相关试卷
-
1、常温下,下列各离子组在指定溶液中能大量共存的是( )A、在溶液中:、、、 B、的溶液中:、、、 C、使石蕊变红的溶液中:、、、 D、的溶液中:、、、
-
2、用NA表示阿伏加德罗常数的数值,下列说法错误的是( )A、28 g乙烯和丙烯的混合气体充分燃烧,消耗的O2分子数为3NA B、0.2 mol FeCl3水解形成的Fe(OH)3胶体粒子数小于0.2NA C、标准状况下,2.24 L新戊烷中电子的数目为3.4NA D、含0.2 mol H2SO4的浓硫酸与足量的镁反应,转移的电子数大于0.2NA
-
3、中国传统文化中蕴含着许多化学知识,下列分析错误的是( )A、“绚丽丝绸云涌动,霓裳歌舞美仙姿”中“丝绸”的主要成分是纤维素 B、“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中涉及过滤操作 C、“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 D、“火树银花合,星桥铁索开”,其中的“火树银花”涉及到焰色试验
-
4、稀土元素是国家战略资源,目前我国稀土提炼技术处于世界领先地位。某课题组以废显示屏玻璃碴(含较多的、、、及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
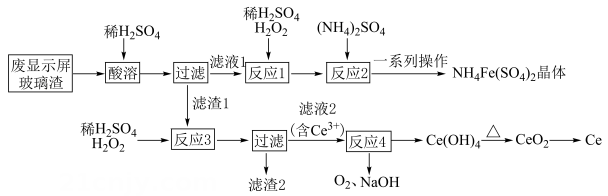
已知:不溶于稀硫酸,也不溶于溶液。
回答下列问题:
(1)、为提高“酸溶”的速率,可采取的措施是(填一种);可用于检验“滤液1”中含有的 , 中铁元素的化合价为价价。(2)、获得晶体的“一系列操作”包含蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干,则晶体的溶解度随温度的变化关系为。(3)、“滤渣2”中主要成分的化学式为;“反应3”的离子方程式为 , 其中的作用与“反应1”中的作用(填“相同”或“不相同”)。(4)、“反应4”的离子方程式为。(5)、可用作净水剂,其净水原理是(用离子方程式表示)。等物质的量浓度的下列三种溶液中,浓度由小到大的顺序是(用标号表示)。①溶液 ②溶液 ③溶液
(6)、取上述流程中得到的产品 , 加稀硫酸溶解后,用标准溶液滴定至终点时(铈被还原为),消耗标准溶液的体积为 , 则测得该产品中Ce元素的质量分数约为(保留三位有效数字)。 -
5、汽车尾气中含有、CO,排气管内的催化转化器可实现将污染性气体转化为和。(1)、已知:①
②
③
则与反应生成和的热化学方程式为。该反应在(填“高温”或“低温”)下可自发进行。
(2)、的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应(填对应序号);中间产物的化学式为。
(3)、利用如图装置可测定汽车尾气中CO的含量,电解质为氧化钇和氧化钠,该电池中可以在固体介质(固熔体)内自由移动。
工作时,多孔电极a为极,多孔电极b处发生的电极反应为。
(4)、一定温度下,起始时向的恒容密闭容器中充入、 , 仅发生反应 , 起始气体总压强为 , 时反应达到平衡,此时气体总压强为起始压强的。①内, , NO转化率=(保留三位有效数字)%。
②此温度下,该反应的平衡常数(是用平衡分压代替平衡浓度计算的平衡常数)。
-
6、亚硝酰氯( , 熔点为℃,沸点为℃)是一种红褐色液体或黄色气体,遇水反现生成一种氢化物和两种氧化物,可用于合成清洁剂、触媒剂及中间体等。某学习小组在实验室中用和NO制备。请回答下列问题:(1)、原料气NO和的制备。

①如图中盛有碱石灰的仪器名称是。实验室制备NO的反应的离子方程式为。
②实验室制备可选择图中的装置(填标号);制备并收集干燥的的装置连接顺序:a→(按气流方向,用小写字母表示)。
(2)、利用制得的NO和制备亚硝酰氯 , 装置如图所示。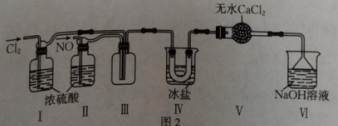
①装置Ⅰ、Ⅱ除可进一步干燥NO、外,另一个作用是。
②装置Ⅳ的作用是;若无装置Ⅴ,则装置Ⅳ中可能发生反应的化学方相式为。
③查阅资料知,王水是浓硝酸与浓盐酸的混合酸,一定条件下该混合酸可自身反应生成亚硝酰氯、氯气和水,该反应的化学方程式为。
-
7、我国化学家侯德榜创立了中国人自己的制碱工艺——侯氏制碱法(联合制碱法),为我国乃至世界的制碱工业做出了巨大贡献。以粗盐为原料的工业生产工艺流程图如图:

已知:“流程Ⅱ”中反应为。
请回答下列问题:
(1)、“流程Ⅰ”是对原料粗盐进行提纯的过程,其中试剂1为(填化学式,下同)溶液,试剂2为溶液。(2)、“流程Ⅱ”中向滤液1中先通入 , 再通入 , 顺序(填“能”或“不能”)颠倒,理由是。(3)、“流程Ⅲ”中灼烧的产物中可循环利用的物质为(填化学式)。(4)、某化学兴趣小组利用下列装置在实验室模拟侯氏制碱法制纯碱。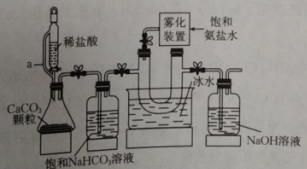
支管a的作用是 , 雾化装置的优点有。
(5)、制得的纯碱中只含有氯化钠杂质,现取产品样品 , 将其放入干净的烧杯中,加入水,使其完全溶解。向所得溶液中慢慢加入溶质质量分数为14.6%的稀盐酸,烧杯中溶液的质量与加入盐酸的的质量关系曲线如图所示。(设全部逸出,且只有气体逸出)。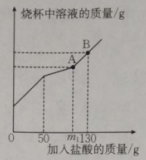
①该产品样品中,含碳酸钠的质量为(计算结果精确至)。
②A点时,此温度下所得不饱和溶液中溶质质量分数为(计算结果精确至0.1%)。
-
8、常温下,用调节浊液的pH,测得在通入的过程中,体系中(X代表或)与的关系如图所示。下列说法正确的是( )。
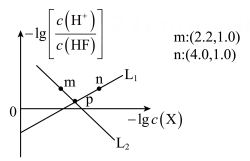
已知:为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A、 B、随着的加入,溶解度逐渐减小 C、p点对应的溶液中 D、M、n点时的溶液中均存在 -
9、工业上利用和在催化剂的作用下合成 , 发生如下反应: 。现于一定条件下向的密闭容器中充入一定量的和发生反应,测得在不同压强下平衡体系中的转化率随温度的变化情况如图所示。下列说法正确的是( )。
 A、 , B、在、条件下,d→a的过程中,正、逆反应速率之间的关系: C、a、b、c三点对应的平衡常数、、的大小关系是 D、b→c的过程,正反应速率变小,逆反应速率变大
A、 , B、在、条件下,d→a的过程中,正、逆反应速率之间的关系: C、a、b、c三点对应的平衡常数、、的大小关系是 D、b→c的过程,正反应速率变小,逆反应速率变大 -
10、某固体混合物可能含有Al、、、、、中的一种或几种,现对该混合物做如图实验,所得现象和有关数据如图(气体体积均已换算成标准状况下的体积)。下列说法错误的是( )。
 A、“步骤①”中发生了反应 B、“步骤②”和“步骤③”中反应消耗的的物质的量之比大于 C、混合物中一定含有Al、、、 , 不含有 D、混合物中一定不含有 , 可能含有和
A、“步骤①”中发生了反应 B、“步骤②”和“步骤③”中反应消耗的的物质的量之比大于 C、混合物中一定含有Al、、、 , 不含有 D、混合物中一定不含有 , 可能含有和 -
11、一种用氢气制备双氧水的反应机理如图所示(按①②③的反应顺序进行)。下列有关说法正确的是( )。
 A、和中存在的化学键类型完全相同 B、和均为该反应的催化剂 C、反应①中每消耗 , 转移电子 D、整个反应过程只涉及氧化还原反应
A、和中存在的化学键类型完全相同 B、和均为该反应的催化剂 C、反应①中每消耗 , 转移电子 D、整个反应过程只涉及氧化还原反应 -
12、如图所示,利用电化学原理可同时吸收处理和NO,下列说法正确的是( )。

已知是一种弱酸,不考虑与水的反应及能量损耗。
A、b极为直流电源的负极 B、阳极区电极反应为 C、理论上,在相同条件下,该装置吸收的和NO的体积比为 D、电路中若有电子转移,则被吸收的气体体积为 -
13、以、炭粉、氯化钙等为原料,采用下列流程可制备粉状(一种压电材料)。

已知:①“焙烧”后固体产物有、易溶于水的和微溶于水的;
②“沉淀”步骤中加入的试剂适量,反应生成。
下列叙述错误的是( )。
A、“焙烧”时炭粉作还原剂,氧化剂与氧化产物的物质的量之比为 B、“滤渣1”的主要成分是和炭粉 C、“沉淀”反应的化学方程式为 D、流程中涉及了过滤操作.实验室中完成该操作所需的玻璃仪器有漏斗、烧杯和玻璃棒 -
14、下列离子组能大量共存,且加入对应的试剂发生反应的离子方程式正确的是( )。
选项
离子组
加入的试剂
离子方程式
A
、、
少量溶液
B
、、
少量溶液
C
、、
少量溶液
D
、、
足量铁粉
A、A B、B C、C D、D -
15、X、Y、Z、W为原子序数依次增大的短周期主族元素,X与Z同主族,Z的最外层电子数是内层电子总数的一半,Y的原子半径在短周期主族元素中最大。下列说法正确的是( )。A、简单离子半径:Y>X B、最高价氧化物对应水化物的酸性:W>Z C、与含有的化学键的类型相同 D、W的最简单氢化物常温下为液态
-
16、下列装置可以达到相应实验目的的是( )。
A
B
C
D

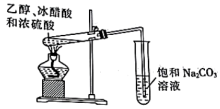
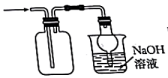

分离乙醇和水
实验室制乙酸乙酯
收集并吸收多余尾气
探究化学反应速率的影响因素
A、A B、B C、C D、D -
17、从中草药中提取的M的结构简式如图。关于M的说法正确的是( )。
 A、一个M分子中含有20个碳原子 B、在酸性条件下的水解产物只有1种 C、苯环上氢原子发生氯取代时,其一氯代物有3种 D、该分子最多与发生加成反应
A、一个M分子中含有20个碳原子 B、在酸性条件下的水解产物只有1种 C、苯环上氢原子发生氯取代时,其一氯代物有3种 D、该分子最多与发生加成反应 -
18、氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是( )。
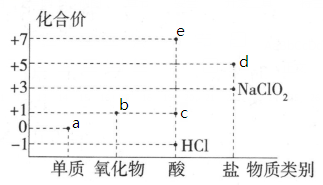 A、c在光照条件下很容易分解 B、b不是酸性氧化物,因为它没有对应的含氧酸 C、图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 D、将a通入溶液中,已知生成、和d的混合物,若与之比为 , 则氧化剂与还原剂的物质的量之比为
A、c在光照条件下很容易分解 B、b不是酸性氧化物,因为它没有对应的含氧酸 C、图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 D、将a通入溶液中,已知生成、和d的混合物,若与之比为 , 则氧化剂与还原剂的物质的量之比为 -
19、下列实验方案能达到实验目的(或所得结论正确)的是( )。A、用玻璃棒蘸取溶液点在pH试纸上测溶液的pH B、用湿润的淀粉KI试纸区分溴蒸气与二氧化氮气体 C、向溶液中通入 , 验证非金属性:C>Si D、向某溶液中滴入溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,则该溶液一定是铵盐溶液
-
20、下列有关化学用语正确的是( )。A、聚丙烯的结构简式: B、核外有a个电子、b个中子,M的原子符号: C、的电子式: D、乙酸的结构式: