相关试卷
-
1、下列说法正确的是( )A、向溶液中慢慢滴加少量稀盐酸,无明显现象 B、溶液中含少量NaOH杂质,可通入过量除去 C、向晶体中加入少量水,伴随放热现象 D、相同温度下相同浓度的两溶液,碱性:
-
2、下列反应的离子方程式不正确的是( )A、向溶液中加入NaOH溶液: B、向NaOH溶液中加入金属铝: C、酸化的溶液暴露于空气中: D、溶液中滴加少量溶液:
-
3、下列说法正确的是( )A、道尔顿提出原子、分子学说 B、的近似相对原子质量为18 C、原子核外电子排布中,次外层电子数是2或8或18 D、考古学常用来测定文物的年代,分析古代人类的食物结构
-
4、下列变化中一般需要加入氧化剂才能实现的是( )A、 B、 C、 D、
-
5、下列离子能在溶液中大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、
-
6、下列说法正确的是( )A、氯水和液氯都可以存放在钢瓶中 B、新制氯水的pH会随光照时间增长而增大 C、HCl溶于水形成水合氯离子和 D、NaCl溶液通电后产生自由移动的离子
-
7、有关的说法正确的是( )A、在干燥空气中最终变成 B、与足量水反应,转移2mol电子 C、与足量反应,固体质量增加14g D、加入滴有酚酞的水中,观察到溶液颜色先变红后褪去
-
8、下列反应的生成物与反应条件或用量无关的是( )A、Na与 B、与NaOH C、Fe与 D、与
-
9、下列说法正确的是( )A、用pH试纸可测定氯水的pH B、固体保存在棕色细口瓶中 C、中含有的HCl气体可通过饱和溶液除去 D、实验室存放的KI溶液会变黄色,是由于KI被氧化
-
10、下列说法正确的是( )A、、、互为同位素 B、金刚石与互为同素异形体 C、与的相互转化是物理变化 D、科学家发现一种物质 , 不可能分解生成
-
11、下列反应中,是氧化剂的是( )A、 B、 C、 D、
-
12、钠在坩埚中做燃烧实验时用不到的仪器或用品是( )A、酒精灯
 B、三脚架
B、三脚架 C、石棉网
C、石棉网 D、泥三角
D、泥三角
-
13、下列物质属于碱性氧化物的是( )A、 B、 C、 D、
-
14、下列物质属于电解质的是( )A、盐酸 B、干冰 C、胆矾 D、石墨
-
15、以某工业废锰渣(含MnO2及少量KOH、MgO、Fe2O3)为原料制备MnSO4晶体,其工艺流程如下:
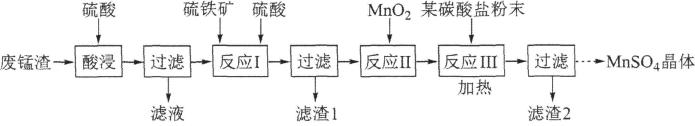
该工艺条件下金属离子开始沉淀和完全沉淀(c≤10-5mol/L)的pH如表所示:
金属离子
Fe3+
Fe2+
Mn2+
Mg2+
开始沉淀pH
2.10
7.45
9.27
9.60
完全沉淀pH
3.20
8.95
10.87
11.13
(1)、“反应I”中加入硫铁矿(主要成分FeS2)将MnO2还原为Mn2+。滤渣1的主要成分除FeS2外,还有一种相对分子质量为192的单质,该物质的化学式为。(2)、“反应I”的离子方程式为。(3)、“某碳酸盐”的化学式 , 加热的目的是。(4)、为检验MnSO4受热分解是否生成SO2或SO3 , 某同学设计探究实验装置如图所示: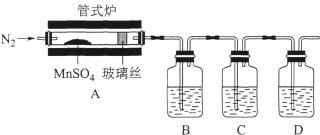
①装置B、C、D中的溶液依次为(填字母)。
a.Ba(NO3)2b.BaCl2c.品红 d.浓硫酸e.Ca(OH)2 f.NaOH
②实验结束时,为防止倒吸,正确的操作方法是。
(5)、测定产品纯度。取制得的MnSO4晶体0.1510g,溶于适量水中,加硫酸酸化;用过量NaBiO3(难溶于水)将Mn2+完全氧化为 , 过滤;洗涤未溶解固体2-3次,向滤液中加入Na2C2O4固体0.5360 g,振荡,充分溶解并反应后,用0.0320 mol·L-1KMnO4溶液滴定(被还原为Mn2+),用去20.00 mL。已知:Mr(Na2C2O4)=134,Mr(MnSO4)=151。①计算产品中MnSO4的质量分数(保留两位有效数字)。
②为提高测定的精度,应补充的实验操作。
-
16、废旧太阳能电池ClGS具有较高的回收利用价值,其主要组成为Culn0.5Ca0.5Se2。某探究小组回收处理流程如图:
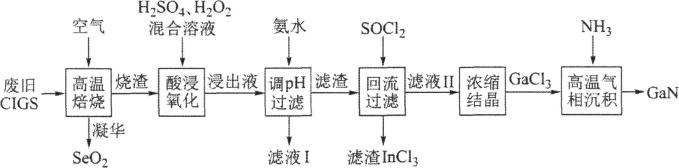
回答下列问题:
(1)、硒(Se)与硫为同族元素,Se的最外层电子数为;在化合物Culn0.5Ca0.5Se2中镓(Ga)和铟(In)均为+3价,则Cu的化合价为。(2)、“酸浸氧化”得蓝色溶液,则该过程发生的主要氧化还原反应的化学方程式为。(3)、氢氧化铜沉淀可溶于氨水,则滤液I中的阴离子主要有和两种。(4)、滤渣加入SOCl2混合前需要洗涤、干燥,并用试剂和来检验滤渣中的是否洗净。(5)、滤渣加入SOCl2可反生反应:2In(OH)3+3SOCl2=2InCl3+3X;对物质X的性质有如下判断,你认为不正确的是____。
A、有弱酸性 B、可使溴水褪色 C、与CaCl2溶液反应得白色沉淀 D、与烧碱溶液反应可生成两种盐(6)、“高温气相沉积”过程中发生的化学反应方程式为。 -
17、实验室制备SO2并探究其性质的方案如下,回答下列问题(1)、Ⅰ.制备SO2(部分固定装置略)

制备SO2可以选择的发生装置为(填大写字母)。(2)、选用如图装置制备并收集一瓶干燥的SO2 , 其连接顺序为:发生装置→(按气流方向,填小写字母)。(3)、Ⅱ.探究SO2与Cu(OH)2悬浊液的反应查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:i.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的
颜色有明显不同。

配制Cu(OH)2悬浊液时,要保证溶液过量。(填“NaOH”或“CuSO4”)
(4)、为确定红色固体成分,进行如图实验:
①根据上述实验可得结论:该红色固体为。
②产生红色固体的原因是(用离子方程式表示)。
(5)、为探究F中溶液呈绿色而不是蓝色的原因,实验如下:ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝
色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验i的目的是。
②溶液显绿色的原因可能是溶液中含有较多Cu (HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入(填化学式),得到绿色溶液。
-
18、(1)、书写对应的化学方程式:
①用氯气制备漂白粉:。
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:。
③呼吸面具中过氧化钠与二氧化碳反应:。
④KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2气体,还生成CO2和KHSO4等物质。写出该反应的化学方程式。
(2)、书写对应的离子方程式:⑤制作印刷电路板时氯化铁溶液腐蚀铜:。
⑥用高锰酸钾酸性溶液检验溶液中的亚铁离子(还原产物为Mn2+):。
⑦在酸性条件下,向含铬废水中加入FeSO4 , 可将还原为Cr3+ , 该过程的离子
反应方程式为。
-
19、为探究新制氯水的性质,某学生做了如下实验。由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是( )
实验 装置 试剂a 现象 ① 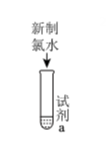
紫色的石蕊试液 溶液先变红后褪色 ② NaHCO3溶液 产生气泡 ③ HNO3酸化的AgNO3溶液 产生白色沉淀 ④ FeCl2溶液、KSCN溶液 溶液变红 A、实验①说明新制氯水中含有H+、HClO B、实验②发生的反应为+HClO=ClO-+CO2↑+H2O C、实验③说明新制氯水中有Cl- , Cl- +Ag+=AgCl↓ D、实验④说明氯气具有强氧化性,Cl2+2Fe2+=2Cl-+ 2Fe3+ -
20、在酸性环境中,纳米Fe/Ni复合材料去除污染水体的的反应过程(Ni不参与反应)如图所示:下列表达反应过程或现象的方程式错误的是( )
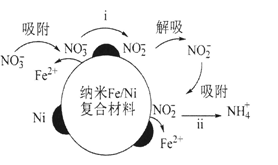 A、反应步骤i:+Fe+2H+ =+Fe2++H2O B、反应步骤ⅱ:+3Fe+8H+= 3Fe2+++2H2O C、反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终变
A、反应步骤i:+Fe+2H+ =+Fe2++H2O B、反应步骤ⅱ:+3Fe+8H+= 3Fe2+++2H2O C、反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终变成红褐色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
D、硝酸亚铁溶液中滴加稀硫酸发现溶液变黄:2Fe2+++4H+= 2Fe3++SO2↑+ 2H2O