相关试卷
-
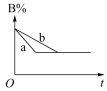
1、对于化学反应 , 某研究小组经研究后绘制了4幅图像,下列说法正确的是( )


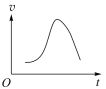
图a
图b
图c
图d
A、由图 a 可知该反应 ΔH >0 B、由图 b 可知,该反应 a+b<c C、若图 c 是绝热条件下速率和时间的图象,由此说明该反应吸热 D、图 d 中,曲线 a 一定增加了催化剂 -
2、我国科研人员提出了由 CO2和 CH4 转化为高附加值产品CH3COOH 的催化反应历程,该历程如图所示:下列说法正确的是( )
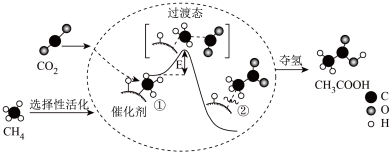 A、该反应为吸热反应 B、反应过程中,只有 C-H 键发生断裂 C、状态①②之间的能量差即该反应的焓变 D、反应速率与催化剂表面积有关
A、该反应为吸热反应 B、反应过程中,只有 C-H 键发生断裂 C、状态①②之间的能量差即该反应的焓变 D、反应速率与催化剂表面积有关 -
3、下列关于如图所示转化关系(X 代表卤素)的说法不正确的是( )
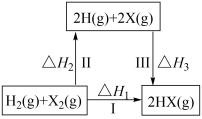 A、ΔH2> 0 B、 C、HX(g)分解反应,正反应活化能比逆反应大 D、按照 Cl、Br、I的顺序,ΔH3 依次减少
A、ΔH2> 0 B、 C、HX(g)分解反应,正反应活化能比逆反应大 D、按照 Cl、Br、I的顺序,ΔH3 依次减少 -
4、某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列说法中正确的是( )
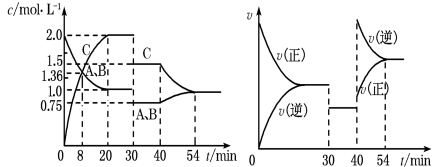 A、30min时降低温度,40min时升高温度 B、反应方程式中的x=1,正反应为吸热反应 C、8min前A的平均反应速率为0.08mol/(L·min) D、30min~40min间该反应使用了催化剂
A、30min时降低温度,40min时升高温度 B、反应方程式中的x=1,正反应为吸热反应 C、8min前A的平均反应速率为0.08mol/(L·min) D、30min~40min间该反应使用了催化剂 -
5、T1 时,在 1L 的密闭容器中进行反应: , A、B 的起始浓度均为 0.5mol·L-1 , 起始压强为 p0 , 反应达到平衡状态时压强为p,且 , 下列说法不正确的是( )A、T1 时,该反应的 K= B、T1时,A 的平衡转化率为 80% C、升高温度,平衡常数为 100,可知该反应为吸热反应 D、T1达到平衡时,再充入 0.1molC 和 0.1molB,则平衡将正向移动
-
6、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法: , 则 H-H 键的键能为( )
化学键
C-H
H-O
键能/kJmol-1
414
1068
463
A、436 B、573 C、273 D、419 -
7、关于一定条件下的化学平衡 , 下列说法正确的是( )A、升高温度,ν (正)减小,ν(逆)增大,平衡左移 B、增大压强,ν(正)、ν(逆)不变,平衡不移动 C、恒温恒容,充入 H2 , ν (正)增大,平衡右移 D、恒温恒压,充入 He,ν(正)减小,平衡右移
-
8、一定温度下,在 2L 密闭容器中发生该反 应,下列说法不正确的是( )
物质
A
B
C
初始量/mol
1
2
0
平衡量/mol
0.5
A、反应达到平衡时,B 的转化率为 50% B、改变温度可改变此反应的平衡常数 C、反应前后压强保持不变 D、反应达平衡后,再充入 1mol A 与 2mol B,则达到新平衡后 C 的百分含量不变 -
9、恒温下, 该反应达到平衡时 CO2浓度为 a mol•L-1 , 再充入 CO2使其浓度变为 2a mol•L-1 , 再次达到平衡后 CO2浓度为( )A、2a B、a C、介于 a 与 2a 之间 D、>2a
-
10、下列说法正确的是( )A、催化剂可以降低反应的活化能,从而改变化学反应速率,影响平衡移动 B、加入或减少反应物的量,可以提高活化分子百分数,从而提高反应速率 C、升高温度能改变化学反应速率主要原因是增加了反应物中活化分子的百分数 D、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
-
11、下列事实不能用勒夏特列原理解释的是( )A、棕红色 NO2加压后颜色最终变深 B、氯气中混有氯化氢气体用饱和食盐水除杂 C、工业生产硫酸中使用过量的空气来提高 SO2 的转化率 D、已知 , 升高温度,混合气体颜色变深
-
12、下列说法正确的是( )A、已知中和热 ΔH=-57.3kJ·mol-1 , 则 含1mol H2SO4的稀 H2SO4溶液和足量 Ba(OH)2溶液充分反应,放出热量114.6kJ B、已知在一定条件下, , 则该反应消耗 2mol N2后放出热量 184.8kJ C、甲烷的标准燃烧热 ΔH=–890.3kJ·mol-1 , 则 D、 , 则∆H1>∆H2
-
13、在反应中,其他条件不变,采取下列措施,既能加快反应速率又能使平衡正移的是( )A、缩小体积 B、增加碳的量 C、恒容通入 CO2 D、恒容通入 N2
-
14、一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法不正确的是( )
 A、Ea 为正反应活化能,Ea'为逆反应活化能 B、该反应为放热反应,△H=Ea-Ea' C、温度升高,降低反应活化能,化学反应速率增大 D、所有活化分子的平均能量高于所有分子的平均能量
A、Ea 为正反应活化能,Ea'为逆反应活化能 B、该反应为放热反应,△H=Ea-Ea' C、温度升高,降低反应活化能,化学反应速率增大 D、所有活化分子的平均能量高于所有分子的平均能量 -
15、下列有关仪器使用或实验操作说法正确的是( )A、容量瓶、分液漏斗和蒸馏烧瓶使用前一定要检漏 B、锥形瓶、烧杯和蒸发皿都不能用酒精灯直接加热 C、用托盘天平称量 5.10 克氯化钠固体 D、中和热测定时每组实验温度计至少使用 3 次
-
16、恒温恒容下反应达到平衡状态时,再通入一定量的 N2。下列说法正确的是(K 为平衡常数,Q 为浓度商)( )A、Q 不变,K 变大,H2 转化率增大 B、Q 增大,K 变大,N2转化率减小 C、Q 变小,K 不变,N2 转化率减小 D、Q 增大,K 不变,H2转化率增大
-
17、下列说法正确的是( )A、若反应 , 则该反应在较低温度下不能自发 B、熵增的反应都是自发的,现象一定非常明显 C、若反应中反应物总键能低于生成物总键能,则该反应为吸热反应 D、科学家应大力研究 的条件,从而解决含碳不充分燃烧引起的环境问题
-
18、工业上二氧化硫制备三氧化硫时,采用 500℃左右的温度,其原因是( )
①提高 SO2 的转化率
②提高 O2 的转化率
③适当加快 SO3 的合成速率
④催化剂在 500℃左右时活性最好
A、①② B、① C、③④ D、①②④ -
19、在中,表示该反应速率最快的是( )A、v(A)=0.5mol•L-1•min-1 B、v(B)=1.2mol•L-1•min-1 C、v(C)=0.9mol•L-1•min-1 D、v(D)=1mol•L-1•min-1
-
20、下列说法不正确的是( )A、化学反应中的能量变化以物质变化为基础 B、所有的反应热都可以由量热计直接测得 C、其他条件相同,升高温度,化学反应速率加快 D、实验中可以通过定性观察的方法来比较反应速率的大小