相关试卷
-
1、某化学反应其△H=-122 kJ/mol,∆S=231 J/(mol·K),则此反应在下列哪种情况下可自发进行( )A、在任何温度下都能自发进行 B、在任何温度下都不能自发进行 C、仅在高温下自发进行 D、仅在低温下自发进行
-
2、下列化学反应中,反应物总能量高于生成物总能量的是( )A、碳酸氢钠与盐酸反应 B、浓硫酸溶于水 C、石灰石分解 D、醋酸与氢氧化钠反应
-
3、下列关于反应热的叙述正确的是( )A、需要加热的反应一定是吸热反应 B、放热反应不需要加热 C、化学反应中旧键断裂需要吸收能量,新键生成会释放能量 D、若 , 则 SO2(g)的能量大于 SO3的能量
-
4、为探究一种矿石()的组成,已知矿石不含其他杂质,铁元素呈+2、+3价,氧元素为-2价。称取1.504g样品用足量的稀硫酸溶解,所得溶液用的溶液恰好使+2价铁元素氧化为+3价,同时Cr元素被还原为+3价。另取1.504g样品用足量的还原,得固体1.120g。请回答:(1)、实验用稀硫酸溶解矿石而不用盐酸,原因是(用文字或用方程式表述均可)。(2)、矿石的化学组成为。(3)、若无“另取1.504g样品用足量的还原,得固体1.120g”的数据,能否求得该矿石的组成:(填“能”或“否”)。
-
5、物质A是由四种短周期元素组成的带结晶水的化合物,为测定其组成进行如下实验:

已知:固体D、沉淀F既能溶于酸又能溶于碱,所加试剂均过量。
请回答下列问题:
(1)、组成A的元素除H、O外还有(写元素符号),A的化学式为。(2)、A灼烧的化学方程式为。(3)、写出溶液E生成F的离子方程式:。(4)、溶液E中存在的阳离子是(填离子符号),检验金属阳离子的具体操作是。 -
6、用下列装置制备溶液,装置B中放入溶液。(部分夹持装置已省略)

请回答下列问题:
(1)、多孔球泡的作用是。(2)、NaOH溶液的作用是。(3)、装置B中反应的离子方程式为。(4)、装置A可制备 , 写出反应的化学方程式,并用单线桥法标出电子转移方向和数目:。(5)、当发生反应时,被氧化的的物质的量为mol。 -
7、(1)、I.欲配制的溶液,可供选用的仪器有①烧杯②托盘天平③药匙④玻璃棒⑤胶头滴管⑥量筒,请回答下列问题:
需要称量固体的质量为g。(2)、配制溶液,还缺少的仪器是。(3)、从下面的操作中,排列正确的操作顺序:(填标号)。①称量固体
②用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也注入容量瓶
③固体在烧杯中溶解,恢复至室温,并将溶液注入容量瓶
④容量瓶验漏
⑤将配制好的溶液倒入试剂瓶,并贴上标签
⑥注入蒸馏水,当液面离容量瓶颈部的刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切将配制好的溶液倒入试剂瓶,并贴上标签,标签是。
(4)、下列某些操作会导致所配溶液浓度有误差:①所用的容量瓶未干燥
②所用的烧杯、玻璃棒未洗涤
③定容后,摇匀时发现溶液液面低于刻度线,再滴加蒸馏水
④定容时俯视刻度线
⑤定容时超过刻度线,用胶头滴管吸出溶液
以上操作对所配溶液浓度无影响的是(填标号,以下同),以上操作导致所配溶液浓度偏低的是。
(5)、II.对是否可用溶液鉴别溶液和溶液有争议,本实验为解决这个问题而设计,如图所示:把的溶液滴加到配制好的的溶液中,结果发现,装置A、B中均有白色沉淀产生,同时装置A烧瓶中产生气体。请回答:
向烧瓶中滴加溶液的操作是。
(6)、烧杯中发生反应的化学方程式为。(7)、烧瓶中发生反应的离子方程式为。结论:三者浓度较大时,不能根据是否有沉淀生成鉴别溶液和溶液。
-
8、请按要求填空。(1)、写出磁性氧化铁的化学式:。(2)、碘水与溶液混合,生成了 , 写出反应的离子方程式:。(3)、溴水与溶液反应有淡黄色AgBr沉淀生成,写出反应的离子方程式:。(4)、已知在一定温度下,溴与NaOH溶液反应,产物中NaBrO与的物质的量之比为3:1,写出反应的化学方程式:。
-
9、下图为周期表的主族元素的一部分,L原子最外层电子数是次外层电子数的一半。
X
Z
R
W
L
J
Q
M
(1)、写出M的元素符号:。(2)、写出R在元素周期表中的位置:。(3)、最高价氧化物对应水化物的碱性:R(填“>”“<”或“=”,下同)W。(4)、气态氢化物的稳定性:ZX。(5)、R、W、Z的简单离子的半径由大到小的排列顺序是(用元素的离子符号表示)。(6)、下列说法不正确的是____(填标号)。A、Q、M的最高价氧化物对应的水化物酸性:M<Q B、L元素的单质具有半导体的特性,与Z可形成 C、W、Z形成的化合物既能与酸反应又能与碱反应 D、M的单质的氧化性大于Q -
10、下列方案的设计、现象和结论正确的是( )
实验目的
方案设计
现象与结论
A
检验Fe与水蒸气反应的产物
将反应后的固体溶于盐酸,滴加KSCN溶液
溶液未呈红色,说明无+3价铁元素生成
B
证明溶于水部分与水反应
将溶于水,观察氯水颜色,再滴加紫色石蕊试液
若观察到氯水为淡黄绿色,且滴加石蕊试液溶液先变红后褪色,说明溶于水部分与水反应
C
检验某溶液中是否存在
向溶液中加入溶液,再加稀硝酸
产生白色沉淀,加稀硝酸,沉淀不溶解,说明溶液中存在
D
证明卤素单质的氧化性
向KBr溶液中加入过量氯水,再加入KI-淀粉溶液
溶液先变橙色,再变蓝色,说明氧化性:
A、A B、B C、C D、D -
11、利用表面含有油污的废旧铁屑制备粒子,流程如下:

下列说法正确的是( )
①溶液的作用是除去铁屑表面的油污
②控制的用量是使部分被氧化成
③溶液也可以用或溶液代替
④溶液A制的离子方程式是
⑤过滤后洗涤固体时,加入水浸没沉淀物并用玻璃棒轻轻搅拌
A、①④⑤ B、①②③ C、①②④ D、①②③④⑤ -
12、已知: , 。下列表达不正确的是( )A、可判断不存在溶液 B、向溶液中通入少量 , 离子方程式为 C、还原性: D、向含的溶液中通入(标准状况下),离子方程式为
-
13、已知反应①
反应②
下列说法不正确的是( )
A、根据反应①判断,是一元酸 B、反应②说明,酸性: C、是一元碱 D、向溶液中滴加盐酸先产生沉淀后沉淀溶解 -
14、已知卤素互化物(例如BrCl)、拟卤素[例如]等物质的性质与单质相似,下列相关反应的方程式不正确的是( )A、 B、 C、 D、
-
15、关于114号元素的预测或判断不正确的是( )A、该元素是一种金属元素 B、该元素处于第七周期第VIA族 C、该元素的主要化合价为+2、+4 D、该元素是一种放射性元素
-
16、将溶液滴入沸水中制备氢氧化铁胶体,涉及的反应为 , , 胶体的结构如图,胶核、胶粒难解离,胶团可电离。下列说法不正确的是( )
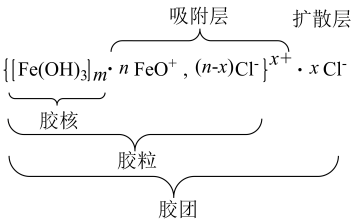 A、扩散层的可电离成自由移动的离子 B、胶体是电中性
A、扩散层的可电离成自由移动的离子 B、胶体是电中性 C、胶粒带正电
D、含的胶体中,存在胶体粒子数约为
C、胶粒带正电
D、含的胶体中,存在胶体粒子数约为
-
17、下列物质的用途与其性质相对应的是( )
①可用于蚀刻铜电路板,是由于其具有氧化性
②硬铝常用于制造飞机的外壳,是由于其密度小、强度高等特点
③钠钾合金可用作核反应堆的传热介质,是由于钠钾合金熔点低、流动性好等特点
④HClO可用作棉、麻和纸张的漂白剂,是由于其具有弱酸性
⑤可在呼吸面具中作为氧气的来源,是由于能与水或反应生成
A、①②③④⑤ B、①②③⑤ C、①③⑤ D、①③④⑤ -
18、设为阿伏加德罗常数的值,下列说法不正确的是( )A、含有H原子数为b个,则为 B、0.2molFe与足量的在一定条件下充分反应,转移电子数为 C、固体中含有的离子数为 D、溶液含 , 稀释到1000mL时,的浓度为(不考虑水解)
-
19、下列处理方法正确的是( )A、实验未用完的药品都可以扔到废液缸里 B、若不慎将酸沾到皮肤上,立即用水冲洗,然后涂上1%的硼酸 C、火灾现场存在大量活泼金属时,要用干燥的沙土灭火 D、轻微烫伤或烧伤时,可先用洁净的热水处理,然后涂上烫伤药膏
-
20、短周期元素X、Y、Z和M在周期表中的位置如图,其中X的单质在标准状态下的密度为。下列说法正确的是( )
X
Z
Y
M
A、Y的原子半径比M的小 B、M的氧化物对应水化物为强酸 C、X元素在地壳中含量最多 D、M元素的非金属性比Z的弱