相关试卷
-
1、一种可充电锌—空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以的形式存在,并存在。下列说法正确的是( )
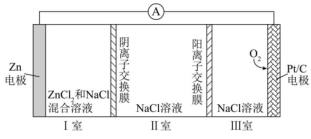 A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g
A、放电时,Ⅰ室溶液pH增大 B、放电时,该装置Ⅱ室可实现海水淡化 C、充电时,Zn电极反应为 D、充电时,每生成 , Ⅲ室溶液质量理论上减少32g -
2、下列关于物质应用的说法错误的是( )A、在医疗上,可用作钡餐 B、食用纯碱可用作食品添加剂 C、可用于制作抗胃酸药品“胃舒平” D、将铁粉、食盐和活性炭等混合可用于制作一次性保暖贴
-
3、已知:的能量变化如图所示,有关叙述正确的是( )
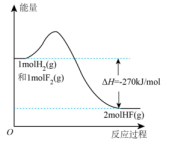 A、1mol HF(g)分解生成和需要吸收270kJ的热量 B、断裂1mol H—H键和1mol F—F键吸收的能量大于形成2mol H—F键放出的能量 C、在相同条件下,与的能量总和小于2mol HF(g)的能量 D、与反应生成2mol HF(l)放出的热量大于270kJ
A、1mol HF(g)分解生成和需要吸收270kJ的热量 B、断裂1mol H—H键和1mol F—F键吸收的能量大于形成2mol H—F键放出的能量 C、在相同条件下,与的能量总和小于2mol HF(g)的能量 D、与反应生成2mol HF(l)放出的热量大于270kJ -
4、设为阿伏加德罗常数的值,下列说法正确的是( )A、100g质量分数为46%的乙醇水溶液中含有氧原子数为 B、若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为 C、向大量水中通入1mol氯气,反应中转移的电子数为 D、电解精炼铜,当电路中通过的电子数目为时,阳极质量减少6.4g
-
5、一种用于驱动潜艇的液氨—液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
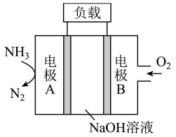 A、电极A为电池的正极 B、电池工作时,向电极B移动 C、电极A上发生的电极反应为: D、该电池工作时,每消耗转移4mol电子
A、电极A为电池的正极 B、电池工作时,向电极B移动 C、电极A上发生的电极反应为: D、该电池工作时,每消耗转移4mol电子 -
6、实验室用石墨电极电解含有酚酞的饱和NaCl溶液,装置如下图所示,下列说法不正确的是( )
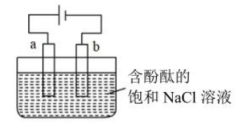 A、a极为电解池的阳极 B、a极发生的电极反应为: C、在电场作用下、向阴极移动 D、b极酚酞变红的原因是:放电,导致正向移动,
A、a极为电解池的阳极 B、a极发生的电极反应为: C、在电场作用下、向阴极移动 D、b极酚酞变红的原因是:放电,导致正向移动, -
7、中国是稀土大国,铈(Ce)是地壳中含量最高的稀土元素,主要存在与独居石中。金属铈在空气中易被氧化变暗,能与水反应,常见的化合价为+3和+4,氧化性:。下列说法正确的是( )A、、、互为同位素 B、可通过电解溶液制得金属铈 C、铈能从硫酸铜溶液中置换出铜: D、溶于氢碘酸的化学方程式可表示为
-
8、下列反应属于氧化还原反应,且是放热反应是( )A、稀醋酸与烧碱溶液反应 B、灼热的炭与的反应 C、铁片与稀盐酸的反应 D、与的反应
-
9、请回答下列问题:(1)、高铁酸钾()不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
图1
 图2
图2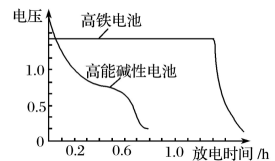
①该电池放电时正极反应式为。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向(填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有。
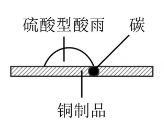
(2)、铜是人类最早使用的金属,它与人类生产、生活关系密切,请运用所学知识解释下列与铜有关的化学现象。甲
 乙
乙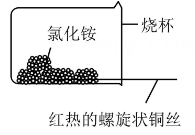
①如图甲,在硫酸型酸雨地区,不纯的铜制品发生电化学腐蚀,Cu发生(填“氧化”或“还原”)反应,写出正极的电极反应式:。
②如图乙,将螺旋状的铜丝在酒精灯上灼烧,铜丝变黑色,然后将红热的铜丝插入固体中,过一会取出,发现插入部分黑色变为光亮的红色,查阅资料可知,该过程有生成,写出由黑色变为光亮红色过程中反应的化学方程式:。
(3)、一定温度下,反应中的某一基元反应为 , 其能量变化如图所示。表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。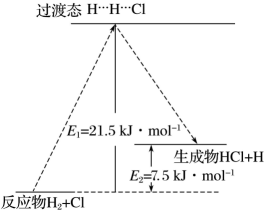
该基元反应的活化能为kJ/mol,为kJ/mol。
(4)、键能也可以用于估算化学反应的反应热()。下表是部分化学键的键能数据:化学键
键能/(kJ/mol)
172
335
498
X
已知白磷的标准燃烧热为-2378kJ/mol,白磷的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中。
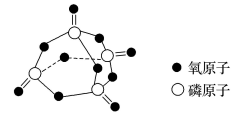
-
10、为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是: 。回答下列问题:(1)、该反应的能量变化如图所示,反应的 , 曲线(填“a”或“b”)表示使用了催化剂。
 (2)、下列措施既能加快反应速率,又能提高CO转化率的是____;A、升高温度 B、增大压强 C、降低温度 D、增加投料量(3)、相同温度下,若已知:
(2)、下列措施既能加快反应速率,又能提高CO转化率的是____;A、升高温度 B、增大压强 C、降低温度 D、增加投料量(3)、相同温度下,若已知:①反应的平衡常数为;
②反应的平衡常数为;
则:反应的化学平衡常数(用含和的代数式表示)。
(4)、在恒温恒容密闭容器中按加入反应起始物Ⅰ.下列描述不能说明反应达到平衡状态的是。
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与的浓度相等 D.容器内CO的体积分数不再变化
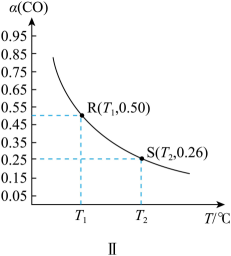
Ⅱ.若CO的平衡转化率[]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:(填“>”、“=”或“<”)。温度下,测得起始压强 , 达平衡时。
-
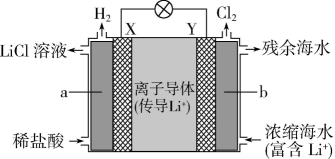
11、电池的种类繁多,应用广泛。根据电化学原理回答下列问题。(1)、电池是一种能被海水激活的一次性贮备电池,电池总反应为 , 则负极材料为 , 正极反应式为。(2)、浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。X极生成时,移向(填“X”或“Y”)极。
 (3)、微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。隔膜1为(填“阴”或“阳”)离子交换膜,负极的电极反应式为 , 当电路中转移0.2mol电子时,模拟海水理论上除盐g。
(3)、微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含的溶液为例)。隔膜1为(填“阴”或“阳”)离子交换膜,负极的电极反应式为 , 当电路中转移0.2mol电子时,模拟海水理论上除盐g。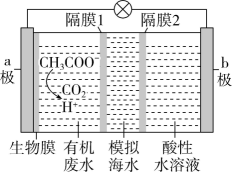
-
12、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物(直径小于等于的悬浮颗粒物),其主要来源为燃煤、机动车尾气等因此,对、、等进行研究具有重要意义。
请回答下列问题:
(1)、为减少的排放,常采取的措施如下:将煤转化为清洁气体燃料。已知: ;
。
写出焦炭与水蒸气反应的热化学方程式:。
(2)、汽车尾气的转化:①NO在催化条件下分解,反应在恒温密闭容器中下进行: ;某温度下,NO平衡转化率为10.0%,该温度下的平衡常数为 , 若某时刻、、分别为2.0mol、1.0mol、0.50mol,此时反应(填序号)。
a.向逆反应方向进行
b.向正反应方向进行
c.达到平衡状态
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:。已知该反应的 , 简述该设想能否实现的依据:。
(3)、清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池,一定条件下用CO和合成: 。向体积为2L的密闭容器中充入2molCO和 , 测得不同条件下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
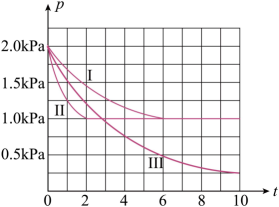
①Ⅱ和Ⅰ相比,改变的反应条件是;
②若反应Ⅰ的温度(),反应Ⅲ的温度(),则(填“小于”、“大于”或“等于”),简要说明判断依据:。
-
13、执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为: , 被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
 A、呼出气体中酒精含量越高,微处理器中通过的电流越小 B、电解质溶液中的移向a电极 C、b为正极,电极反应式为 D、a极上的电极反应式为
A、呼出气体中酒精含量越高,微处理器中通过的电流越小 B、电解质溶液中的移向a电极 C、b为正极,电极反应式为 D、a极上的电极反应式为 -
14、在容积固定为1.00L的密闭容器中,通入一定量的 , 发生反应 , 100℃时体系中各物质的浓度随时间变化如图所示。下列说法正确的是( )
 A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率
A、时刻反应已经达到平衡状态 B、100℃时,反应的平衡常数K为0.36 C、待容器中混合气体的密度不变时,说明反应达到平衡状态 D、100℃时,在0~60s时段反应的平均反应速率 -
15、某种碱性氢氧燃料电池的的正极反应式为:。下列有关该电池的叙述正确的是( )A、负极上发生的反应为 B、工作时,电解质溶液中的向正极移动 C、工作一段时间后,电解液中KOH的物质的量浓度减小 D、若电池在工作过程中有0.4mol电子转移,则正极消耗
-
16、下列对于化学反应方向说法正确的是( )A、一定温度下,反应的 , B、反应 , 则该反应在低温下能自发进行 C、常温下反应能自发进行,则 D、反应在一定条件下能自发进行,则该反应的合金
-
17、科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用CuSi合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
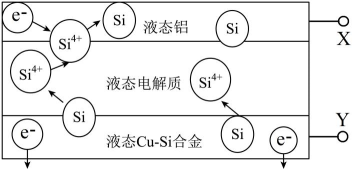 A、X与电源的正极相连 B、电子由液态CuSi合金流出 C、电子能够在三层液熔盐间自由流动 D、在该液相熔体中Cu优先于Si被氧化,优先于被还原
A、X与电源的正极相连 B、电子由液态CuSi合金流出 C、电子能够在三层液熔盐间自由流动 D、在该液相熔体中Cu优先于Si被氧化,优先于被还原 -
18、在密闭容器中的一定量混合气体发生反应: , 平衡时测得C的浓度为0.50mol/L。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90mol/L。下列有关判断不正确的是( )A、B的体积分数增大了 B、A的转化率降低了 C、平衡向正反应方向移动 D、
-
19、反应 达平衡状态后,改变某一条件,下列图像与条件变化一致的是( )A、升高温度
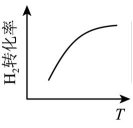 B、增大浓度
B、增大浓度 C、改变压强
C、改变压强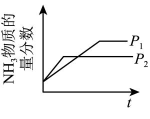 D、加入催化剂
D、加入催化剂
-
20、利用如图所示装置(电极均为惰性电极)可吸收 , 并用阴极排出的溶液吸收。下列说法正确的是( )
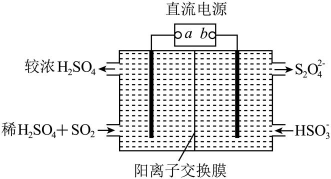 A、b为直流电源的正极 B、将装置中的阳离子交换膜换成阴离子交换膜电极反应式不变 C、电解时,由阴极室通过阳离子交换膜到阳极室 D、阳极的电极反应式为
A、b为直流电源的正极 B、将装置中的阳离子交换膜换成阴离子交换膜电极反应式不变 C、电解时,由阴极室通过阳离子交换膜到阳极室 D、阳极的电极反应式为