相关试卷
-
1、某公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为(制备原料为、和),电解液为的碳酸丙烯酯溶液。下列化学用语正确的是( )A、的电子排布式为: B、基态碳原子的价层电子轨道表示式为
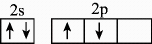 C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
C、中子数为20的氯原子:
D、与同主族,基态原子的简化电子排布式为:
-
2、五育并举,劳动先行。下列生活应用或生产活动,没有运用相应化学知识的是( )
选项
生活应用或生产活动
化学知识
A
用SO2漂白纸张
SO2具有氧化性
B
用铝槽车运输浓硝酸
Al在冷的浓硝酸中发生钝化
C
用铁盐净水
Fe3+水解得到Fe(OH)3胶体
D
用热的纯碱溶液清洗铁屑油污
油脂在碱性条件下可水解
A、A B、B C、C D、D -
3、明矾是一种常用的净水剂,以废易拉罐(主要成分为铅和少量不溶于碱性溶液的物质)为原料制取明矾晶体的实验流程如下:
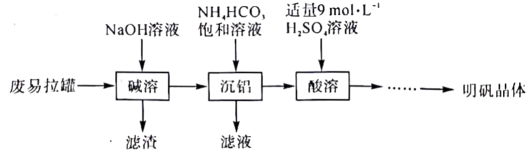
回答下列问题:
(1)、“碱溶”步骤中发生反应的化学方程式为。(2)、“沉铝”步骤在煮沸条件下进行,生成和.检验“沉铝”所得滤液中主要阳离子的定性分析操作为(填操作名称).(3)、由浓硫酸配制250mL“酸溶”所需的溶液需要用到的玻璃仪器有烧杯、玻璃棒、量筒、、。(4)、“酸溶”步骤在如图所示的装置中进行,导管的作用是。圆底烧瓶中发生反应的离子方程式为。
 (5)、“酸溶”所得的溶液经过一系列步骤后可制得明矾晶体.该系列过程中还需要加入的试剂是(填化学式)。
(5)、“酸溶”所得的溶液经过一系列步骤后可制得明矾晶体.该系列过程中还需要加入的试剂是(填化学式)。 -
4、锌、铁、铜及其化合物在生活、生产中有着广泛应用。回答下列问题:
 (1)、基态的核外电子排布式为。在第四周期过渡元素中,基态原子未成对电子数最多的元素为(用元素符号表示)。(2)、一水合甘氨酸锌是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为;从结构角度解释甘氨酸易溶于水的原因。(3)、铜元素的第一电离能、第二电离能分别为;锌元素的第一电离能、第二电离能分别为 , 铜的第二电离能大于锌的第二电离能,其主要原因是。(4)、磷酸铁可用于制造磷酸铁锂电池材料,的空间构型为。(5)、某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为 , 该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度 , 设为阿伏加德罗常数的值,结合图中的数据计算底面棱(只要求列出计算式,用含b的代数式表示)pm。
(1)、基态的核外电子排布式为。在第四周期过渡元素中,基态原子未成对电子数最多的元素为(用元素符号表示)。(2)、一水合甘氨酸锌是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为;从结构角度解释甘氨酸易溶于水的原因。(3)、铜元素的第一电离能、第二电离能分别为;锌元素的第一电离能、第二电离能分别为 , 铜的第二电离能大于锌的第二电离能,其主要原因是。(4)、磷酸铁可用于制造磷酸铁锂电池材料,的空间构型为。(5)、某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为 , 该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度 , 设为阿伏加德罗常数的值,结合图中的数据计算底面棱(只要求列出计算式,用含b的代数式表示)pm。 -
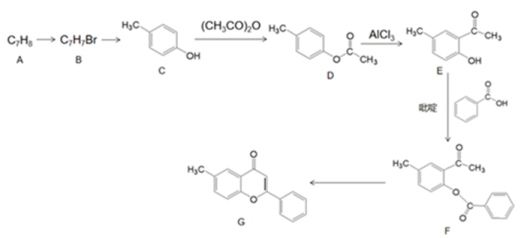
5、中医药是中华民族的宝库,莲花清瘟胶囊由13味中药组方而成,研究表明,其中黄酮类物质(如槲皮素、木犀草素等)对病毒有明显的抑制作用,某黄酮类化合物G的化学合成路线如图所示。
已知:
ⅰ.
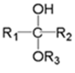 (为烃基或氢,为烃基)
(为烃基或氢,为烃基)ⅱ.
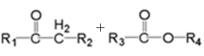
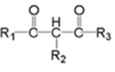 (为烃基或氢,为烃基)(1)、G的分子式为 , 其中含氧官能团的名称是。(2)、AB反应条件为。(3)、C的名称为 , 共面原子最多为。(4)、CD的化学方程式是。(5)、下列说法正确的是。(填字母序号)
(为烃基或氢,为烃基)(1)、G的分子式为 , 其中含氧官能团的名称是。(2)、AB反应条件为。(3)、C的名称为 , 共面原子最多为。(4)、CD的化学方程式是。(5)、下列说法正确的是。(填字母序号)a.最多能与或2mol NaOH反应
b.可以用酸性是否褪色检验D已完全转化为E
c.E的沸点比
 低
低d.
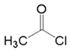 与F为同系物(6)、符合下列条件E的所有同分异构体的结构共有种。
与F为同系物(6)、符合下列条件E的所有同分异构体的结构共有种。a.苯环上的一氯代物只有两种
b.既能发生银镜反应又能发生水解反应
任写出其中一种核磁共振谱具有四组峰的结构简式。
(7)、已知的反应为可逆反应,吡啶是一种有机碱,吡啶的作用是。(8)、F经三步转化为G的路线: , 已知:中间产物1、中间产物2与F互为同分异构体,中间产物1的结构简式;第二步的反应类型是;第三步所用的试剂和条件。 -
6、印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3 , 任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl21.5mol/L,FeCl23.0mol/L,FeCl31.0mol/L,HCl3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
(1)、取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液(填“红色”或“蓝色”、“紫色”),证明废液含有FeCl3。(2)、上述方法获得的铜粉中含有杂质,除杂所需试剂是(填化学式)。(3)、操作Ⅰ是 , 该操作需用到的玻璃仪器有烧杯、普通漏斗和。(4)、FeCl2溶液中通入氯气,发生反应的离子方程式为。 -
7、元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图是钠的价类二维图:

请回答以下问题
(1)、写出二维图中缺失①中某种淡黄色固体能做供氧剂的原因(用化学方程式表示,写一个即可)(2)、写出的电离方程式 ;溶液常因温度过高而分解含有少量 , 除去杂质的方法为(用离子方程式表示)。(3)、向300 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的(忽略溶液体积的变化),充分反应后,得到和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加1mol.L-1的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
①AB段发生反应的离子方程式 。
②B点时,反应所得溶液中溶质的物质的量浓度是。
-
8、常温下,向(一水合二甲胺)溶液中滴加0.1mol·L-1盐酸,滴定曲线如图甲所示,含C微粒的物质的量分数随pH变化如图乙所示。下列说法错误的是( )
 A、e点时,溶液中 B、S点对应溶液的pH约为11.5 C、常温下的电离常数为 D、d点时,溶液中
A、e点时,溶液中 B、S点对应溶液的pH约为11.5 C、常温下的电离常数为 D、d点时,溶液中 -
9、已知:。室温下,将稀盐酸滴加到某一元碱溶液中,测得混合溶液的pOH与微粒浓度的变化关系如图所示。下列说法错误的是( )
 A、若向溶液中加水稀释,则溶液中增大 B、室温下,BOH的电离平衡常数 C、P点所示的溶液中: D、N点所示的溶液中:
A、若向溶液中加水稀释,则溶液中增大 B、室温下,BOH的电离平衡常数 C、P点所示的溶液中: D、N点所示的溶液中: -
10、铁铝矾有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )A、该溶液显中性 B、该溶液中: C、在空气中蒸干并灼烧该溶液,最后所得的残留固体为 D、向该溶液中加入溶液,当完全沉淀时,恰好被完全沉淀
-
11、下列关于的说法错误的是( )A、中铁元素有价和价,是混合物 B、配制溶液时,先将晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 C、溶于一定量稀硝酸中可能生成和Fe2+ D、向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
-
12、常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明的溶液中: B、的溶液中: C、的溶液中: D、能使甲基橙变红的溶液中:
-
13、科研小组用氧化—沉淀法从废电池浸出液中去除铁:用氧化废电池浸出液中的(酸性条件下,被还原为),再加适量溶液调使转化为沉淀.研究发现对氧化率和铁去除率的影响如图1和图2所示。
图1

图2

下列说法错误的是( )
A、由图1可推断的氧化性随浸出液增大而减弱 B、若起始浸出液与反应一段时间后,浸出液会减小 C、转变为沉淀的离子方程式为 D、推测若用溶液调也可以使转化为沉淀 -
14、根据实验操作及现象,下列结论正确的是( )
选项
实验操作及现象
结论
A
向溶液中滴加溶液,生成的白色沉淀迅速变成灰绿色,过一段时间后变为红褐色
有还原性
B
向某溶液中滴加溶液,产生白色沉淀
原溶液中一定含有Cl-
C
向某溶液中滴加酸性KMnO4溶液,紫色褪去
原溶液中一定含有
D
向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊
原溶液中一定含有
A、A B、B C、C D、D -
15、室温下,下列各组离子在指定溶液中能大量共存的是( )A、溶液中: B、酸性溶液中: C、澄清透明的溶液中: D、使酚酞变红色的溶液中:
-
16、下列物质中属于碱性氧化物的是( )A、CO2 B、 C、 D、
-
17、一定量通入500mL某浓度的NaOH溶液中得到溶液A,向溶液A中逐滴滴入稀盐酸,加入与生成的关系如图所示。下列有关叙述错误的是( )
 A、XY段发生反应的离子方程式为 B、原溶液中 C、通入的
A、XY段发生反应的离子方程式为 B、原溶液中 C、通入的 气体体积为44.8L
D、溶液A中含和
气体体积为44.8L
D、溶液A中含和 各1 mol
各1 mol
-
18、下列反应的离子方程式中,书写正确的是( )A、铁粉与稀硫酸反应: B、钠与水反应: C、鸡蛋壳(主要成分为) 醋酸反应: D、小苏打与盐酸反应:
-
19、下列关于铝的叙述不正确的是( )A、铝是地壳中含量最多的金属元素 B、在化学反应中,铝容易失去电子,作氧化剂 C、在常温下,铝能与NaOH溶液反应 D、铝是一种比较活泼的金属
-
20、有关的叙述不正确的是( )A、是淡黄色固体 B、可以作供氧剂 C、应密封保存 D、氧元素的化合价为-2价