相关试卷
-
1、同温同压下,在体积相同的两个密闭容器中分别充满CH4、CO2气体,下列说法不正确的是 ( )A、两种气体的分子数目相等 B、两种气体的质量不相等 C、两种气体的碳原子数目相等 D、两种气体的密度相等
-
2、下列溶液中Cl-的浓度与25mL 0.15 mol/L MgCl2溶液相同的是( )A、10 mL 0.05 mol/LAlCl3溶液 B、150 mL0.1 mol/LNH4Cl溶液 C、含Ba2+浓度为0.3 mol/L 的BaCl2溶液 D、100 mL0.4 mol/L HCl溶液与100 mL0.2mol/L NaCl溶液的混合溶液(溶液混合时体积变化忽略不计)
-
3、某溶液由个数之比为1∶2∶3∶1的、、、M组成,则离子M可能是( )A、Ca2+ B、 C、 D、
-
4、某元素R的阳离子Rn+ , 其核外共有X个电子,该元素的原子的质量数为A,则该元素的核内中子数为( )A、A-X-n B、A+X-n C、A+X+n D、A-X+n
-
5、设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,32g氧气含有的电子数目为16NA B、标准状况下,22.4LH2O所含的分子数目为NA C、0.1mol Mg变为Mg2+时,得到的电子数目为0.2NA D、0.5mol·L﹣1的AlCl3溶液中含有的Cl-的数目为1.5 NA
-
6、某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
 A、图甲连接好线路发现灯泡不亮,证明NaCl固体是非电解质 B、NaCl溶于水,在通电的条件下才能电离出自由移动的离子 C、甲的NaCl固体中无自由移动的阴阳离子,因此不能导电 D、图乙连接好线路灯泡亮,证明NaCl溶液是电解质
A、图甲连接好线路发现灯泡不亮,证明NaCl固体是非电解质 B、NaCl溶于水,在通电的条件下才能电离出自由移动的离子 C、甲的NaCl固体中无自由移动的阴阳离子,因此不能导电 D、图乙连接好线路灯泡亮,证明NaCl溶液是电解质 -
7、下列实验中,所选装置不合理的是( )
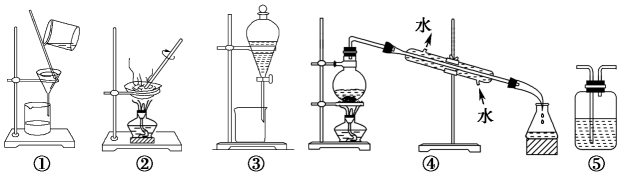 A、粗盐提纯,选①和② B、用CCl4萃取碘水中的碘,选③ C、分离植物油和水,选④ D、用澄清石灰水溶液检验CO2 , 选⑤
A、粗盐提纯,选①和② B、用CCl4萃取碘水中的碘,选③ C、分离植物油和水,选④ D、用澄清石灰水溶液检验CO2 , 选⑤ -
8、下列关于常见离子的检验方法和结论,其中正确的是( )A、用铂丝蘸取待测液在无色的火焰上灼烧,若有黄色火焰产生,证明原溶液一定有钠元素,没有钾元素 B、取待测液加入浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝,证明原溶液一定有 C、取待测液加盐酸酸化的BaCl2溶液,产生白色沉淀,证明原溶液一定有SO42- D、取待测液加入溶液,有白色沉淀生成,证明原溶液一定有
-
9、下列物质的转化,不能一步实现的是( )A、Fe2O3Fe(OH)3 B、K2SO4KOH C、ZnZnCl2 D、MgCl2Mg(OH)2
-
10、下列不属于氧化还原反应的是( )A、S + O 2 SO 2 B、3NO2+ H2O= 2HNO3+NO C、2Mg + CO22MgO + C D、Fe(OH)3 + 3HCl = FeCl3 + 3H2O
-
11、下表中关于物质的分类正确的是( )
酸
碱
盐
碱性氧化物
酸性氧化物
A
H2SO4
NaOH
BaCO3
CO
CO2
B
HNO3
KOH
NaHCO3
CaO
SO2
C
CH3COOH
Cu2(OH)2CO3
CaCl2
Na2O
SO3
D
NaHSO4
NH3
NaCl
CuO
NO2
A、A B、B C、C D、D -
12、下列有关胶体性质和应用描述错误的是( )A、胶体区别于其他分散系的本质特征是分散质粒子的直径在1 nm~100 nm之间 B、“钴酞菁”的分子(直径为1.3×10-9 m)在水中形成的分散系既能透过滤纸,也能透过半透膜 C、光束通过大雾时会产生一条光亮的通路,是胶体的丁达尔效应 D、黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质
-
13、下列物质属于电解质的是( )A、二氧化硫 B、铜 C、硫酸钡 D、酒精
-
14、下列化学用语表示正确的是( )A、硫酸铁的化学式:FeSO4 B、硫原子的结构示意图:
 C、质量数为37的氯原子:
D、Cu(NO3)2的电离方程式:Cu(NO3)2=Cu2++(NO3)2-
C、质量数为37的氯原子:
D、Cu(NO3)2的电离方程式:Cu(NO3)2=Cu2++(NO3)2-
-
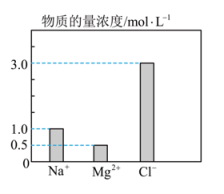
15、物质的量是联系宏观和微观的桥梁,根据物质的量等相关物理量回答下列问题:(1)、0.5molCH4在标准状况下的体积为。(2)、3.1gNa2X含有Na+0.1mol,则X的相对原子质量为。(3)、36gCO与CO2的混合气体与足量O2充分反应后,将所得气体通入过量的澄清石灰水中,生成白色沉淀的质量为100g,则36g CO与CO2的混合气体的总物质的量为 mol。(4)、在0.2L由NaCl、 MgCl2、 CaCl2组成的混合液中,部分离子浓度大小如下图所示。
①该混合液中的物质的量为mol。
②将该混合液加水稀释至体积为1L,稀释后溶液中的物质的量浓度为。
③向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀mol。
-
16、孔雀石主要含Cu2(OH)2CO3 , 还含少量Fe、SiO2。实验室以孔雀石为原料制备CuSO4•5H2O及CaCO3的步骤如图:
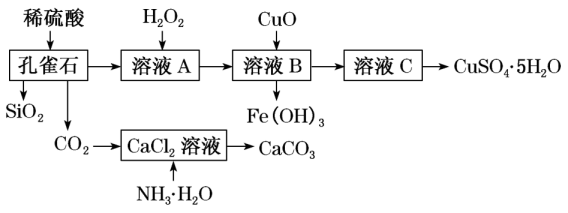 (1)、H2O2中氧元素的化合价为 , 因此H2O2具有强氧化性。(2)、Cu2(OH)2CO3属于(填“酸”“碱”或“盐”)。(3)、制备CaCO3时,发生的反应的化学方程式为。(4)、在一定条件下发生氧化还原反应的是。(填序号)
(1)、H2O2中氧元素的化合价为 , 因此H2O2具有强氧化性。(2)、Cu2(OH)2CO3属于(填“酸”“碱”或“盐”)。(3)、制备CaCO3时,发生的反应的化学方程式为。(4)、在一定条件下发生氧化还原反应的是。(填序号)①孔雀石与稀盐酸
②溶液A与H2O2
③溶液B与CuO
④CO2与NH3•H2O、CaCl2溶液
(5)、C2O3能与水反应生成乙二酸(H2C2O4 , 一种二元酸),则C2O3是氧化物,(填“酸性”、“碱性”或“两性”)C2O3与足量NaOH溶液反应的化学方程式为。 -
17、“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如下信息:
84消毒液
有效成分NaClO
规格1000mL
质量分数 14.9%
密度1.19g/cm3
(1)、该“84消毒液”的物质的量浓度约为。(2)、取100 mL该“84消毒液”,稀释后的溶液中c(Na+)=mol/L(3)、“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒人员用18 mol/L的浓硫酸配制100 mL物质的量浓度为0.9 mol/L的稀硫酸用于增强其的消毒能力。①需要用量筒量取mL上述浓硫酸进行配制。
②配制上述稀硫酸,除量筒、胶头滴管、烧杯、玻璃棒外,还缺少的玻璃仪器是。
③在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号)。
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.往容量瓶转移时,有少液体溅出
e.未洗涤稀释浓硫酸的烧杯
-
18、现代化学在材料、资源、能源、环境、医药、信息技术等领域均有重大应用。(1)、I 新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:
钇原子核内有个质子,左图中89.91表示的是; (2)、钇元素形成氧化物的化学式是。(3)、II电解质是维持人体生理活动的基础之一。请回答下列问题:
(2)、钇元素形成氧化物的化学式是。(3)、II电解质是维持人体生理活动的基础之一。请回答下列问题:①CO2 ②Al ③乙醇 ④Fe(OH)3胶体 ⑤熔融BaSO4 ⑥KOH溶液 ⑦固态
上述物质中属于电解质的是。(填序号)
(4)、属于非电解质的是。(填序号)(5)、能导电的纯净物是。(填序号)(6)、写出⑦在水中的电离方程式。(7)、写出①和⑥的反应方程式。(8)、请写出实验室中制备Fe(OH)3胶体的化学反应方程式。 -
19、在相同容积的密闭容器中,1g O2与1gX气体的压强(p)与温度(T)的关系如图所示,则X气体可能是( )
 A、CO B、NO C、CH4 D、CO2
A、CO B、NO C、CH4 D、CO2 -
20、有A、B、C、D四种元素,质子数均小于18。A元素原子的最外层电子数是其电子层数的3倍;B元素的原子失去1个电子,所得到的微粒具有与氖原子相同的电子层结构;C元素是地壳中含量最多的金属元素;D元素的原子M层电子数是K层的3倍,下列说法不正确的是( )A、A元素可以形成多种同素异形体 B、C的氧化物能与盐酸反应生成盐和水,所以C的氧化物为碱性氧化物 C、可以通过焰色反应检验B元素 D、A和D两种元素形成的化合物能与NaOH溶液反应