相关试卷
-
1、纳米级Fe3O4可用于太阳能分解水制H2 , 过程如下图所示,下列说法中不正确的是( )
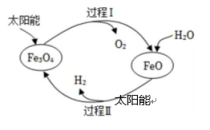 A、过程Ⅰ的反应:2Fe3O4=6FeO + O2↑ B、过程Ⅱ的反应:2H2O=2H2↑+ O2↑ C、两个转化过程都发生了氧化还原反应 D、整个过程实现了太阳能向化学能的转化
A、过程Ⅰ的反应:2Fe3O4=6FeO + O2↑ B、过程Ⅱ的反应:2H2O=2H2↑+ O2↑ C、两个转化过程都发生了氧化还原反应 D、整个过程实现了太阳能向化学能的转化 -
2、下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
O2
H2
通过灼热的氧化铜
④
NaCl固体
CaCO3
溶解,过滤、蒸发
A、②④ B、①②③ C、②③④ D、①②③④ -
3、下列体系中氯离子浓度最大的是( )A、标准状况下22.4L 氯气 B、2mL 0.3mo/L HCl溶液 C、10mL 0.2mol/LCaCl2溶液 D、1mL 0.5mol/L KClO3溶液
-
4、用NA表示阿伏加德罗常数的值,下列说法中不正确的是 ( )A、含有 NA个氦原子的氦气在标准状况下的体积约为22.4L B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA C、0.1mol O3分子中所含的电子数为2.4NA D、在标准状况下,11.2L H2O含有的分子数为0.5NA
-
5、下列实验装置及操作都正确的是( )
 A、图甲:萃取中的分液过程 B、图乙:蒸干溶液制碳酸氢氨固体 C、图丙:过滤Ca(OH)2悬浊液 D、图丁:蒸馏自来水获取蒸馏水
A、图甲:萃取中的分液过程 B、图乙:蒸干溶液制碳酸氢氨固体 C、图丙:过滤Ca(OH)2悬浊液 D、图丁:蒸馏自来水获取蒸馏水 -
6、实验是研究物质组成、结构和性质的重要方法。下列实验操作,正确的是( )A、蒸馏过程中若发现忘加沸石,应立即补加 B、加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- C、用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ , 无K+ D、用苯萃取碘水中
 碘,有机层从分液漏斗的下口放出,颜色为紫红色
碘,有机层从分液漏斗的下口放出,颜色为紫红色
-
7、胶体与人类生活有密切的关系,下列现象不能用胶体知识解答的是( )
 A、重金属中毒,可喝豆浆缓解 B、树林中出现的晨曦(如图) C、将稀硫酸逐滴加入Fe(OH)3胶体中,开始产生红褐色沉淀,继续滴加沉淀溶解 D、针对严重肾病患者的血液透析治疗
A、重金属中毒,可喝豆浆缓解 B、树林中出现的晨曦(如图) C、将稀硫酸逐滴加入Fe(OH)3胶体中,开始产生红褐色沉淀,继续滴加沉淀溶解 D、针对严重肾病患者的血液透析治疗 -
8、分类是科学研究的重要方法,下列物质分类正确的是( )A、淀粉溶液和烟都是胶体 B、固体NaCl、熔融HCl都能导电 C、硫酸、纯碱、食盐是按酸、碱、盐排列的 D、碱石灰、冰水混合物都是混合物
-
9、下列化学用语表示不正确的是 ( )A、氯离子的结构示意图:
 B、阿伏加德罗常数约为6.02×1023mol-1
C、Na+的摩尔质量是23g
D、NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
B、阿伏加德罗常数约为6.02×1023mol-1
C、Na+的摩尔质量是23g
D、NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
-
10、古诗词是我国传统文化的瑰宝。下列关于诗词的解读错误的是( )A、“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 B、“风干日曝咸味加,始灌潮波增成卤”,海水晒盐涉及蒸发结晶的操作 C、“煤饼烧蛎房(贝壳)成灰”,该过程中包含分解反应和复分解反应 D、“雾失楼台,月迷津渡”,雾属于胶体,能产生丁达尔效应
-
11、下列是我国“国家最高科学技术奖”的几位获得者及其部分研究领域,其中研究领域与中药有效成分的分离提纯有关的是( )A、闵恩泽:石油化工催化剂 B、徐光宪:稀土金属化学 C、屠呦呦:青蒿素的发现与提取 D、王泽山:火炸药研究
-
12、(1)、Ⅰ下图是铜锌原电池装置。其电池的总反应是:
。
请回答以下问题:
R的名称是 , R中的阳离子移向(填A或B)中的溶液。 (2)、电极Y的材料是 , B中的电解质溶液是。(3)、X为原电池的极,其电极反应式是。(4)、Ⅱ.已知:
(2)、电极Y的材料是 , B中的电解质溶液是。(3)、X为原电池的极,其电极反应式是。(4)、Ⅱ.已知:物质
C(石墨)
标准燃烧焓
-
13、中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
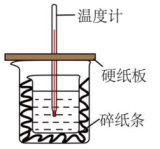 (1)、从如图实验装置看,其中尚缺少的一种玻璃用品是。(2)、烧杯间填满碎纸条的作用是:。(3)、若改用和溶液进行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热(填“相等”“不相等”),用相同浓度和体积的氨水()代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)(4)、写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):。(5)、-51.8kJ/mol某学生实验记录数据如下:
(1)、从如图实验装置看,其中尚缺少的一种玻璃用品是。(2)、烧杯间填满碎纸条的作用是:。(3)、若改用和溶液进行反应与上述实验相比,所放出的热量(填“相等”“不相等”),若实验操作均正确,则所求中和热(填“相等”“不相等”),用相同浓度和体积的氨水()代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)(4)、写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):。(5)、-51.8kJ/mol某学生实验记录数据如下:实验
起始温度
终止温度
序号
硫酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热(结果保留一位小数)。
(6)、上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是。a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.实验装置保温、隔热效果差
-
14、(1)、Ⅰ.如图为相互串联的甲、乙两个电解池。
甲池若为用电解原理精炼铜的装置,B极材料是电极反应式为。电解一段时间后,电解质溶液的浓度。(填“增大”、“减小”或“不变”)。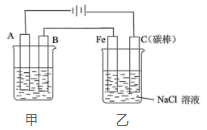 (2)、甲池若为铁制品上镀银的装置,A极材料是。(3)、乙池中发生反应的方程式为。(4)、Ⅱ.某些化学键的键能如表所示:
(2)、甲池若为铁制品上镀银的装置,A极材料是。(3)、乙池中发生反应的方程式为。(4)、Ⅱ.某些化学键的键能如表所示:化学键
H-H
N≡N
键能/(kJ/mol)
a
b
试回答下列问题:已知 ,
则N-H键的键能是kJ/mol(用含有a、b、c的式子表示)。
(5)、Ⅲ.如下图所示装置中都盛有0.1mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是。
-
15、化学物质在汽车的动力、安全等方面有着极为重要的作用。(1)、汽油是以为主要成分的混合烃类。燃烧的化学方程式是。(2)、汽车尾气中含有NO,CO等污染物。其中NO生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为(填“吸热”或“放热”)反应。

和反应生成NO(g)过程中的能量变化
(3)、通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
①NiO电极上发生的是反应(填“氧化”或“还原”)
②外电路中,电子流动方向是从电极流向电极(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为。
(4)、电动汽车普遍使用锂离子电池。某锂离子电池反应:。①放电时,Li做电池的极。
②Na也可以做电池的电极,但Li做电极更有优势。试解释原因。
(5)、安全性是汽车发展需要解决的重要问题.汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有、、、 , 已知在猛烈撞击时分解产生两种单质,并放出大量的热。①推测的作用是。
②结合化学方程式解释的作用。
③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有(填代号,可多选)。
a.反应速率 b.反应的能量变化 c.气体的量 d.气体毒性
-
16、支撑海港码头基础的钢管桩,常用电化学原理进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
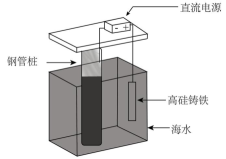 A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、此方法在化学上称之为牺牲阳极法 D、通入的保护电流应该根据环境条件变化进行调整
A、通入保护电流使钢管桩表面腐蚀电流接近于零 B、通电后外电路电子被强制从高硅铸铁流向钢管桩 C、此方法在化学上称之为牺牲阳极法 D、通入的保护电流应该根据环境条件变化进行调整 -
17、有关甲、乙、丙、丁四个图示的叙述正确的是( )
甲
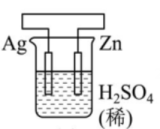 乙
乙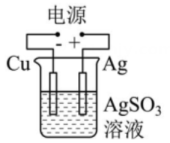 丙
丙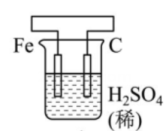 丁
丁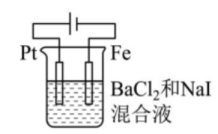 A、甲中Zn电极失去电子发生氧化反应,电子经过溶液后,流向Ag电极 B、乙中阴极反应式为 C、丙中向Fe电极方向移动 D、丁中电解开始时阳极产生黄绿色气体
A、甲中Zn电极失去电子发生氧化反应,电子经过溶液后,流向Ag电极 B、乙中阴极反应式为 C、丙中向Fe电极方向移动 D、丁中电解开始时阳极产生黄绿色气体 -
18、下列说法正确的是( )A、1mol物质完全燃烧生成指定产物时放出的热量,叫该物质的燃烧热 B、酸和碱发生中和反应生成1mol水时的反应热叫中和热 C、反应热就是焓变 D、简易量热计由内筒,外壳,隔热层,杯盖,温度计,玻璃搅拌器构成
-
19、如图是甲烷燃料电池的工作原理模拟示意图,下列说法不正确的是( )
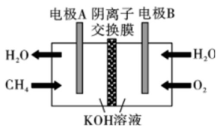 A、电极B为正极 B、在电极A上发生氧化反应 C、电极A区发生反应: D、当有通过外电路时,有通过阴离子交换膜
A、电极B为正极 B、在电极A上发生氧化反应 C、电极A区发生反应: D、当有通过外电路时,有通过阴离子交换膜 -
20、“国之重器”之一——曾侯乙编钟,是战国早期的青铜编钟,主要由铜锡合金冶炼铸造而成,至今保存完好。下列说法不正确的是( )A、铜比锡青铜更易腐蚀 B、在自然环境中,锡青铜中的铜可对锡起保护作用 C、青铜文物在潮湿环境中的腐蚀比在干燥环境中快 D、锡青铜表面生成覆盖物的过程属于电化学腐蚀