相关试卷
-
1、下列说法不正确的是( )A、道尔顿认为物质是由原子构成,原子是不能被创造,在化学反应中不可再分 B、卢瑟福提出了带核的原子结构模型 C、汤姆生发现了原子中电子的存在 D、20世纪初,科学家揭示了微观世界波粒二象性的规律,认识到原子核外电子的运动遵循经典力学的原理。
-
2、现有下列三种气体:a. 32 g CH4 , b.约含有6.02×1023个HCl分子的氯化氢气体,c.标准状况下33.6 L NH3。下列排列顺序一定正确的是( )A、质量:a>b>c B、氢原子数目:a>c>b C、分子数:b>a>c D、体积:c>a>b
-
3、配制一定物质的量浓度的Na2CO3溶液的操作过程如图,下列说法中错误的是( )
 A、“操作1”中烧杯洗涤液也要转移到容量瓶中 B、“操作2”中玻璃棒起引流作用 C、所配制的Na2CO3溶液中c(Na+ )为2mol/L D、“操作4”定容时俯视刻度线会造成所配溶液浓度偏低
A、“操作1”中烧杯洗涤液也要转移到容量瓶中 B、“操作2”中玻璃棒起引流作用 C、所配制的Na2CO3溶液中c(Na+ )为2mol/L D、“操作4”定容时俯视刻度线会造成所配溶液浓度偏低 -
4、下列有关实验操作的叙述合理的是( )A、用酒精灯加热烧瓶、蒸发皿时,都需要垫上石棉网 B、用酒精为萃取剂萃取碘水中的碘单质 C、蒸馏自来水实验中发现忘加沸石,冷却后再加入沸石 D、蒸发操作时,将溶液放入坩埚中加热到出现大量晶体后停止加热
-
5、已知溶液中可与恰好完全反应,反应后全部转化为 , 则可能转化为( )A、 B、 C、 D、
-
6、以NaCl为原料,可制取纯碱。Na2CO3可用侯氏制碱法制取,主要涉及如下反应:; , 下列有关实验室模拟侯氏制碱法的实验原理和装置正确的是( )
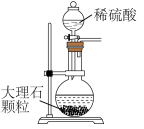
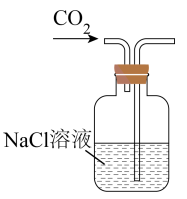


A.制取CO2
B.制取NaHCO3
C.分离NaHCO3
D.制取Na2CO3
A、A B、B C、C D、D -
7、用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.5mol·L-1的MgCl2溶液中离子总数为1.5NA B、标准状况下,22.4L水所含分子数为NA C、65gZn与足量H2SO4完全反应生成的H2所含原子数目为2NA D、足量的Na在11.2L氯气中完全燃烧,转移电子数为0.5NA
-
8、下列有关物质的性质与用途具有对应关系的是( )A、Cl2能溶于水,可用于与H2反应制HCl B、NaHCO3受热易分解,可用制备抗酸药物 C、Al2O3能与酸反应,可用于制备耐高温材料 D、铁粉能与O2反应,可用作食品保存的脱氧剂
-
9、对于反应: , 下列说法不正确的是( )A、是氧化剂 B、发生氧化反应 C、每有反应将生成 D、每有电子转移将生成
-
10、下列化学用语表示正确的是( )A、次氯酸钙的化学式:CaCl2 B、H、D、T的关系:同位素 C、HCl的摩尔质量:36.5 D、质子数为6、中子数为7的碳原子
-
11、朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成种种美景的本质原因是( )A、发生了丁达尔效应 B、空气中的小水滴颗粒的运动 C、雾是一种胶体,胶粒带有电荷 D、空气中的小水滴颗粒直径为1~100nm
-
12、我国古代伟大发明黑火药的爆炸反应方程式为:。下列说法不正确的是( )A、属于强电解质 B、属于酸性氧化物 C、中子数为8的碳原子可表示为 D、的结构示意图是:
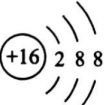
-
13、我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。下列措施对实现“碳中和”不具有直接贡献的是( )A、推行生活垃圾分类 B、发展捕集技术 C、采取节能低碳生活方式 D、创新转化为碳燃料的技术
-
14、物质的量浓度是一种常用的溶液浓度表示方法,利用其进行定量分析计算比较方便。(1)、I.实验需要溶液475mL和硫酸溶液250mL。根据这两种溶液的配制情况回答下列问题:
下列操作中,能用容量瓶实现的有____(填序号)。A、配制一定体积准确浓度的标准溶液 B、测量容量瓶规格以下的任意体积的液体 C、准确稀释某一浓度的溶液 D、贮存溶液 E、用来加热溶解固体溶质(2)、根据计算用托盘天平称取所需的NaOH的质量为g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度(填“大于”“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度。(3)、若用质量分数为98%、密度为的浓硫酸来配制,在下列配制过程示意图中,错误的是(填选项字母). (4)、II.在0.2L由NaCl、、CaCl2组成的混合液中,部分离子浓度大小如图所示。请回答下列问题:
(4)、II.在0.2L由NaCl、、CaCl2组成的混合液中,部分离子浓度大小如图所示。请回答下列问题:该混合液中的物质的量为mol,将该混合液加水稀释至体积为1L,稀释后溶液中的物质的量浓度为。

-
15、现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。已知NaNO3的溶解度受温度的影响较大。

请回答下列问题:
(1)、写出实验流程中下列物质的化学式:沉淀A , 试剂X。(2)、上述实验流程中①②③步均要进行的实验操作是(填操作名称)。(3)、上述实验流程中加入过量Na2CO3溶液的目的是。(4)、按此实验方案得到的溶液3中肯定含有(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的(填化学式),之后通过蒸发浓缩,(填操作名称),过滤,洗涤、低温烘干可获得NaNO3晶体。 -
16、葡萄糖氧化反应(C6H12O6+6O26CO2+6H2O)放出的热量是人体生命活动所需能量的重要来源。医学上葡萄糖溶液可作为药物的溶媒,同时能给病人补充体液和能量。(1)、葡萄糖是(填“电解质”或“非电解质”)。(2)、一袋500mL规格的医用葡萄糖注射液含葡萄糖50g,在实验室准确配制一份这样的葡萄糖溶液,需用到的玻璃仪器有:烧杯、玻璃棒、、。(3)、90g葡萄糖在人体内完全氧化供能,理论上需要消耗标准状况下的O2L。(4)、人体血糖(血液中的葡萄糖)正常值为3.9~6.1mmol/L。某人体检报告血糖值为0.92g/L的血糖(填“偏高”“正常”或“偏低”)。(5)、生化法处理污水需添加葡萄糖为微生物提供能量,污水中葡萄糖浓度达到0.04mol/L时处理效果较好。处理一份300mL的污水样本需要添加0.54mol/L葡萄糖溶液mL(忽略溶液混合时体积的变化)。
-
17、利用太阳能光解水,制备的H2用于还原CO2合成有机物甲醇(CH3OH),可实现资源的再利用。回答下列问题:(1)、CH3OH的摩尔质量是g∙mol-1。(2)、2mol CO2中所含原子的物质的量为 mol。(3)、 g的氢气中所含H原子的数目与1mol CH3OH相同。(4)、含0.1NA个O的CO2中有个电子,标准状况下该CO2的体积为L。(5)、在标准状况下,H2和CO2的混合气体共11.2 L,质量为13.6 g,其中H2为 mol
-
18、已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
元素编号
元素性质或原子结构的相关叙述
T
失去一个电子后形成与Ne相同的核外电子排布
X
最外层电子数是次外层电子数的2倍
Y
其某种单质是空气的主要成分,也是最常见的助燃剂
Z
原子核外有3个电子层,最外层比次外层少1个电子
(1)、元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是。X的另一种同位素可用来测定文物所属年代,这种同位素的原子符号是。(2)、Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是。(3)、元素Z在海水中含量非常高,海水中含Z元素的化合物主要是(填化学式),电离方程式为。(4)、画出T的原子结构示意图:。(5)、由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的化学方程式为。 -
19、高纯碳酸钙广泛应用于精密电子陶瓷、医药等生产。如图为模拟制备高纯碳酸钙的主要流程,已知该大理石中杂质是二氧化硅和氧化铁。下列有关说法错误的是( )
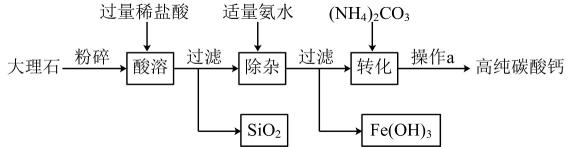 A、由“酸溶”可知,二氧化硅不溶于水和稀盐酸 B、“除杂”中,氨水只与溶液中的氯化铁反应 C、“转化”发生的主要反应是(NH4)2CO3+CaCl2=CaCO3↓+2NH4Cl D、操作a为组合操作,包含过滤、洗涤、干燥
A、由“酸溶”可知,二氧化硅不溶于水和稀盐酸 B、“除杂”中,氨水只与溶液中的氯化铁反应 C、“转化”发生的主要反应是(NH4)2CO3+CaCl2=CaCO3↓+2NH4Cl D、操作a为组合操作,包含过滤、洗涤、干燥 -
20、某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、
CO、SO、NO。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入BaCl2溶液后,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定含有的离子是( )
A、Cu2+ 、OH-、Cl-、CO B、Na+、Mg2+、Cl-、SO C、OH-、Cl-、CO、NO D、Na+、OH-、Cl-、CO