相关试卷
-
1、某兴趣小组的同学利用电导率传感器探究电解质相互反应时溶液的导电性发生变化的情形,得到如下图所示的图像。此时发生的离子反应不可能是( )
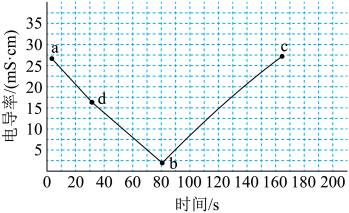 A、 B、 C、 D、
A、 B、 C、 D、 -
2、已知Pb3O4与HNO3溶液发生反应Ⅰ:Pb3O4+4H+=PbO2+2Pb2++2H2O;PbO2与酸化的MnSO4溶液发生反应Ⅱ:5PbO2+2Mn2++4H++5SO=2MnO+5PbSO4+2H2O;KMnO4与浓盐酸发生反应Ⅲ:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。下列推断正确的是( )A、由反应Ⅰ可知,Pb3O4中+2价的Pb和+4价的Pb含量之比为1:2 B、由反应Ⅰ、Ⅱ可知,氧化性:HNO3>PbO2>MnO C、Pb可与稀硝酸发生反应:3Pb+16HNO3=3Pb(NO3)4+4NO↑+8H2O D、Pb3O4可与盐酸发生反应:Pb3O4+8HCl=3PbCl2+4H2O+Cl2↑
-
3、下列说法错误的是( )
①化合反应一定属于氧化还原反应
②由同一种元素组成的物质一定是纯净物
③是混合物,因此不是电解质
④酸性氧化物一定是非金属氧化物,非金属氧化物不一定是酸性氧化物
⑤尽管的水溶液能导电,但仍是非电解质,因为与水反应生成了电解质
⑥氧化钠溶于水生成钠离子和氢氧根离子,尽管氧化钠是化合物,其水溶液能导电,但由于水溶液中的氢氧根离子并非由氧化钠自身电离产生,因此氧化钠是非电解质
A、①②③⑥ B、①②③④ C、①②③④⑥ D、ABC答案均不正确 -
4、下列反应的离子方程式书写正确的是( )A、向漂白粉溶液中通入足量: B、过氧化钠与水反应: C、将过量通入冷氨水中: D、少量和溶液:
-
5、下列各组澄清透明溶液中,能大量共存的离子组是( )A、、、、 B、、、、 C、、、、 D、、、、
-
6、下列实验中,所选装置能达到实验目的的是( )
 A、用装置①除去NaCl溶液中的Fe(OH)3胶体 B、用装置②蒸干氯化锰溶液制MnCl2·4H2O C、用装置③分离二硫化碳中溶解的硫 D、用装置④从碘的四氯化碳溶液中回收CCl4
A、用装置①除去NaCl溶液中的Fe(OH)3胶体 B、用装置②蒸干氯化锰溶液制MnCl2·4H2O C、用装置③分离二硫化碳中溶解的硫 D、用装置④从碘的四氯化碳溶液中回收CCl4 -
7、根据实验目的,下列实验操作、现象及结论都正确的是( )
选项
实验目的
实验操作及现象
结论
A
制备Fe(OH)3胶体
向沸水中逐滴加入5~6滴饱和FeCl3溶液,持续加热,生成红褐色固体
FeCl3与水反应产生Fe(OH)3胶体
B
验证Cl2的漂白性
将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃瓶。一段时间后有色鲜花褪色
Cl2有漂白性
C
检验溶液中的Na+
用硫酸洗净后的铂丝蘸取少量溶液在酒精灯外焰上灼烧,产生黄色火焰
溶液中存在Na+
D
探究Na2O2与水反应的产物
将1~2mL水滴入盛有1~2g固体的试管中,滴入2滴酚酞试液,溶液先变红后褪色
反应可能生成了NaOH和H2O2
A、A B、B C、C D、D -
8、下列选项所表示的物质间转化关系不能一步转化的是( )A、 B、 C、 D、
-
9、化学来源于生活,也服务于生活。下列有关生活中
 化学知识叙述错误的是( ) A、氯气与烧碱溶液或石灰乳反应都能得到含氯漂白剂 B、烧制陶瓷、冶炼金属、酿造酒类都属于化学变化 C、洁厕灵与“84”消毒液混用会产生有毒气体 D、漂白粉在空气中久置变质,是因为与空气反应生成
化学知识叙述错误的是( ) A、氯气与烧碱溶液或石灰乳反应都能得到含氯漂白剂 B、烧制陶瓷、冶炼金属、酿造酒类都属于化学变化 C、洁厕灵与“84”消毒液混用会产生有毒气体 D、漂白粉在空气中久置变质,是因为与空气反应生成 发生了分解
发生了分解
-
10、2023 年诺贝尔化学奖颁发给了研究量子点的三位科学家,其研究成果表明,物质在纳米级时因微粒大小不同而具有不同的颜色、性质,故在医疗、科技等多个领域有重大意义,下列叙述正确的是( )A、科学家研究过程中制得了直径为4.5nm的硫化镉,这种硫化镉是胶体 B、利用丁达尔效应鉴别胶体和蛋白质溶液 C、依据分散质粒子的直径大小可将分散系分为溶液、胶体与浊液 D、胶体微粒既可以透过半透膜也可以透过滤纸
-
11、分类法是学习化学的重要方法,下列物质对应分类正确的是( )
类别
选项
单质
酸
盐
混合物
A
白磷
纯碱
冰水混合物
B
水银
氧化钙
碱石灰
C
盐酸
D
氨水
A、A B、B C、C D、D -
12、称取5.40 g草酸亚铁晶体( , g/mol),用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示,已知400℃时,剩余固体是铁的一种氧化物。
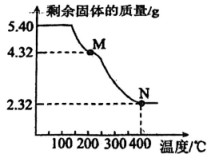
5.40 g草酸亚铁晶体的物质的量为mol,M点对应物质的化学式为 , N点对应的物质是 , M→N发生反应的化学方程式为。
-
13、二氧化铈( , 相对分子质量为172)是一种重要的稀土化合物。提纯二氧化铈()一种工艺流程如图所示:
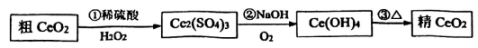 (1)、稀土化合物中Ce的化合价为。(2)、在反应①中体现(填“氧化性”或“还原性”),写出稀硫酸、与反应的化学方程式。(3)、由反应②可知氧化性:(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 , 当消耗1 mol 转移电子的物质的量为mol。(4)、是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。
(1)、稀土化合物中Ce的化合价为。(2)、在反应①中体现(填“氧化性”或“还原性”),写出稀硫酸、与反应的化学方程式。(3)、由反应②可知氧化性:(填“>”或“<”或“=”),反应②中的氧化剂与还原剂的物质的量之比为 , 当消耗1 mol 转移电子的物质的量为mol。(4)、是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。
写出过程①发生反应的化学方程式。
的消除过程
(5)、取上述流程中得到的精产品0.4500 g,加硫酸溶解,经标准溶液测定以后,产品中含 0.0025 mol。该产品中的质量分数为(保留一位小数)。 -
14、人们在认识自然的过程中所形成的化学知识和观念,都始于对实验的观察、想象和思考。(1)、两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的溶液和溶液,实验中发现加入水的试管中溶液迅速变为蓝色,而加入溶液的试管却是在慢慢地、慢慢地变蓝。可以想象,当将KI溶液滴加到和的混合溶液中,首先发生的离子反应为 ,
由此可以推知,将等物质的量的与在溶液中反应,发生反应的离子方程式为。
(2)、①将5 mL饱和(滴有酚酞试液)溶液迅速滴加到充满气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体。产生晶体的离子方程式为。②两支试管中分别放有1 g NaOH固体,现向两支试管中分别加入等体积(约10 mL)的水和饱和溶液。振荡,两试管中NaOH固体均完全溶解且有放热的现象,同时加入饱和溶液的试管的温度明显高于加水的试管。可见NaOH固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应。
-
15、请配平下列氧化还原反应的方程式,标出电子转移方向和数目,并按要求用“氧化剂”、“还原剂”、“氧化产物”或“还原产物”填空:(1)、过氧化钠曾经作为潜水艇中的供氧剂,其作用是吸收同时释放。
反应中是。
(2)、在表现为酸性时,与有着相似的性质,可是遇到过氧化钠却发生了如下反应。反应中是。
-
16、钠是一种非常活泼、具有广泛应用的金属。(1)、金属钠非常活泼,通常保存在里,以隔绝空气。(2)、汽车安全气囊的气体发生剂可由金属钠生产。某汽车安全气囊内含、和等物质。
①当汽车发生较严重的碰撞时,引发分解: , 从而为气囊充气。产生的Na立即与发生置换反应生成 , 化学方程式是。
②是冷却剂,吸收产气过程释放的热量。起冷却作用时发生反应的化学方程式为。
③如果安全气囊中装有78 g , 其完全分解所释放的在标准状况下的体积为L。
(3)、工业通过电解NaCl生产金属钠:2NaCl(爆炸) , 过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入从而把熔点降至约580℃。粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是。
-
17、纯碱是重要的基本化工原料。工业上获得纯碱的方法(氨碱法)主要是将①、②通入NaCl③饱和溶液中,使溶解度小的④从溶液中析出,加热晶体即可获得⑤。我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将⑥与⑦合成氨法、氨碱法联合起来,同时得到了纯碱和⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。(1)、属于酸性氧化物的是(填序号,下同),在水溶液中可以全部电离的物质是 , 属于非金属单质的是。(2)、实验室在模拟上述反应过程时,先制得饱和食盐水,然后先通入气体,当达到一定浓度后,再通入 , 一段时间以后,便可观察到有白色晶体析出。
写出发生反应的总方程式。
-
18、某溶液中大量存在五种离子:、、、、X,它们的物质的量之比为 , 则X可能为( )A、 B、 C、 D、
-
19、下列选项所示的物质间转化均能通过一步反应实现的是( )A、 B、 C、 D、
-
20、阅读下列文字,回答下面小题:实验室分别进行如下实验:①向蓝色的溶液中滴加酸性溶液,溶液由蓝色变为淡黄色();②向溶液中滴加浓盐酸产生黄绿色气体(),溶液变蓝。(1)、下列各物质中带点元素的化合价最高的是( )A、 B、 C、 D、(2)、下列有关说法正确的是( )A、①中还原剂与氧化剂物质的量之比为1∶5 B、由①②可知,酸性条件下氧化性: C、②中每生成1 mol 分子,转移2 mol电子 D、向溶液中滴加溶液发生反应