相关试卷
-
1、人体血液存在和等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值[x表示或]与的关系如图所示。已知。下列说法正确的是( )
 A、曲线Ⅰ表示与的变化关系 B、点点的过程中,水的电离程度逐渐减小 C、当增大时,逐渐减小 D、当时,
A、曲线Ⅰ表示与的变化关系 B、点点的过程中,水的电离程度逐渐减小 C、当增大时,逐渐减小 D、当时, -
2、甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气再转化为甲醇,涉及的反应如下;
反应Ⅰ:
反应Ⅱ:
在密闭容器中通入和 , 假设只发生反应Ⅰ和Ⅱ,分别在和下进行反应,其中和的平衡体积分数随温度变化如图所示。
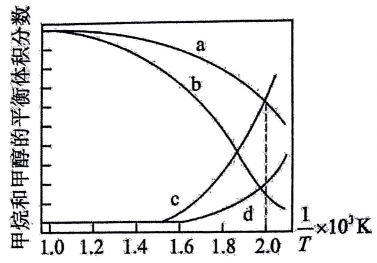
已知:对于反应Ⅱ,为速率常数,只与温度有关,分压总压物质的量分数。下列说法不正确的是( )
A、压强为时,表示和的曲线分别是 B、混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡 C、在升温的过程中,反应Ⅱ速率常数增大的倍数: D、条件下,若平衡时的物质的量为 , 则的转化率约为 -
3、沉积型锌镍单液流电池是介于双液流电池和传统二次电池之间的一种储能装置,放电时的电池结构见如图。下列说法正确的是( )
 A、充电时电极电势:电极电极 B、放电时向电极移动 C、放电时储液罐中溶液浓度减小 D、充电时电极发生反应:
A、充电时电极电势:电极电极 B、放电时向电极移动 C、放电时储液罐中溶液浓度减小 D、充电时电极发生反应: -
4、与形成的合金具有抗高温氧化、耐腐蚀等优点,微观结构如图a所示;用金属铼()掺杂后,形成的化合物 , 微观结构如图所示:
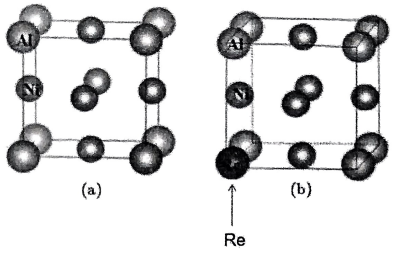
已知:与同族。下列说法正确的是( )
A、与均为区元素 B、图b为化合物的晶胞结构 C、 D、图的晶胞参数为 , 则晶体密度为 -
5、处理废旧电池[主要含、铼]的流程如下:
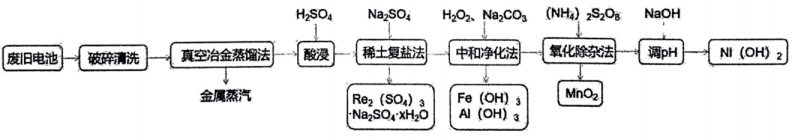
下列说法正确的是( )
A、金属的沸点高于其他金属 B、生成复盐的离子方程式为 C、在实际中和净化过程中,需要的与的物质的量之比应为 D、中,为价,其中含有2个过氧键 -
6、甲酸常被用于橡胶、医药等工业。在一定条件下可分解生成和 , 无、有催化剂条件下的能量与反应历程的关系分别如图1、图2所示。下列说法错误的是( )
 A、途径一和途径二中甲酸的平衡转化率相等 B、 C、途径二使用了作为催化剂 D、途径二反应的快慢由生成
A、途径一和途径二中甲酸的平衡转化率相等 B、 C、途径二使用了作为催化剂 D、途径二反应的快慢由生成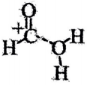 的速率决定
的速率决定
-
7、钛合金耐高温,被称之为“航天金属”。工业上可以在时电解制得钛,装置如图所示,下列叙述不正确的是( )
 A、石墨电极是阳极 B、常温下为液体,可直接电解液体制钛 C、阴极电极反应方程式为: D、阳极可能会产生有毒的气,石墨电极需要定期更换
A、石墨电极是阳极 B、常温下为液体,可直接电解液体制钛 C、阴极电极反应方程式为: D、阳极可能会产生有毒的气,石墨电极需要定期更换 -
8、下列所示装置或操作能达到实验目的的是( )
A
B
C
D
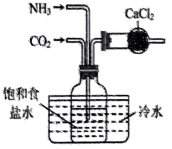
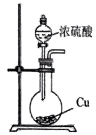
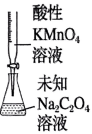
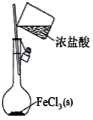
模拟侯氏制碱法获得
制备
测定未知溶液的浓度
配制溶液
A、A B、B C、C D、D -
9、将溶于(1-乙基-3-甲基咪唑四氟硼酸盐)后形成的混合液,能替代锌离子电池中的常规水系电解液,避免水对锌的腐蚀。制备原理如下:

已知
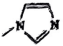 是类似于苯的芳香族化合物。下列说法错误的是( )A、固态为离子晶体,含有极性键,非极性键和离子键 B、
是类似于苯的芳香族化合物。下列说法错误的是( )A、固态为离子晶体,含有极性键,非极性键和离子键 B、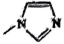 分子中的
C、N原子均在同一平面C.和中B的杂化方式不相同
D、
分子中的
C、N原子均在同一平面C.和中B的杂化方式不相同
D、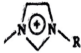 中存在元大键
中存在元大键
-
10、价-类二维图是学习元素化合物知识的重要方法,某同学绘制某常见元素的价-类二维图如图所示。下列推断合理的是( )
 A、f中阴阳离子个数比一定为1∶2 B、可用盐酸酸化的氯化钡检验e是否变质 C、标准状况下,和c的混合物体积为 D、图中按箭头所示的转化均可一步实现
A、f中阴阳离子个数比一定为1∶2 B、可用盐酸酸化的氯化钡检验e是否变质 C、标准状况下,和c的混合物体积为 D、图中按箭头所示的转化均可一步实现 -
11、能正确表示下列反应的离子方程式为( )A、溶液与少量溶液混合: B、溶液与少量溶液混合: C、向酸性溶液中滴加双氧水: D、向溶液中滴加溶液:
-
12、胍(
 )是一元强碱,分子构型为平面型,其盐酸盐(
)是一元强碱,分子构型为平面型,其盐酸盐(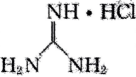 )是核酸检测液的主要成分。下列说法错误的是( ) A、胍中元素电负性大小关系为: B、胍具有很强的吸湿性 C、胍的熔点低于胍盐 D、胍中杂化方式均为
)是核酸检测液的主要成分。下列说法错误的是( ) A、胍中元素电负性大小关系为: B、胍具有很强的吸湿性 C、胍的熔点低于胍盐 D、胍中杂化方式均为 -
13、铜可以溶解在氨水和过氧化氢的混合溶液中:。设为阿伏加德罗常数的值,下列有关说法不正确的是( )A、基态铜原子的最外层电子数为 B、每生成转移的电子数为 C、含有键数目为 D、等物质的量的与所含有的质子数相等
-
14、化学与生活、生产、社会密切相关,下列说法正确的是( )A、制造镍氢电池使用的储氢合金是一类能与氢气结合成金属氢化物的材料,如钛锆合金,镧镍合金等 B、等漂白剂均是利用强氧化性达到漂白效果 C、用于制作大运会火炬塔塔身的钛合金板具有硬度低、延展性好等特点 D、天和核心舱电推进系统腔体的氮化硼陶瓷属于传统无机非金属材料
-
15、碘(紫黑色固体,微溶于水)及其化合物应用于医药、染料等方面。
已知1:还原性:碘离子大于亚铁离子
已知2:碘化银、溴化银和氯化银一样,难溶于水
回答下列问题:
(1)、的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为。
②通入的过程中,若氧化产物只有一种,反应的化学方程式;若反应物用量比时,氧化产物为;当后,单质碘的收率会降低,原因是。
(2)、以为原料制备的方法是:先向溶液中加入计量的 , 生成碘化物;再向混合溶液中加入溶液,反应得到。上述制备的总反应的离子方程式为。(3)、KI溶液和溶液混合可生成CuI沉淀和 , 若生成1个 , 消耗的KI至少为个。在KI溶液中可发生反应:。实验室中使用过量的KI与溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是。 -
16、某实验室利用和反应合成硫酰氯(),并对和HClO的酸性强弱进行探究。已知的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl白雾,100℃以上分解生成和。实验室合成的原理: , 且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
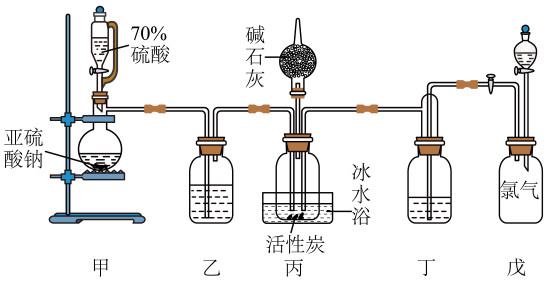 (1)、写出碱石灰起作用的化学方程式:。(写一个即可)(2)、装置戊上方分液漏斗中最好选用(填字母)。
(1)、写出碱石灰起作用的化学方程式:。(写一个即可)(2)、装置戊上方分液漏斗中最好选用(填字母)。a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.盐酸
(3)、装置乙和丁盛放的试剂均是。(4)、装置丙放置在冰水浴中的原因是。(5)、和水反应的化学方程式为。(6)、选用下面的装置探究酸性: , 溶液均足量,其连接顺序为A→。能证明的酸性强于HClO的实验现象为。信息:可以使品红褪色,通常用来检验;难溶于饱和的;酸性大于
-
17、实验小组探究和的性质。
【进行实验】
序号
实验装置
主要实验步骤
实验现象
实验1
向2支试管中分别加入少量和溶液,再分别滴加盐酸
2支试管中均有气泡产生
实验2

向Ⅱ中加入试剂a,向Ⅰ中加入少量或固体,分别加热一段时间
受热时Ⅱ中无明显现象,受热时Ⅱ出现浑浊
(1)、写出实验1中与盐酸反应的离子方程式。(2)、①实验2中,试剂a是 , 此实验得出的结论是。②称量固体168g,加热一段时间之后,剩余固体的质量为137g,则剩余固体中与的物质的量之比为。
实验3
浓度/
0.01
0.10
0.50
0.01
0.01
无明显现象
有浑浊
有浑浊
有浑浊
0.10
无明显现象
有浑浊
有浑浊,有微小气泡
有沉淀
0.50
无明显现象
有浑浊
有浑浊,有大量气泡
有沉淀
已知:易溶于水。
(3)、溶液与溶液混合的现象中,有些只观察到浑浊但没有观察到气体,可能原因是。(4)、写出溶液中与反应的离子方程式。(5)、【反思评价】根据实验3,鉴别浓度均为0.50的和的方法是:分别取等量溶液置于两试管中,。
-
18、(1)、Ⅰ、有以下13种物质:①石墨②氯化钠③酒精④氨水⑤二氧化碳⑥碳酸氢钠⑦氢氧化钠溶液⑧纯醋酸⑨氯化氢⑩硫酸铝⑪稀硫酸⑫氯化银⑬硫酸氢钠
能导电的是;属于非电解质的是。(2)、Ⅱ、“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为)吸收烟气中的 , 得到亚硫酸钠()粗品。其流程如下: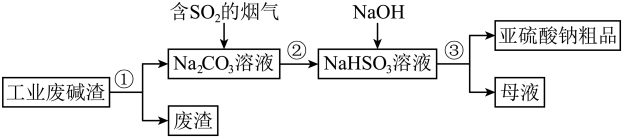
过程①进行
 操作是。(3)、上述流程中的是酸性氧化物,原因是:。(用化学方程式表示)(4)、加入NaOH后,发生反应的离子方程式为。(5)、亚硫酸钠粗品中含有少量 , 原因是。(6)、设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有。
操作是。(3)、上述流程中的是酸性氧化物,原因是:。(用化学方程式表示)(4)、加入NaOH后,发生反应的离子方程式为。(5)、亚硫酸钠粗品中含有少量 , 原因是。(6)、设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, , 出现白色沉淀,则证明含有。 -
19、为探究氯水在光照条件下的分解反应,某同学用强光照射盛有新制氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下三张图片。下列说法正确的是( )
 A、图甲可以表示强光照射过程中,氯水随时间的变化趋势 B、图乙可以表示强光照射过程中,的体积分数随时间的的变化趋势 C、图丙可以表示强光照射过程中,随时间的变化趋势 D、氯水在光照过程中可能出现
A、图甲可以表示强光照射过程中,氯水随时间的变化趋势 B、图乙可以表示强光照射过程中,的体积分数随时间的的变化趋势 C、图丙可以表示强光照射过程中,随时间的变化趋势 D、氯水在光照过程中可能出现 -
20、某固体中可能含有:等离子,将该固体溶解所得到的溶液进行了如下实验:
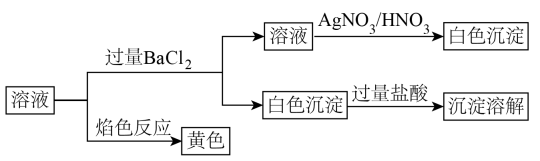
下列说法正确的是( )
A、该固体一定含有Na2CO3 B、该固体可能是Na2CO3和KCl C、该固体可能是Na2SO4和Na2CO3 D、该固体一定是Na2CO3和NaCl