相关试卷
-
1、回答下列问题:(1)、某工业废水中存在大量的 , 欲除去其中的 , 设计提纯流程如图所示:
①试剂b溶液为(化学式),试剂c溶液为(化学式)。
②操作X为。
(2)、“”试剂可将氧化为可溶的 , 而作为废气中的脱除剂。①催化分解产生有很强的氧化性的 , 将氧化为的机理如图所示,Y的化学式为。

②与反应生成的化学方程式为。
③脱除率随温度的变化如题图所示,温度高于120℃时,脱除率随温度升高呈现下降趋势的主要原因是。
 (3)、一个密闭容器中有可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 , 右边充入和的混合气体共时,隔板处于如下图位置(保持温度不变)。
(3)、一个密闭容器中有可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 , 右边充入和的混合气体共时,隔板处于如下图位置(保持温度不变)。
①右边和分子数之比为。
②右侧气体密度与相同条件下氧气密度之比为。
-
2、工业上以侯氏制碱法为基础生产焦亚硫酸钠()的工艺流程如下:
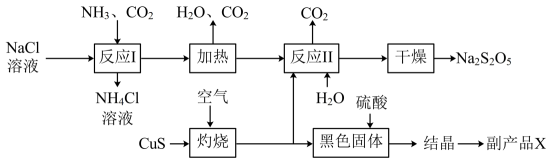 (1)、反应1的化学方程式为;在进行反应时,向溶液中先通入 (填“” 或“”);(2)、已知“灼烧时会生成 , 则其化学方程式为;(3)、已知与稀硫酸反应会生成 , 则其离子方程式为;(4)、副产品X化学式为;该生产中可循环利用的物质为(化学式)。(5)、为了减少产品中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为。
(1)、反应1的化学方程式为;在进行反应时,向溶液中先通入 (填“” 或“”);(2)、已知“灼烧时会生成 , 则其化学方程式为;(3)、已知与稀硫酸反应会生成 , 则其离子方程式为;(4)、副产品X化学式为;该生产中可循环利用的物质为(化学式)。(5)、为了减少产品中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为。 -
3、某学习小组探究潮湿的与反应的产物,进行如下实验:
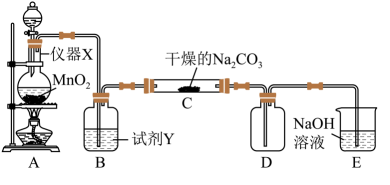
请回答:
(1)、仪器X的名称是:。(2)、装置E的作用是:;试剂Y是。(3)、请写出装置A中发生的离子方程式。(4)、装置C中潮湿的与以等物质的量反应,生成、气体和另一种盐,试写出该反应化学方程式:。(5)、设计实验方案验证C中生成的固体中存在。 -
4、化学研究中应当学会实验与探究、归纳与演绎、分析与综合等方法的运用。回答下列问题:(1)、I.现有下列10种物质:
①冰水混合物 ②有色玻璃 ③ ④ ⑤熔融 ⑥溶液 ⑦ ⑧硫酸溶液 ⑨ ⑩固体。
属于分散系的是 , 属于强电解质且能导电的是 , 属于非电解质的是。(2)、向⑥溶液中滴加用⑩物质配制的溶液,至恰好完全沉淀时的离子方程式:。(3)、Ⅱ.完成下列问题溶液能用作中毒的解毒剂反应可生成P的最高价含氧酸和铜;该反应的化学方程式是。
(4)、汽车剧烈碰撞时,安全气囊中发生反应:。该反应中氧化产物与还原产物的质量比为;若氧化产物比还原产物多 , 则反应生成的在标准状况下的体积为L。 -
5、已知碳酸氢钙是一种易溶于水的白色固体,受热易分解。某小组取质量为的碳酸氢钙样品进行加热分解实验,加热过程中剩余固体的质量随加热时间的变化如图一所示。经查阅资料发现,碳酸氢钙能与盐酸反应,也能与石灰水反应。于是,他们构建了由碳酸氢钙转化为二氧化碳的不同路径反应转化关系如图二、
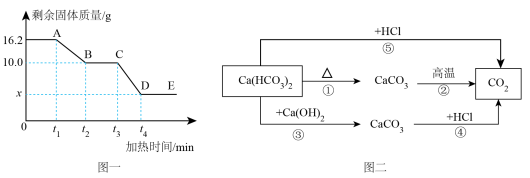
下列说法错误的是( )
A、图一中,A、C、D三点对应的固体中所含钙元素质量相等 B、图一中,若向A点所示固体中加入足量稀盐酸,充分反应生成的质量为 C、图二中,相同质量的在反应①、②生成的总质量大于反应④生成的质量 D、图二中,相同质量的在反应⑤中消耗的质量小于在反应④中消耗的质量 -
6、向含的溶液中通入一定体积的使其充分反应,再向所得溶液中逐滴滴加稀盐酸。测得产生的物质的量随加入的物质的量变化如图所示。则下列说法错误的是( )
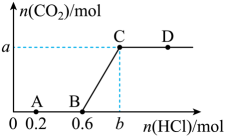 A、A点之前发生的离子反应为 B、图中的 C、在D点对应的溶液中,不能大量共存 D、向氢氧化钠溶液中通入的体积为
A、A点之前发生的离子反应为 B、图中的 C、在D点对应的溶液中,不能大量共存 D、向氢氧化钠溶液中通入的体积为 -
7、一定温度和压强下,用质量相等的四种气体吹出四个体积大小不同的气球,下列说法中不正确的是( )
 A、气球②中装的是 B、气球①和气球③中气体分子数相等 C、气球①和气球②中原子数之比为 D、气球③和气球④中气体体积之比为
A、气球②中装的是 B、气球①和气球③中气体分子数相等 C、气球①和气球②中原子数之比为 D、气球③和气球④中气体体积之比为 -
8、下列实验方案中,不能测定和固体混合物中质量分数的是( )A、取混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 B、取混合物与足量稀盐酸充分反应,加热、蒸干灼烧,得固体 C、取混合物充分加热,固体质量减少 D、取混合物与足量溶液充分反应,过滤、洗涤、烘干,得固体
-
9、下列说法错误是( )A、分别以高锰酸钾、氯酸钾、过氧化氢为原料制取相同质量的氧气,转移的电子的物质的量之比为 B、已知在碱性溶液中可发生反应: , 则中R的化合价是+6 C、在碱性条件下可被氧化为 , 而被还原为 , 若反应中与的物质的量之比为 , 则x值为5 D、与一定浓度的溶液反应,生成和。当的个数之比为时,平参加反应的与的物质的量之比为
-
10、亚氯酸钠()是一种重要的含氯消毒剂,制备亚氯酸钠的工艺流程如下:
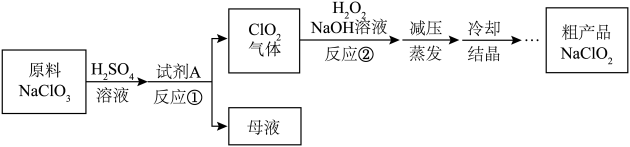
下列说法正确的是( )
A、溶解时若将稀换成盐酸,会发生反应: B、试剂A应选择一种安全、成本低的氧化剂 C、反应②的化学方程式为: D、氧化性: -
11、三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。实验室可用图装置制取ICl3 , 制备的反应原理:I2+3Cl2=2ICl3 下列说法不正确的是( )
 A、利用装置甲制备氯气选用的药品可以是高锰酸钾和浓盐酸 B、装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞 C、装置丙中氯化钙的作用是干燥Cl2 D、装置戊中的碱石灰可以用无水氯化钙代替
A、利用装置甲制备氯气选用的药品可以是高锰酸钾和浓盐酸 B、装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞 C、装置丙中氯化钙的作用是干燥Cl2 D、装置戊中的碱石灰可以用无水氯化钙代替 -
12、下列离子方程式书写错误的是( )A、向溶液滴加少量溶液: B、向溶液中加入足量溶液: C、向饱和溶液中通入过量气体: D、新制氯水中加入少量:
-
13、下列有关实验操作正确的是( )

 A、装置①制取少量氧气并可以控制反应停止 B、装置②制取氢氧化铁胶体 C、装置③验证热稳定性: D、装置④制取少量
A、装置①制取少量氧气并可以控制反应停止 B、装置②制取氢氧化铁胶体 C、装置③验证热稳定性: D、装置④制取少量 -
14、用如图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
 A、向硫化钠溶液中通入氯气 B、向硝酸银溶液中通入少量氯化氢 C、向饱和溶液中通入 D、向氢氧化钠溶液中通入少量氯气
A、向硫化钠溶液中通入氯气 B、向硝酸银溶液中通入少量氯化氢 C、向饱和溶液中通入 D、向氢氧化钠溶液中通入少量氯气 -
15、已知反应:(已知的沸点为-114℃,且氟元素的化合价为-1)。若为阿伏加德罗常数的值,下列叙述错误的是( )A、若消耗(标准状况)时该反应转移的电子数为 B、若消耗(标准状况)时,生成的还原产物的物质的量为 C、在0℃、下,和混合后的体积约为 D、在常温常压下,和的密度之比为
-
16、分类法是学习和研究化学的一种常用科学方法,下列说法正确的个数有( )
①(次磷酸)与足量的反应生成盐 , 属于一元酸
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③由同种元素组成的物质一定是单质
④蔗糖和水分别属于非电解质和电解质
⑤既有单质参加又有单质生成的反应一定是氧化还原反应
⑥根据丁达尔现象可以将分散系分为溶液、胶体和浊液
⑦、都能与水反应生成 , 二者均为碱性氧化物
⑧“火树银花”火树就是指焰火,俗称烟花,是金属的焰色试验,焰色试验属于物理变化
A、3个 B、4个 C、5个 D、6个 -
17、下列有关化学用语的说法正确的是( )A、碳酸氢钠在水溶液中的电离方程式为: B、中铁元素的化合价是+3 C、氧化还原反应中电子转移方向和数目的表示:
 D、常温常压下的摩尔质量为
D、常温常压下的摩尔质量为
-
18、朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( )A、薄雾是均一、透明的 B、胶体的电泳现象 C、薄雾中分散质微粒直径约为 D、薄雾中分散质微粒进行布朗运动
-
19、下列说法错误的是( )A、化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然科学 B、化学已成为自然科学领域中一门“中心的、实用的和创造性的基础科学 C、化学变化是自然界中物质变化的所有形式 D、将宏观与微观联系起来研究物质及其变化是化学的特点和魅力所在
-
20、以乙苯催化脱氢来制取乙烯,是化工产业中常用的方法如下所示:
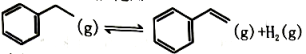 (1)、在催化作用下将乙苯加入三个恒容密闭容器发生上述反应。相关数据如下:
(1)、在催化作用下将乙苯加入三个恒容密闭容器发生上述反应。相关数据如下:容器
容积/L
温度/℃
起始量/mol
平衡量/mol
苯乙烯(g)
乙苯(g)
氢气(g)
苯乙烯(g)
甲
1
3
0
0
1
乙
1
4
3
2
x
丙
1
5
0
0
2.5
①时,向乙容器中按表格中数据投料,则此时(填写“>”“=”“<”);
②(填写“>”“=”“<”);请解释原因。
③乙苯脱氢经历如图所示:

该环节中,温度较低时,更有利于发生的“环节”是;该催化剂在使用过程中,失活现象比较严重,由此推断“脱氢环节”除了产生 , 还会生成离开催化剂表面。
(2)、为了节省能源,乙苯催化脱氢制苯乙烯的过程可以在气氛下进行。100kPa下,反应气组成 , 按照1∶0;1∶1;1∶5;1∶9投料,乙苯平衡转化率随反应温度变化关系如图。图中的曲线是(填曲线标号) (3)、工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂活性,其原因是。
(3)、工业乙苯催化脱氢生产苯乙烯时,会产生少量积碳,加入一定温度的水蒸气可较长时间保持催化剂活性,其原因是。