相关试卷
-
1、下列各组对装置及相关实验的描述正确的是( )
 A、用装置①从NaCl溶液中提取NaCl晶体 B、用装置②检验的漂白性 C、用装置③干燥 D、实验室用装置④制备
A、用装置①从NaCl溶液中提取NaCl晶体 B、用装置②检验的漂白性 C、用装置③干燥 D、实验室用装置④制备 -
2、工业上从硒化亚铜中提取Se的反应之一为。下列与该反应有关的化学用语表述正确的是( )A、的电子式为
 B、的空间结构是三角锥形
C、键角:
D、基态Se原子核外电子有34种空间运动状态
B、的空间结构是三角锥形
C、键角:
D、基态Se原子核外电子有34种空间运动状态
-
3、氯化缬草素是一种广谱除草剂,通过抑制植物的芽分裂活性来达到除草效果,其结构简式如图所示。下列有关说法错误的是( )
 A、氯化缬草素不属于芳香族化合物 B、1mol氯化缬草素最多能与5mol 反应 C、氯化缬草素能使酸性溶液和溴水褪色 D、氯化缬草素能发生水解、氧化、加成等反应
A、氯化缬草素不属于芳香族化合物 B、1mol氯化缬草素最多能与5mol 反应 C、氯化缬草素能使酸性溶液和溴水褪色 D、氯化缬草素能发生水解、氧化、加成等反应 -
4、中华文化源远流长,文物是一个国家文化的延续和承载,是民族精神的结晶。下列文物所用原料富含纤维素的是( )
选项
A
B
文物


名称
青花瓷
象牙笔筒
选项
C
D
文物


名称
竹简书
龙纹铜方壶
A、A B、B C、C D、D -
5、化合物(H)是一种可治疗癌症药物的中间体,其合成路线如下:

已知:
回答下列问题:
(1)、由A生成B的反应类型为。(2)、C的化学名称是。(3)、由D生成E的化学反应方程式为。(4)、F的结构简式为。(5)、H中的含氧官能团名称为 , 其中N原子的杂化轨道类型为。(6)、化合物B的同分异构体中能同时满足下列条件的有(填标号)。(ⅰ)能发生银镜反应;(ⅱ)苯环上含有两个取代基。
a.3种 b.6种 c.7种 d.9种
其中,谱显示为四组峰,且峰面积比为2∶2∶2∶1的同分异构体的结构简式为、。
-
6、“碳达峰、碳中和”是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求,因此,二氧化碳的合理利用成为研究热点。回答下列问题:
Ⅰ.加氢可以合成甲醇,该过程主要发生如下反应
① kJ⋅mol
② kJ⋅mol
(1)、反应③的kJ⋅mol , 平衡常数(用含、表示),反应在(“高温”“低温”或“任何温度”)条件下能自发进行。(2)、Ⅱ.加氢可以合成甲烷向某密闭容器中充入一定量的和 , 在压强为条件下发生反应: 。在不同条件下达到平衡,设体系中的平衡转化率为 , 在温度为下的、在下的如图所示。

(ⅰ)生成物中的键角比的(“大”或“小”)。
(ⅱ)在下的关系是m,理由是(从平衡移动角度分析)。
(ⅲ)在、和下,若最初充入1 mol , 反应经10 min达到平衡状态,则mol,。[用表示,列出算式,]。
-
7、镍、钴均是一种重要的战略资源,广泛应用于飞机发动机、锂离子电池等领域。以红土镍矿常压盐酸浸液(含、、、、和)为原料提取Ni、Co。工艺流程如下:

已知(常温下):
物质
回答下列问题:
(1)、滤渣1的成分是、。(2)、“调”时,发生反应的主要化学方程式为。(3)、“碱性氧化”时,由转化为的离子方程式为 , 常温下,若pH控制为9,则溶液中浓度最多为mol·L。(4)、“析晶”时,通入的酸性气体A为(化学式)。(5)、①“电解”时Ni在(“阴”或“阳”)极析出。②Ni可以进一步制备超导体 , 其立方晶胞如图。C与Ni最小间距小于Ni与Mg最小间距,x为整数,则Ni在晶胞中的位置为(“顶点”“面心”或“体心”),晶体中一个C周围与其最近的Ni的个数为。

-
8、草酸合铜酸钾()是一种重要的化工原料,实验室可以通过氧化铜和草酸氢钾反应进行制备,具体步骤如下:
Ⅰ.称取2.0 g (g⋅mol),用40 mL水溶解,再加入10 mL 2 mol⋅L NaOH溶液,加热至沉淀由蓝色变为黑色。
Ⅱ.继续煮沸15 min,稍冷后过滤,洗涤沉淀三次。
Ⅲ.称取3.0 g , 用80 mL水微热溶解。稍冷后分数次加入适量固体,制得和混合溶液。
Ⅳ.将Ⅲ的溶液加热至80~85℃,再加入Ⅰ中的黑色沉淀,充分反应至沉淀溶解后,趁热过滤。
V.取滤液,经多步操作,得到固体(g⋅mol)。将固体用滤纸吸干后称量,质量为1.77 g。
回答下列问题:
(1)、步骤Ⅰ中使用的部分仪器如下。
仪器c的名称是 , 加快溶解的操作有。
(2)、步骤Ⅱ中检验沉淀是否洗涤干净的操作和现象为。(3)、步骤Ⅳ中加入氧化铜后,由生成的化学方程式为。(4)、步骤Ⅴ中多步操作包括: , , 过滤,洗涤。(5)、本实验的产率为。 -
9、常温下,向20 mL浓度均为0.1 mol⋅L盐酸和醋酸()的混合溶液中滴加0.1 mol⋅L的氨水(),测得混合溶液的电阻率(电阻率越大,导电能力越弱)与加入氨水的体积的关系如图所示(忽略混合时体积变化),下列叙述正确的是( )
 A、a→c过程中,逐渐增大 B、c→d过程中,水的电离程度一直增大 C、c点溶液中, D、d点时,
A、a→c过程中,逐渐增大 B、c→d过程中,水的电离程度一直增大 C、c点溶液中, D、d点时, -
10、钠硒电池具有能量密度大、成本低等优点,被认为是富有潜力的新一代室温钠离子电池。某科研团队设计的钠硒电池模型如图所示。下列叙述错误的是( )
 A、放电时,电极N的电势高于电极M B、放电时,M电极附近不能选用水系电解液 C、充电时,从N电极向M电极迁移 D、充电时,N极上的反应式为:
A、放电时,电极N的电势高于电极M B、放电时,M电极附近不能选用水系电解液 C、充电时,从N电极向M电极迁移 D、充电时,N极上的反应式为: -
11、研究化学反应的机理对于合成特定有机物具有重要意义,已知烯烃与氢卤酸(HX)加成反应分步进行:
①

②

根据下图中所示的丙烯与HCl反应两种可能反应路径的势能图(TS-1与TS-2分别是两种过渡态的碳正离子),下列说法正确的是( )
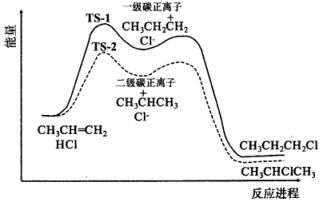 A、一级碳正离子比二级碳正离子稳定 B、决定烯烃与HX加成反应速率的关键步骤是② C、相同时间内,产物中所占比例更大 D、含3个C以上的烯烃与HCl加成时均会有两种路径
A、一级碳正离子比二级碳正离子稳定 B、决定烯烃与HX加成反应速率的关键步骤是② C、相同时间内,产物中所占比例更大 D、含3个C以上的烯烃与HCl加成时均会有两种路径 -
12、肌红蛋白具有存储氧气的作用,由一个球蛋白和一个血红素基团(a)组成,氧分子和血红素基团结合形成b;当吸入CO时,肌红蛋白失去储氧能力。下列说法错误的是( )
 A、血红素基团中铁元素的化合价为+2价 B、a与b中铁的配位数相同 C、血红素基团中元素电负性: D、与肌红蛋白配位能力弱于CO
A、血红素基团中铁元素的化合价为+2价 B、a与b中铁的配位数相同 C、血红素基团中元素电负性: D、与肌红蛋白配位能力弱于CO -
13、新型碲化镉(CdTe)太阳能电池能量转化效率较高,立方晶系CdTe的晶胞结构如图所示,晶胞参数为apm(已知Te与O同族)。下列说法正确的是( )
 A、碲原子的价层电子数为4 B、Cd的配位数为4 C、晶胞中Cd与Te的最短距离为pm D、晶体的密度为g⋅cm
A、碲原子的价层电子数为4 B、Cd的配位数为4 C、晶胞中Cd与Te的最短距离为pm D、晶体的密度为g⋅cm -
14、以下实验目的对应的实验方案最合适的是( )
实验方案
实验目的
A
向溴乙烷中加入NaOH溶液,水浴加热,静置,取少量上层清液,然后加入2滴溶液。
验证溴乙烷是否发生水解反应
B
分别向两支大小相同的试管中加入2 mL 5%溶液,同时再分别滴加2滴1 mol·L的溶液、溶液
比较和的催化效果
C
向溶液中滴加稀盐酸
比较Si和Cl的非金属性
D
分别向相同体积、1 mol·L的盐酸和醋酸中加入等量铁粉
比较盐酸和醋酸的酸性强弱
A、A B、B C、C D、D -
15、碳酸氢钠溶液中碳酸氢根离子以氢键相连成二聚离子,其结构如图所示。

下列有关说法错误的是( )
A、键能: B、的空间结构:平面三角形 C、溶解度: D、形成发生了化学反应 -
16、吉非替尼可增加肿瘤细胞的凋亡,其中含有M、Q、W、X、Y、Z六种短周期元素,M的某种核素没有中子,它们在周期表中的相对位置如下所示,其中W元素原子的价层电子排布式为 , 下列说法正确的是( )
 A、第一电离能:X>W>Q B、简单气态氢化物的稳定性:Y>Z C、W的含氧酸均为强酸 D、Q元素形成的单质一定是分子晶体
A、第一电离能:X>W>Q B、简单气态氢化物的稳定性:Y>Z C、W的含氧酸均为强酸 D、Q元素形成的单质一定是分子晶体 -
17、下列表述对应的离子方程式书写错误的是( )A、向溶液中加入足量氨水: B、用溶液除去乙炔中的: C、通入冷的NaOH溶液: D、向溶液中加入稀硫酸:
-
18、杜仲是贵州三宝药材之一,已知杜仲中含有一种名为杜仲甙的有机物,具有清湿热、保肝护肝、抗肿瘤等作用,其结构如图所示。下列有关杜仲甙的说法错误的是( )
 A、含有两种含氧官能团 B、分子中只有1个手性碳原子 C、分子中所有原子不可能共平面 D、该分子能发生加成反应、氧化反应、消去反应
A、含有两种含氧官能团 B、分子中只有1个手性碳原子 C、分子中所有原子不可能共平面 D、该分子能发生加成反应、氧化反应、消去反应 -
19、《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅……而后火药成声”,涉及的主要反应为。设为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L 中含有的π键数为 B、1 mol 分子中的电子总数为 C、常温下,1 mol⋅L 溶液中数为 D、12 g C完全反应转移电子数为
-
20、利用下列装置进行实验(部分夹持装置略),能达到实验目的的是( )
 A、甲用于制备乙炔气体 B、乙用于测量的体积 C、丙用于灼烧得到 D、丁用于除去中的HCl气体
A、甲用于制备乙炔气体 B、乙用于测量的体积 C、丙用于灼烧得到 D、丁用于除去中的HCl气体