相关试卷
-
1、常温下,将、的悬浊液分别置于分压固定的气相中,体系中(X为、、、、)与pH的关系如图所示。
已知:。

下列说法正确的是( )
A、当时, B、 C、该体系的悬浊液中始终存在 D、当时, -
2、将转化为的途径有如下两种:
反应I:无时,
反应Ⅱ:有时,
向密闭容器甲中投入 , 向密闭容器乙中投入和 , 相同时间内测得的转化率随温度的变化情况如图所示。

下列说法正确的是( )
A、两个反应的均大于0 B、X点时两个容器中的正反应速率相同 C、容器甲中的反应达到平衡后,再投入 , 则的平衡转化率增大 D、图中Y点对应的平衡常数 -
3、南开大学某课题组采用新合成路线,合成出新型的二元团簇离子 , 其结构如图所示。下列有关说法错误的是( )
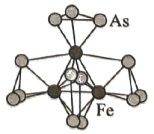 A、固体是离子晶体 B、3个形成正三角形 C、含极性键、非极性键 D、存在5种不同化学环境的
A、固体是离子晶体 B、3个形成正三角形 C、含极性键、非极性键 D、存在5种不同化学环境的 -
4、连二亚硫酸钠()俗称保险粉,可用作造纸工业中的漂白剂,将部分有色物质还原为无色物质,提高纸浆白度。已知亚硫酸的结构式为
 , 实验室利用如下流程进行制备: , 装置如图所示。下列说法错误的是( )
, 实验室利用如下流程进行制备: , 装置如图所示。下列说法错误的是( ) A、实验室利用亚硫酸钠制备时,应选择70%的浓硫酸 B、单向阀的作用是只让气体通过并防倒吸 C、加入的NaOH不宜过多,防止生成难以分离的 D、尾气可用溶液处理
A、实验室利用亚硫酸钠制备时,应选择70%的浓硫酸 B、单向阀的作用是只让气体通过并防倒吸 C、加入的NaOH不宜过多,防止生成难以分离的 D、尾气可用溶液处理 -
5、一种双极膜电池可长时间工作,其工作原理如图所示。已知双极膜中间层中的解离为和。下列说法错误的是( )
 A、电极电势:电极电极 B、双极膜中解离出的透过膜q向Cu电极移动 C、Cu电极的电极反应式为 D、双极膜中质量每减少18g,左侧溶液中硫酸质量减少98g
A、电极电势:电极电极 B、双极膜中解离出的透过膜q向Cu电极移动 C、Cu电极的电极反应式为 D、双极膜中质量每减少18g,左侧溶液中硫酸质量减少98g -
6、设为阿伏加德罗常数的值。下列说法正确的是( )A、时,的溶液中的数目为 B、标准状况下,中所含分子数为 C、中含有的电子数和质子数均为 D、中含有的键数为
-
7、下列陈述I和陈述II均正确,且有因果关系的是( )
选项
陈述I
陈述II
A
用计测得等浓度的2-氯丙酸与2-氟丙酸溶液的分别为和 , 且
2-氯丙酸中键的极性大于2-氟丙酸中键的极性
B
将氨气溶于水,进行导电性实验,灯泡亮
氨气是电解质
C
向溶液中通入足量再滴加溶液,溶液不显红色
还原性:
D
取少量涂改液,向其中加入足量硝酸银溶液,溶液出现白色沉淀
涂改液所含卤代烃中存在氯元素
A、A B、B C、C D、D -
8、某同学利用W形管和V形管安装了下面微型实验装置,进行的制备及探究的漂白性实验。下列说法正确的是( )
 A、固体粉末甲为二氧化锰 B、鲜花花瓣褪色说明具有漂白性 C、W形管和V形管的玻璃泡能防止倒吸 D、溶液乙为碱液,与安全气球共同防止逸出
A、固体粉末甲为二氧化锰 B、鲜花花瓣褪色说明具有漂白性 C、W形管和V形管的玻璃泡能防止倒吸 D、溶液乙为碱液,与安全气球共同防止逸出 -
9、三烯丙基异氰脲酸酯是一种助交联剂,其结构如图所示。下列有关三烯丙基异氰脲酸酯的说法错误的是( )
 A、该有机物含有2种官能团 B、该有机物的单体分子中所有原子均共面 C、该有机物能发生加成反应、水解反应、氧化反应 D、该有机物最多能与发生加成反应
A、该有机物含有2种官能团 B、该有机物的单体分子中所有原子均共面 C、该有机物能发生加成反应、水解反应、氧化反应 D、该有机物最多能与发生加成反应 -
10、劳动有利于“知行合一”。下列劳动项目与所述的化学知识有关联的是( )
选项
劳动项目
化学知识
A
环保行动:用净水
具有氧化性
B
义务劳动:用75%的乙醇溶液做消毒剂对栏杆消毒
乙醇具有还原性
c
帮厨活动:蒸馒头用小苏打做膨松剂
能与酸反应,受热易分解
D
工业生产:用氢氟酸雕刻玻璃花纹
HF具有弱酸性
A、A B、B C、C D、D -
11、Z是一种治疗狂躁症药物的中间体,其合成过程如图所示。下列说法错误的是( )
 A、X→Y的反应为取代反应 B、Z分子中所有碳原子可能共平面 C、1 mol Y最多消耗3 mol NaOH D、Y的同分异构体中存在五元环酯且苯环上只有1个取代基的有9种(不考虑立体异构)
A、X→Y的反应为取代反应 B、Z分子中所有碳原子可能共平面 C、1 mol Y最多消耗3 mol NaOH D、Y的同分异构体中存在五元环酯且苯环上只有1个取代基的有9种(不考虑立体异构) -
12、下列有关物质结构和性质的说法,错误的是( )A、的沸点较低与分子内氢键有关 B、油脂的酯基在酸性或碱性条件下都可以发生水解反应 C、合金的硬度大于其成分金属,是因为原子有规则的排列发生了改变 D、“杯酚”的空腔大小适配 , 二者通过化学键形成分子
-
13、下列有关实验室仪器和试剂的使用说法错误的是( )A、进行钾与水反应的实验,可用培养皿代替小烧杯 B、实验室使用试管和烧瓶加热液体时,所盛液体体积应介于其容积的之间 C、制备硝基苯时用到的混酸,可通过将浓硫酸缓缓注入浓硝酸中获得 D、用苯进行萃取溴水中的溴的实验时,振荡后打开分液漏斗的活塞及时放气
-
14、建设美丽乡村,守护中华家园,衣食住行皆化学。下列与食品有关的叙述中没有涉及氧化还原反应的是( )A、用葡萄糖酸—δ—内酯做食品的凝固剂品 B、用抗坏血酸做食品抗氧化剂 C、将植物油氢化,以便运输和储存 D、使用臭氧代替氯气进行自来水消毒
-
15、科教兴国,我国科技发展在多个领域获得突破。下列说法错误的是( )A、新能源甲醇燃料电池汽车在行驶时其能量的转化形式:电能→化学能 B、新一代航空发动机陶瓷基复合材料:具有耐高温、耐腐蚀特性 C、X射线衍射实验:深度解析复杂晶体结构的晶胞参数 D、火焰喷雾技术制备纳米材料:在高温火焰喷雾中形成的胶体属于气溶胶
-
16、中华民族有着光辉灿烂的历史和文化。下列说法正确的是( )

战国·曾侯乙编钟

秦·兵马俑
A.编钟属于青铜制品,青铜是一种金属
B.兵马俑用陶土烧制而成,属于合成高分子材料

宋·《千里江山图》

明·皮影戏
C.《千里江山图》是绢本设色画,绢的主要成分是纤维素
D.皮影戏人偶用牛皮制作,牛皮主要成分是蛋白质
A、A B、B C、C D、D -
17、如图是利用芳香烃A制备聚酯类化合物G的流程图。

已知:


回答下列问题:
(1)、A的名称为 , D的结构简式为。(2)、反应④、⑤的反应类型分别是、。(3)、设计反应③、⑤的目的是。(4)、写出反应⑥的化学方程式:。(5)、同时符合下列条件的F的同分异构体有种(不含立体异构)。①遇FeCl3溶液显紫色
②能够发生银镜反应
③结构中不含有-O-O-键,核磁共振氢谱显示有4组峰,峰面积之比为1∶l∶2∶2
其中在溶液中能够与NaOH以物质的量之比1:3发生反应的物质的结构简式为。
(6)、以对甲基苯酚和甲醇为原料,制备对羟基苯甲酸甲酯的路线如下:
则M中官能团的名称为 , 条件Ⅰ为 , N的结构简式为。
-
18、2024年3月4日全国“两会”正式拉开帷幕,资源和环境问题仍是社会关注的焦点。碳利用是从工业,能源生产等排放源或空气中捕集分离CO2 , 然后将其输送到适宜的场地加以利用,其中CO催化加氢合成CH3OH是一种实现碳利用的重要方法。回答下列问题:(1)、二氧化碳加氢制甲醇涉及的反应可表示为:
反应Ⅰ.CO(g)+2H2(g)CH3OH(g)
反应Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(l)
反应Ⅲ.H2O(1)H2O(g)
根据上述反应求CO(g)+H2O(g)CO2(g)+H2(g)的kJ·mol-1 , 该反应的活化能Ea(正)Ea(逆)(填“大于”“小于”或“等于”)。
(2)、已知反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应机理历程如图所示(吸附在催化剂表面的物质用“*”标注,如“”表示CO2吸附在催化剂表面):
该反应历程中决速步反应能垒为eV。
(3)、一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系。0

其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为(填“M”或“N”),b点对应的平衡常数Kp=MPa-2(Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(4)、利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2 , 还原制备碳基燃料(包括CO、烷烃和酸质子交换膜等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段,其装置原理如图所示:
①电池工作过程中,图中Pt电极附近溶液的pH(填“变大”或“变小”)。
②写出阴极区的电极反应式:。
-
19、二氧化饰(CeO2)是一种重要的稀土氧化物,可以用于光催化降解有机污染物,利用氟碳饰矿(主要成分为CeCO3F,含Fe2O3、FeO等杂质)制CeOz的工艺流程如下:

已知:①滤渣Ⅰ主要成分是难溶于水的Ce(BF4)3。
②Ce3+在空气中易被氧化为Ce4+。
回答下列问题:
(1)、CeCO3F中Ce元素的化合价为。(2)、焙烧氟碳铈矿时,提高焙烧效率的措施有(写出两种),实验室进行焙烧操作时一般在中进行。(3)、CeCO3F在焙烧时发生反应的化学方程式为。(4)、上述流程中所加的盐酸要适当过量,其目的是 , 操作中可用硫酸和H2O2替换盐酸,其优点是。(5)、写出从滤液Ⅱ中沉淀铈的离子方程式:。 -
20、水合肼(N2H4·H2O)作为一种重要的精细化工原料,主要用于合成AC、D1PA,TSH等发泡剂。工业上常用尿素[CO(NH2)2]、NaOH、NaClO溶液反应制备水合肼。
已知:①Cl2与NaOH反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3。
②N2H4·H2O沸点为118℃,具有强还原性。
回答下列问题:
Ⅰ.制备NaClO溶液(实验装置如图所示):
 (1)、配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和。(2)、装置C中发生反应的离子方程式为 , 用冰水浴控制温度在25℃以下,其主要目的是。(3)、Ⅱ.制备水合肼:
(1)、配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和。(2)、装置C中发生反应的离子方程式为 , 用冰水浴控制温度在25℃以下,其主要目的是。(3)、Ⅱ.制备水合肼:将制得的NaClO与NaOH的混合溶液滴入尿素水溶液中,在一定温度下加热,装置如图所示(夹持及控温装置已略),充分反应后,仪器X中的溶液经蒸馏获得水合肼粗品,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。

仪器X的名称是 , X中发生反应的化学方程式是。
(4)、若滴加NaClO溶液的速度较快时,水合肼的产率会下降,原因是。(5)、水合肼是二元弱碱,在溶液中可发生类似NH3·H2O的电离。写出水合肼和HCl控物质的量之比为1∶1反应的离子方程式:。(6)、实验室可用碘测定水合肼的浓度,称取5.0g水合肼样品,加入适量水、稀硫酸、碳酸氢钠,配成500mL溶液,从中取出20.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.200mol·L-1I2标准溶液进行滴定,滴定终点的现象是 , 测得消耗标准溶液的体积为24.00mL,则样品中水合肼(N2H4·H2O)的质量分数为(已知:N2H4·H2O+2I2+H2SO4+6NaHCO3=N2↑+4NaI+6CO2↑+Na2SO4+7H2O)。