相关试卷
-
1、测定铁矿石中铁含量的传统方法是SnCl2—HgCl2—K2Cr2O7滴定法。研究小组用该方法测定质量为ag的某赤铁矿试样中的铁含量。
【配制溶液】
①cmol•L﹣1K2Cr2O7标准溶液。
②SnCl2溶液:称取6gSnCl2•2H2O溶于20mL浓盐酸,加水至100mL,加入少量锡粒。
【测定含量】按如图所示(加热装置略去)操作步骤进行实验。

已知:氯化铁受热易升华;室温时HgCl2可将Sn2+氧化为Sn4+ , 难以氧化Fe2+;
 可被Fe2+还原为Cr3+。
可被Fe2+还原为Cr3+。回答下列问题:
(1)、下列仪器在本实验中必须用到的有 (填名称)。 (2)、结合离子方程式解释配制SnCl2溶液时加入锡粒的原因:。(3)、步骤Ⅰ中“微热”的原因是 。(4)、步骤Ⅲ中,若未“立即滴定”,则会导致测定的铁含量 (填“偏大”“偏小”或“不变”)。(5)、若消耗cmol•L﹣1K2Cr2O7标准溶液VmL,则ag试样中Fe的质量分数为 (用含a、c、V的代数式表示)。(6)、SnCl2—TiCl3—KMnO4滴定法也可测定铁的含量,其主要原理是利用SnCl2和TiCl3将铁矿石试样中Fe3+还原为Fe2+ , 再用KMnO4标准溶液滴定。
(2)、结合离子方程式解释配制SnCl2溶液时加入锡粒的原因:。(3)、步骤Ⅰ中“微热”的原因是 。(4)、步骤Ⅲ中,若未“立即滴定”,则会导致测定的铁含量 (填“偏大”“偏小”或“不变”)。(5)、若消耗cmol•L﹣1K2Cr2O7标准溶液VmL,则ag试样中Fe的质量分数为 (用含a、c、V的代数式表示)。(6)、SnCl2—TiCl3—KMnO4滴定法也可测定铁的含量,其主要原理是利用SnCl2和TiCl3将铁矿石试样中Fe3+还原为Fe2+ , 再用KMnO4标准溶液滴定。①从环保角度分析,该方法相比于SnCl2—HgCl2—K2Cr2O7滴定法的优点是 。
②为探究KMnO4溶液滴定时,Cl﹣在不同酸度下对Fe2+测定结果的影响,分别向下列溶液中加入1滴0.1mol•L﹣1KMnO4溶液,现象如表:
溶液
现象
空白实验
2mL0.3mol•L﹣1NaCl溶液+0.5mL试剂X
紫红色不褪去
实验ⅰ
2mL0.3mol•L﹣1NaCl溶液+0.5mL0.1mol•L﹣1硫酸
紫红色不褪去
实验ⅱ
2mL0.3mol•L﹣1NaCl溶液+0.5mL6mol•L﹣1硫酸
紫红色明显变浅
表中试剂X为 ;根据该实验可得出的结论是 。
-
2、精炼铜产生的铜阳极泥富含Cu、Ag、Au等多种元素。研究人员设计了一种从铜阳极泥中分离提取金和银的流程,如图所示。
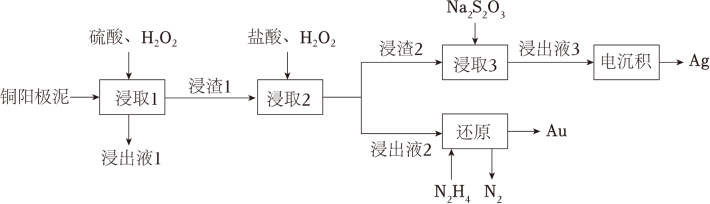
回答下列问题:
(1)、Cu位于元素周期表第 周期第 族。(2)、“浸出液1”中含有的金属离子主要是 。(3)、“浸取2”步骤中,单质金转化为HAuCl4的化学方程式为 。(4)、“浸取3”步骤中,“浸渣2”中的 (填化学式)转化为 。 (5)、“电沉积”步骤中阴极的电极反应式为 。“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为 (填化学式)。(6)、“还原”步骤中,被氧化的N2H4与产物Au的物质的量之比为 。(7)、Na2S2O3可被I2氧化为Na2S4O6。从物质结构的角度分析
。 (5)、“电沉积”步骤中阴极的电极反应式为 。“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为 (填化学式)。(6)、“还原”步骤中,被氧化的N2H4与产物Au的物质的量之比为 。(7)、Na2S2O3可被I2氧化为Na2S4O6。从物质结构的角度分析 的结构为(a)而不是(b)的原因:。
的结构为(a)而不是(b)的原因:。
-
3、研究人员制备了一种具有锂离子通道的导电氧化物(LixLayTiO3),其立方晶胞和导电时Li+迁移过程如图所示。已知该氧化物中Ti为+4价,La为+3价。下列说法错误的是( )
 A、导电时,Ti和La的价态不变 B、若 , Li+与空位的数目相等 C、与体心最邻近的O原子数为12 D、导电时,空位移动方向与电流方向相反
A、导电时,Ti和La的价态不变 B、若 , Li+与空位的数目相等 C、与体心最邻近的O原子数为12 D、导电时,空位移动方向与电流方向相反 -
4、环境保护工程师研究利用Na2S、FeS和H2S处理水样中的Cd2+。
已知25℃时,H2S饱和溶液浓度约为0.1mol•L﹣1 , Ka1(H2S)=10﹣6.97 , Ka2(H2S)=10﹣12.90 , Ksp(FeS)=10﹣17.20 , Ksp(CdS)=10﹣26.10。
下列说法错误的是( )
A、Na2S溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+2c(S2﹣) B、0.01mol•L﹣1Na2S溶液中:c(Na+)>c(S2﹣)>c(OH﹣)>c(HS﹣) C、向c(Cd2+)=0.01mol•L﹣1的溶液中加入FeS,可使c(Cd2+)<10﹣8mol•L﹣1 D、向c(Cd2+)=0.01mol•L﹣1的溶液中通入H2S气体至饱和,所得溶液中:c(H+)>c(Cd2+) -
5、室温下,为探究纳米铁去除水样中
 的影响因素,测得不同条件下
的影响因素,测得不同条件下 浓度随时间变化关系如图。
浓度随时间变化关系如图。实验序号
水样体积/mL
纳米铁质量/mg
水样初始pH
①
50
8
6
②
50
2
6
③
50
2
8

下列说法正确的是( )
A、实验①中,0~2小时内平均反应速率v()=2.0mol•L﹣1•h﹣1 B、实验③中,反应的离子方程式为:2Fe++8H+═2Fe3++Se+4H2O C、其他条件相同时,适当增加纳米铁质量可加快反应速率 D、其他条件相同时,水样初始pH越小,的去除效果越好 -
6、我国学者研发出一种新型水系锌电池,其示意图如图。该电池分别以Zn﹣TCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4和KI混合液为电解质溶液。下列说法错误的是( )
 A、标注框内所示结构中存在共价键和配位键 B、电池总反应为:
A、标注框内所示结构中存在共价键和配位键 B、电池总反应为: +ZnZn2++3I﹣
C、充电时,阴极被还原的Zn2+主要来自Zn﹣TCPP
D、放电时,消耗0.65gZn,理论上转移0.02mol电子
+ZnZn2++3I﹣
C、充电时,阴极被还原的Zn2+主要来自Zn﹣TCPP
D、放电时,消耗0.65gZn,理论上转移0.02mol电子
-
7、某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g)⇌Y(g)(ΔH1<0),Y(g)⇌Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是( )
 A、
A、 B、
B、 C、
C、 D、
D、
-
8、仅用下表提供的试剂和用品,不能实现相应实验目的的是( )
选项
实验目的
试剂
用品
A
比较镁和铝的金属性强弱
MgCl2溶液、AlCl3溶液、氨水
试管、胶头滴管
B
制备乙酸乙酯
乙醇、乙酸、浓硫酸、饱和Na2CO3溶液
试管、橡胶塞、导管、乳胶管、铁架台(带铁夹)、碎瓷片、酒精灯、火柴
C
制备[Cu(NH3)4]SO4溶液
CuSO4溶液、氨水
试管、胶头滴管
D
利用盐类水解制备Fe(OH)3胶体
饱和FeCl3溶液、蒸馏水
烧杯、胶头滴管、石棉网、三脚架、酒精灯、火柴
A、A B、B C、C D、D -
9、某催化剂结构简式如图所示。下列说法错误的是( )
 A、该物质中Ni为+2价 B、基态原子的第一电离能:Cl>P C、该物质中C和P均采取sp2杂化 D、基态Ni原子价电子排布式为3d84s2
A、该物质中Ni为+2价 B、基态原子的第一电离能:Cl>P C、该物质中C和P均采取sp2杂化 D、基态Ni原子价电子排布式为3d84s2 -
10、阅读下列材料,完成问题。
地球上的生物氮循环涉及多种含氮物质,转化关系之一如图所示(X、Y均为氮氧化物),羟胺(NH2OH)以中间产物的形式参与循环。常温常压下,羟胺易潮解,水溶液呈碱性,与盐酸反应的产物盐酸羟胺([NH3OH]Cl)广泛用于药品、香料等的合成。
已知25℃时,Ka(HNO2)=7.2×10﹣4 , Kb(NH3•H2O)=1.8×10﹣5 , Kb(NH2OH)=8.7×10﹣9。
 (1)、NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24LX和Y混合气体中氧原子数为0.1NA B、1L0.1mol•L﹣1NaNO2溶液中Na+和
(1)、NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24LX和Y混合气体中氧原子数为0.1NA B、1L0.1mol•L﹣1NaNO2溶液中Na+和 数均为0.1NA
C、3.3gNH2OH完全转化为
数均为0.1NA
C、3.3gNH2OH完全转化为 时,转移的电子数为0.6NA
D、2.8gN2中含有的价电子总数为0.6NA
(2)、下列有关物质结构或性质的比较中,正确的是( )A、键角:NH3>
时,转移的电子数为0.6NA
D、2.8gN2中含有的价电子总数为0.6NA
(2)、下列有关物质结构或性质的比较中,正确的是( )A、键角:NH3> B、熔点:NH2OH>[NH3OH]Cl
C、25℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D、羟胺分子间氢键的强弱:O—H…O>N—H…N
B、熔点:NH2OH>[NH3OH]Cl
C、25℃同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D、羟胺分子间氢键的强弱:O—H…O>N—H…N
-
11、D﹣乙酰氨基葡萄糖(结构简式如图)是一种天然存在的特殊单糖。下列有关该物质说法正确的是( )
 A、分子式为C6H14O6N B、能发生缩聚反应 C、与葡萄糖互为同系物 D、分子中含有σ键,不含π键
A、分子式为C6H14O6N B、能发生缩聚反应 C、与葡萄糖互为同系物 D、分子中含有σ键,不含π键 -
12、下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是( )

选项
甲
乙
丙
A
Cl2
NaClO
NaCl
B
SO2
H2SO4
CaSO4
C
Fe2O3
Fe(OH)3
FeCl3
D
CO2
H2CO3
Ca(HCO3)2
A、A B、B C、C D、D -
13、青少年帮厨既可培养劳动习惯,也能将化学知识应用于实践。下列有关解释合理的是( )A、清洗铁锅后及时擦干,能减缓铁锅因发生吸氧腐蚀而生锈 B、烹煮食物的后期加入食盐,能避免NaCl长时间受热而分解 C、将白糖熬制成焦糖汁,利用蔗糖高温下充分炭化为食物增色 D、制作面点时加入食用纯碱,利用NaHCO3中和发酵过程产生的酸
-
14、下列各组物质的鉴别方法中,不可行的是( )A、过氧化钠和硫黄:加水,振荡 B、水晶和玻璃:X射线衍射实验 C、氯化钠和氯化钾:焰色试验 D、苯和甲苯:滴加溴水,振荡
-
15、下列资源利用中,在给定工艺条件下转化关系正确的是( )A、煤煤油 B、石油乙烯 C、油脂甘油 D、淀粉乙醇
-
16、特戈拉赞(化合物K)是抑制胃酸分泌的药物,其合成路线如图:

Ⅰ.已知Bn为
 , 咪唑为
, 咪唑为 ;
;Ⅱ.
 和
和 不稳定,能分别快速异构化为
不稳定,能分别快速异构化为 和
和 。
。回答下列问题:
(1)、B中含氧官能团只有醛基,其结构简式为 。(2)、G中含氧官能团的名称为 和 。(3)、J→K的反应类型为 。(4)、D的同分异构体中,与D官能团完全相同,且水解生成丙二酸的有 种(不考虑立体异构)。(5)、E→F转化可能分三步:①E分子内的咪唑环与羧基反应生成X;②X快速异构化为Y;③Y与(CH3CO)2O反应生成F。第③步化学方程式为 。(6)、苯环具有与咪唑环类似的性质。参考E→X的转化,设计化合物I的合成路线如下(部分反应条件己略去)。其中M和N的结构简式为 和 。
-
17、为实现氯资源循环利用,工业上采用RuO2催化氧化法处理HCl废气:
2HCl(g)+O2(g)⇌Cl2(g)+H2O(g)ΔH1=﹣57.2kJ•mol﹣1ㅤΔSㅤK
将HCl和O2分别以不同起始流速通入反应器中,在360℃、400℃和440℃下反应,通过检测流出气成分绘制HCl转化率(α)曲线,如图所示(较低流速下转化率可近似为平衡转化率)。

回答下列问题:
(1)、ΔS 0(填“>”或“<”);T3=℃。(2)、结合以下信息,可知H2的燃烧热ΔH=kJ•moJ﹣1。H2O(l)═H2O(g)ㅤㅤΔH2=+44.0kJ•mol﹣1
H2(g)+Cl2(g)═2HCl(g)ㅤㅤΔH3=﹣184.6kJ•mol﹣1
(3)、下列措施可提高M点HCl转化率的是 ____(填标号)。A、增大HCl的流速 B、将温度升高40℃ C、增大n(HCl):n(O2) D、使用更高效的催化剂(4)、图中较高流速时,a(T3)小于a(T2)和α(T1),原因是 。(5)、设N点的转化率为平衡转化率,则该温度下反应的平衡常数K=(用平衡物质的量分数代替平衡浓度计算)。(6)、负载在TiO2上的RuO2催化活性高,稳定性强。TiO2和RuO2的晶体结构均可用如图表示,二者晶胞体积近似相等,RuO2与TiO2的密度比为1.66,则Ru的相对原子质量为 (精确至1)。
-
18、某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下:
Ⅰ.向50mL烧瓶中分别加入5.7mL乙酸(100mmol)、8.8mL乙醇(150mmol)、1.4gNaHSO4固体及4~6滴1%甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
Ⅱ.加热回流50min后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
Ⅲ.冷却后,向烧瓶中缓慢加入饱和Na2CO3溶液至无CO2逸出,分离出有机相。
Ⅳ.洗涤有机相后,加入无水MgSO4 , 过滤。
Ⅴ.蒸馏滤液,收集73~78℃馏分,得无色液体6.60g,色谱检测纯度为98.0%。
回答下列问题:
(1)、NaHSO4在反应中起 作用,用其代替浓H2SO4的优点是 (答出一条即可)。(2)、甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可 。(3)、使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是 ____(填标号)。A、无需分离 B、增大该反应平衡常数 C、起到沸石作用,防止暴沸 D、不影响甲基紫指示反应进程(4)、下列仪器中,分离有机相和洗涤有机相时均需使用的是 (填名称)。 (5)、该实验乙酸乙酯的产率为 (精确至0.1%)。(6)、若改用C2H518OH作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为 (精确至1)。
(5)、该实验乙酸乙酯的产率为 (精确至0.1%)。(6)、若改用C2H518OH作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为 (精确至1)。
-
19、中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的Au颗粒被FeS2、FeAsS包裹),以提高金的浸出率并冶炼金,工艺流程如图:

回答下列问题:
(1)、北宋时期我国就有多处矿场利用细菌氧化形成的天然“胆水”冶炼铜,“胆水”的主要溶质为 (填化学式)。(2)、“细菌氧化”中,FeS2发生反应的离子方程式为 。(3)、“沉铁砷”时需加碱调节pH,生成 (填化学式)胶体起絮凝作用,促进了含As微粒的沉降。(4)、“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为 ____(填标号)。A、无需控温 B、可减少有害气体产生 C、设备无需耐高温 D、不产生废液废渣(5)、“真金不怕火炼”表明Au难被O2氧化,“浸金”中NaCN的作用为 。(6)、“沉金”中Zn的作用为 。(7)、滤液②经H2SO4酸化,[Zn(CN)4]2﹣转化为ZnSO4和HCN的化学方程式为 。用碱中和HCN可生成 (填溶质化学式)溶液,从而实现循环利用。 -
20、25℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl﹣水样、含Br﹣水样。
已知:①Ag2CrO4为砖红色沉淀;
②相同条件下AgCl溶解度大于AgBr;
③25℃时,pKa1(H2CrO4)=0.7,pKa2(H2CrO4)=6.5。

下列说法错误的是( )
A、曲线②为AgCl沉淀溶解平衡曲线 B、反应Ag2CrO4+H+⇌2Ag++ 的平衡常数K=10﹣5.2
C、滴定Cl﹣时,理论上混合液中指示剂浓度不宜超过10﹣2.0mol•L﹣1
D、滴定Br﹣达终点时,溶液中
的平衡常数K=10﹣5.2
C、滴定Cl﹣时,理论上混合液中指示剂浓度不宜超过10﹣2.0mol•L﹣1
D、滴定Br﹣达终点时,溶液中