相关试卷
-
1、某锂离子电池电极材料结构如图。结构1是钴硫化物晶胞的一部分,可代表其组成和结构;晶胞2是充电后的晶胞结构;所有晶胞均为立方晶胞。下列说法错误的是( )
 A、结构1钴硫化物的化学式为Co9S8 B、晶胞2中S与S的最短距离为a C、晶胞2中距Li最近的S有4个 D、晶胞2和晶胞3表示同一晶体
A、结构1钴硫化物的化学式为Co9S8 B、晶胞2中S与S的最短距离为a C、晶胞2中距Li最近的S有4个 D、晶胞2和晶胞3表示同一晶体 -
2、某工厂利用铜屑脱除锌浸出液中的Cl﹣并制备Zn,流程如下。“脱氯”步骤仅Cu元素化合价发生改变。下列说法正确的是( )

锌浸出液中相关成分(其他成分无干扰)
离子
Zn2+
Cu2+
Cl﹣
浓度(g•L﹣1)
145
0.03
1
A、“浸铜”时应加入足量H2O2 , 确保铜屑溶解完全 B、“浸铜”反应:2Cu+4H++H2O2═2Cu2++H2↑+2H2O C、“脱氯”反应:Cu+Cu2++2Cl﹣═2CuCl D、脱氯液净化后电解,可在阳极得到Zn -
3、“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为:
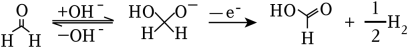 。下列说法错误的是( )
。下列说法错误的是( )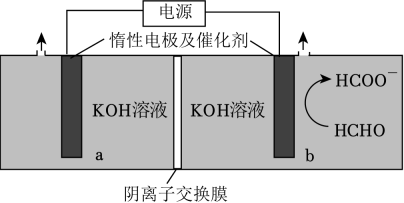 A、相同电量下H2理论产量是传统电解水的1.5倍 B、阴极反应:2H2O+2e﹣═2OH﹣+H2↑ C、电解时OH﹣通过阴离子交换膜向b极方向移动 D、阳极反应:2HCHO﹣2e﹣+4OH﹣═2HCOO﹣+2H2O+H2↑
A、相同电量下H2理论产量是传统电解水的1.5倍 B、阴极反应:2H2O+2e﹣═2OH﹣+H2↑ C、电解时OH﹣通过阴离子交换膜向b极方向移动 D、阳极反应:2HCHO﹣2e﹣+4OH﹣═2HCOO﹣+2H2O+H2↑ -
4、如下反应相关元素中,W、X、Y、Z为原子序数依次增大的短周期元素,基态X原子的核外电子有5种空间运动状态,基态Y、Z原子有两个未成对电子,Q是ds区元素,焰色试验呈绿色。下列说法错误的是( )
QZY4溶液
 QZX4Y4W12溶液A、单质沸点:Z>Y>W B、简单氢化物键角:X>Y C、反应过程中有蓝色沉淀产生 D、QZX4Y4W12是配合物,配位原子是Y
QZX4Y4W12溶液A、单质沸点:Z>Y>W B、简单氢化物键角:X>Y C、反应过程中有蓝色沉淀产生 D、QZX4Y4W12是配合物,配位原子是Y -
5、异山梨醇是一种由生物质制备的高附加值化学品;150℃时其制备过程及相关物质浓度随时间变化如图所示,15h后异山梨醇浓度不再变化。下列说法错误的是( )
 A、3h时,反应②正、逆反应速率相等 B、该温度下的平衡常数:①>② C、0~3h平均速率v(异山梨醇)=0.014mol•kg﹣1•h﹣1 D、反应②加入催化剂不改变其平衡转化率
A、3h时,反应②正、逆反应速率相等 B、该温度下的平衡常数:①>② C、0~3h平均速率v(异山梨醇)=0.014mol•kg﹣1•h﹣1 D、反应②加入催化剂不改变其平衡转化率 -
6、环六糊精(D﹣吡喃葡萄糖缩合物)具有空腔结构,腔内极性较小,腔外极性较大,可包合某些分子形成超分子。图1、图2和图3分别表示环六糊精结构、超分子示意图及相关应用。下列说法错误的是( )
 A、环六糊精属于寡糖 B、非极性分子均可被环六糊精包合形成超分子 C、图2中甲氧基对位暴露在反应环境中 D、可用萃取法分离环六糊精和氯代苯甲醚
A、环六糊精属于寡糖 B、非极性分子均可被环六糊精包合形成超分子 C、图2中甲氧基对位暴露在反应环境中 D、可用萃取法分离环六糊精和氯代苯甲醚 -
7、下列实验方法或试剂使用合理的是( )
选项
实验目的
实验方法或试剂
A
检验NaBr溶液中是否含有Fe2+
K3[Fe(CN)6]溶液
B
测定KHS溶液中c(S2﹣)
用AgNO3溶液滴定
C
除去乙醇中少量的水
加入金属Na,过滤
D
测定KClO溶液的pH
使用pH试纸
A、A B、B C、C D、D -
8、如图所示的自催化反应,Y作催化剂。下列说法正确的是( )
 A、X不能发生水解反应 B、Y与盐酸反应的产物不溶于水 C、Z中碳原子均采用sp2杂化 D、随c(Y)增大,该反应速率不断增大
A、X不能发生水解反应 B、Y与盐酸反应的产物不溶于水 C、Z中碳原子均采用sp2杂化 D、随c(Y)增大,该反应速率不断增大 -
9、H2O2分解的“碘钟”反应美轮美奂。将一定浓度的三种溶液(①H2O2溶液;②淀粉、丙二酸和MnSO4混合溶液;③KIO3、稀硫酸混合溶液)混合,溶液颜色在无色和蓝色之间来回振荡,周期性变色;几分钟后,稳定为蓝色。下列说法错误的是( )A、无色→蓝色:生成I2 B、蓝色→无色:I2转化为化合态 C、H2O2起漂白作用 D、淀粉作指示剂
-
10、家务劳动中蕴含着丰富的化学知识。下列相关解释错误的是( )A、用过氧碳酸钠漂白衣物:Na2CO4具有较强氧化性 B、酿米酒需晾凉米饭后加酒曲:乙醇受热易挥发 C、用柠檬酸去除水垢:柠檬酸酸性强于碳酸 D、用碱液清洗厨房油污:油脂可碱性水解
-
11、硫及其化合物部分转化关系如图。设NA为阿伏加德罗常数的值,下列说法正确的是( )
 A、标准状况下,11.2LSO2中原子总数为0.5NA B、100mL0.1mol•L﹣1Na2SO3溶液中,数目为0.01NA C、反应①每消耗3.4gH2S,生成物中硫原子数目为0.1NA D、反应②每生成1mol还原产物,转移电子数目为2NA
A、标准状况下,11.2LSO2中原子总数为0.5NA B、100mL0.1mol•L﹣1Na2SO3溶液中,数目为0.01NA C、反应①每消耗3.4gH2S,生成物中硫原子数目为0.1NA D、反应②每生成1mol还原产物,转移电子数目为2NA -
12、下列实验操作或处理方法错误的是( )A、点燃H2前,先检验其纯度 B、金属K着火,用湿抹布盖灭 C、温度计中水银洒落地面,用硫粉处理 D、苯酚沾到皮肤上,先后用乙醇、水冲洗
-
13、下列化学用语或表述正确的是( )A、中子数为1的氦核素:He B、SiO2的晶体类型:分子晶体 C、F2的共价键类型:p﹣pσ键 D、PCl3的空间结构:平面三角形
-
14、文物见证历史,化学创造文明。东北三省出土的下列文物据其主要成分不能与其他三项归为一类的是( )A、金代六曲葵花盛金银盆 B、北燕鸭形玻璃注 C、汉代白玉耳杯 D、新石器时代彩绘几何纹双腹陶罐
-
15、有机物I的合成路线如图所示,
 (1)、有机物F的名称为。I中含氧官能团的名称为 , 条件1可能为。(2)、B→C的反应过程包含两个反应,反应类型分别为 , G的结构简式为。观察I的分子结构,判断是否存在顺反异构体?(填“是”或“否”)。(3)、下面关于有机物E的描述正确的是(填序号)。
(1)、有机物F的名称为。I中含氧官能团的名称为 , 条件1可能为。(2)、B→C的反应过程包含两个反应,反应类型分别为 , G的结构简式为。观察I的分子结构,判断是否存在顺反异构体?(填“是”或“否”)。(3)、下面关于有机物E的描述正确的是(填序号)。A.能使酸性高锰酸钾褪色
B.属于酯类,且可与银氨溶液反应
C.1mol E最多可以与5mol 发生加成反应
(4)、写出C与新制的悬浊液反应的化学方程式:。(5)、满足下列条件的B的同分异构体有种。①结构中含有苯环
②可与反应生成气体
③苯环上有三个取代基
-
16、催化重整的反应:Ⅰ.
主要副反应:
Ⅱ.
Ⅲ.
在恒容反应器中按体积分数充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图1所示。

图13=
回答下列问题:
(1)、(用含、的代数式表达),0(填“>”“=”或“<”)。(2)、300~580℃时,的体积分数不断增大,是由于。(3)、氯钯酸钙()固体加热时部分分解为、Pd、 , 500K时平衡常数。500K温度下,在一硬质玻璃烧瓶中加入过量 , 抽真空后,用针管向玻璃烧瓶通入溴蒸气。溴蒸气初始压强为20.0kPa,500K平衡时,测得烧瓶中压强为30.2kPa,则Pa,反应2的平衡常数。(4)、利用重整废气中的、CO联合制取烧碱、氯代烃和甲醇的流程如图2。已知B中的装置使用了阳离子交换膜。
图2
①B中发生的总反应的离子方程式为。
②若某废气中含有的和CO的体积比为1∶1,废气中和CO的体积分数共为8.96%。假设A中处理了标准状况下10的废气,其中和CO全部转化成 , 理论上可制得kg。
-
17、钾长石()是一种火成岩矿物,常见于火山岩和花岗岩中。可用于制作瓷砖、墙壁等,钾长石还可以用于制造化肥。以钾长石为原料制取钾肥()的一种工艺流程如图1所示。

图1
已知:钾长石中的钾元素和铝元素在作用下转化为和
回答下列问题:
(1)、钾长石用氧化物表示的化学式为;浸渣1的主要成分为。(2)、钾离子的基态电子排布式为 , 流程中可循环利用的物质有、。(填俗名)(3)、写出调pH生成浸渣2的离子方程式为。(4)、碱化步骤中加入NaOH的目的是。(5)、的晶胞结构如图2所示,晶胞参数a=x nm,晶胞中氧原子的配位数为 , 列式计算晶体的密度为。
图2
-
18、Ⅰ.图1为常见的气体发生装置,回答下列问题:

图1
(1)、装置A中发生反应的化学方程式为 , a管的作用是。(2)、用漂白粉与浓盐酸制取少量氯气,离子方程式为 , 选用装置。(3)、Ⅱ.某同学设计实验探究NO和Cu反应的氧化产物,装置如图2所示(部分夹持装置未画出)。
图2
装置B中试剂为 , 装置E的作用是。(4)、若D中产物为CuO和的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL(标准状况下)NO气体,则混合物中CuO和的物质的量之比为。 -
19、已知甲酸的分解反应为 △H。在催化作用下反应历程为

根据过渡态理论,其反应过程中的能量变化如图所示(、、均大于0):

下列说法正确的是( )
A、该反应为放热反应, B、反应过程中有碳氧键的断裂与生成 C、 的变化过程为放热过程
D、使用催化剂后,正、逆反应速率不同程度改变,平衡发生移动
的变化过程为放热过程
D、使用催化剂后,正、逆反应速率不同程度改变,平衡发生移动
-
20、硫酸钡在水中的沉淀溶解平衡: △H , 在不同温度()时,曲线如图所示。下列说法正确的是( )
 A、△H<0 B、温度下 C、加入固体,可使溶液从a点变成c点 D、a点和b点的相等
A、△H<0 B、温度下 C、加入固体,可使溶液从a点变成c点 D、a点和b点的相等