相关试卷
-
1、NH3是一种重要的化工原料,在生产、生活中用途广泛。(1)、一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2+3H22NH3 , 测得各组分浓度随时间变化如图所示。

①表示c(N2)的曲线是(填“曲线A”、“曲线B”或“曲线C”)。
② 0~t0时用H2表示的反应速率:v(H2)=mol·L-1·min-1。
③ 下列能说明该反应达到平衡的是。
a.混合气体的压强不再变化 b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化 d.NH3的体积分数不再变化
(2)、潜艇中使用的液氨-液氧燃料电池工作原理如图所示:
① 电极b名称是。
② 电解质溶液中OH-离子向移动(填“电极a”或“电极b”)。
③电极a的电极反应式为。
-
2、烯烃复分解反应实现了在一定条件下烯烃中碳碳双键两边基团的换位。如:
现仅以丙烯为有机原料,经过下列反应合成某些有机物:

已知:
(1)、反应①的方程式为 , 反应类型为。(2)、C中官能团的名称。(3)、写出下列编号的化学方程式:⑥⑦ (H是足量的)
(4)、已知:Diels-Alder反应为共轭双烯与含烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的Diels-Alder反应是
 。若利用Diels-Alder反应合成
。若利用Diels-Alder反应合成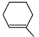 , 所用的起始原料的结构简式:。
, 所用的起始原料的结构简式:。 -
3、乙酸乙酯(熔点:℃,沸点:77.2℃)广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)
 (1)、制备粗品(图1)
(1)、制备粗品(图1)在试管A中加入少量碎瓷片,将三种原料依次加入试管A中,用酒精灯缓慢加热,
一段时间后在试管B中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是 , 试管A中发生反应的化学方程式是。
②试管B中盛装的液体是 , 其作用是。
③若用b装置制备乙酸乙酯与a装置比,其缺点有。(写一条即可)
(2)、制备精品(图2)①将B中的混合液体先用方法(填操作名称)进行分离,得到乙酸乙酯的粗产品。然后在对乙酸乙酯粗品进行系列除杂操作后转移到C中,利用图2装置进一步操作即得到乙酸乙酯精品。
②实验过程中,冷却水从口进入(填字母);收集产品时,控制的温度应在℃左右。
③若实验所用乙酸的质量为6.0 g,乙醇的质量为5.0 g,得到纯净的产品质量为5.3 g,则乙酸乙酯的产率是。(产率指的是某种生成物的实际产量与理论产量的比值)
-
4、要求完成下列各题:(1)、同温同压下蒸气的密度是H2的43倍的烷烃的分子式为 , 其中一氯代物只有2种的结构简式为。(2)、碳原子数小于10的烷烃中一氯代物只有一种结构的物质有种,其中含有碳原子个数最少的物质的电子式为。(3)、分子中含有26个电子的烷烃的二氯代物有种,其不含甲基的结构简式为。(4)、聚合物:
 的单体是(填结构简式)
的单体是(填结构简式) -
5、金属的冶炼一般有下列方法:a.焦炭法 b.水煤气(氢气和一氧化碳)法
c.活泼金属置换法 d.电解法,请从上述四种方法中选择相应的字母填入表中空格:
高炉炼铁
湿法炼铜
铝热法炼铬
工业上冶炼铝
写出Al与Cr2O3反应的化学方程式:
-
6、将下列物质进行分类(填序号):
①O2与O3;②C与C;③CH2=CH2和CH3-CH=CH2;④冰与干冰;
⑤H2、D2、T2;⑥乙醇与甲醚(CH3-O-CH3);⑦CH3CH2CH2CH2CH3和CH3(CH2)3CH3
(1)、互为同系物的是;(2)、互为同素异形体的是;(3)、互为同分异构体的是(4)、属于同种物质的是。如何判断同分异构体。 -
7、概念辨析(判断对错,正确的横线处不填,错误的说明原因)(1)、乙烯能使溴水和酸性高锰酸钾溶液褪色,发生的反应类型相同、。(2)、乙醇中混有的少量水可用金属钠进行检验、。(3)、1 mol C2H5OH和1 mol CH3COOH在浓硫酸作用下加热可以完全反应生成1 mol CH3COOC2H5、。(4)、淀粉、油脂、蛋白质都属于高分子化合物、。
-
8、向绝热恒容密闭容器中通入SO2和NO2 , 使反应:SO2(g)+NO2(g) ⇌ SO3(g)+NO(g)在一定条件下达到平衡,正反应速率随时间变化的曲线如图所示。由图可得出的正确结论是( )
 A、反应在c点达到平衡状态 B、反应物浓度:a点小于b点 C、△t1=△t2时,SO2的转化率:a~b段大于b~c段 D、反应物的总能量高于生成物的总能量
A、反应在c点达到平衡状态 B、反应物浓度:a点小于b点 C、△t1=△t2时,SO2的转化率:a~b段大于b~c段 D、反应物的总能量高于生成物的总能量 -
9、有机物M的结构简式为
 , 下列有关M性质的叙述中错误的是( ) A、M与金属钠完全反应时,二者物质的量之比为1∶2 B、M与碳酸氢钠完全反应时,二者物质的量之比为1∶1 C、M与氢氧化钠完全反应时,二者物质的量之比为1∶2 D、M既能与乙酸反应,又能与乙醇反应
, 下列有关M性质的叙述中错误的是( ) A、M与金属钠完全反应时,二者物质的量之比为1∶2 B、M与碳酸氢钠完全反应时,二者物质的量之比为1∶1 C、M与氢氧化钠完全反应时,二者物质的量之比为1∶2 D、M既能与乙酸反应,又能与乙醇反应 -
10、下列物质发生一氯取代反应后,生成两种沸点不同的有机产物的是( )A、
 B、
B、 C、
D、
C、
D、
-
11、实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验,光照下反应一段时间后,下列说法正确的是( )
 A、反应后的混合气体能使湿润的石蕊试纸变红说明
A、反应后的混合气体能使湿润的石蕊试纸变红说明生成的一氯甲烷具有酸性
B、甲烷和氯气在光照条件下反应,只能生成四种含氯的化合物 C、产物之一氯仿在常温下为液态 D、CH4和Cl2完全反应后液面上升,液体可能会充满试管 -
12、下列关于材料的说法错误的是( )A、塑料的主要成分是合成树脂 B、硫化橡胶具有很好的强度和化学稳定性 C、再生纤维与合成纤维均属于化学纤维 D、塑料、橡胶和纤维都是天然有机高分子材料
-
13、下列有关四个常用电化学装置的叙述中,正确的是( )




图Ⅰ碱性锌锰电池
图Ⅱ铅蓄电池
图Ⅲ
图Ⅳ氢氧燃料电池
A、图Ⅰ所示电池中,MnO2是正极,电极反应式是 B、图Ⅱ所示电池放电过程中,当外电路通过1 mol电子时,理论上负极板的质量增加96 g C、图Ⅲ所示装置没有形成原电池 D、图Ⅳ所示电池中,不管KOH溶液换成H2SO4溶液还是Na2SO4溶液,电池总反应式不变 -
14、下列关于有机物的叙述正确的是( )A、鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液 B、向淀粉溶液中加少量稀硫酸,加热,使淀粉水解后,将溶液分成两份,分别加入碘水和银氨溶液(并水浴加热),可测定其水解程度 C、欲证明中含有碳碳双键,滴入酸性溶液,看紫红色是否褪去 D、除去丙烷中少量的丙烯,可用酸性高锰酸钾溶液洗气
-
15、下列关于乙烯和聚乙烯的说法中,正确的是( )A、二者都能使溴水褪色,性质相似 B、二者互为同系物 C、二者的碳氢原子个数比相同 D、二者的分子组成相同
-
16、糖类、油脂、蛋白质是重要的营养物质,下列说法正确的是( )A、糖类、油脂、蛋白质均可水解 B、油脂属于酯类物质可发生皂化反应 C、纤维素和淀粉互为同分异构体 D、NH4Cl溶液和CuSO4溶液均可使蛋白质变性
-
17、下列过程中发生了加成反应的是( )A、C2H4使酸性高锰酸钾溶液褪色 B、C2H4使溴的CCl4溶液褪色 C、C2H4燃烧生成二氧化碳和水 D、CH4和Cl2的混合气体在光照条件下逐渐褪色
-
18、下列有关金属的工业制法中,正确的是( )A、制铁:以铁矿石为原料,CO还原得铁 B、制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 C、制镁:用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁 D、制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝
-
19、下列说法中正确的是( )A、甲烷的分子式是CH4 , 其二氯取代的产物有两种 B、所有的烷烃都是同系物 C、符合分子通式CnH2n+2的烃都是烷烃,分子中均只含单键 D、烷烃分子中,相邻的三个碳原子可能在同一条直线上
-
20、下列物质的类别与所含官能团都正确的是( )A、
 酚类-OH
B、
酚类-OH
B、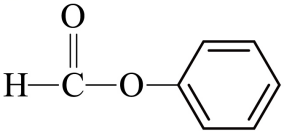 醛类-CHO
C、
醛类-CHO
C、 羧酸-COOH
D、CH3OCH3醚类
羧酸-COOH
D、CH3OCH3醚类 