相关试卷
-
1、贵金属银应用广泛.Ag与稀制得 , 常用于循环处理高氯废水.(1)、沉淀 . 在高氯水样中加入使浓度约为 , 当滴加溶液至开始产生沉淀(忽略滴加过程的体积增加),此时溶液中浓度约为 . [已知: , ](2)、还原AgCl.在AgCl沉淀中埋入铁圈并压实,加入足量盐酸后静置,充分反应得到Ag.
①铁将AgCl转化为单质Ag的化学方程式为 .
②不与铁圈直接接触的AgCl也能转化为Ag的原因是 .
③为判断AgCl是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤,[实验中必须使用的试剂和设备:稀、溶液,通风设备]
(3)、Ag的抗菌性能.纳米Ag表面能产生杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响.①纳米Ag溶解产生的离子方程式为 .

②实验表明溶解氧浓度过高,纳米Ag的抗菌性能下降,主要原因是 .
-
2、F是合成含松柏基化合物的中间体,其合成路线如下:


 (1)、A分子中的含氧官能团名称为醚键和 .(2)、中有副产物生成,该副产物的结构简式为 .(3)、的反应类型为;C转化为D时还生成和(填结构简式).(4)、写出同时满足下列条件的F的一种芳香族同分异构体的结构简式: . 碱性条件下水解后酸化,生成X、Y和Z三种有机产物.X分子中含有一个手性碳原子;Y和Z分子中均有2种不同化学环境的氢原子,Y能与溶液发生显色反应,Z不能被银氨溶液氧化.(5)、已知:与性质相似.写出以
(1)、A分子中的含氧官能团名称为醚键和 .(2)、中有副产物生成,该副产物的结构简式为 .(3)、的反应类型为;C转化为D时还生成和(填结构简式).(4)、写出同时满足下列条件的F的一种芳香族同分异构体的结构简式: . 碱性条件下水解后酸化,生成X、Y和Z三种有机产物.X分子中含有一个手性碳原子;Y和Z分子中均有2种不同化学环境的氢原子,Y能与溶液发生显色反应,Z不能被银氨溶液氧化.(5)、已知:与性质相似.写出以 、
、 、和为原料制备
、和为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干) -
3、回收磁性合金钕铁硼()可制备半导体材料铁酸铋和光学材料氧化钕.(1)、钕铁硼在空气中焙烧转化为、等(忽略硼的化合物),用盐酸酸浸后过滤得到溶液和含铁滤渣.Nd、Fe浸出率()随浸取时间变化如图所示.

①含铁滤渣的主要成分为(填化学式).
②浸出初期Fe浸出率先上升后下降的原因是 .
(2)、含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋.①用含有机胺()的有机溶剂作为萃取剂提纯一定浓度的溶液,原理为:
(有机层)
已知:
其他条件不变,水层初始pH在0.2~0.8范围内,随水层pH增大,有机层中Fe元素含量迅速增多的原因是 .
②反萃取后,经转化可得到铁酸铋.铁酸铋晶胞如图所示(图中有4个Fe原子位于晶胞体对角线上,O原子未画出),其中原子数目比
 (3)、净化后的溶液通过沉钕、焙烧得到 .
(3)、净化后的溶液通过沉钕、焙烧得到 .①向溶液中加入溶液,可转化为沉淀.该反应的离子方程式为 .
②将(摩尔质量为)在氮气氛围中焙烧,剩余固体质量随温度变化曲线如图所示.时,所得固体产物可表示为 , 通过以上实验数据确定该产物中的比值 .

-
4、二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管.装置及、、…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示.下列说法正确的是( )

(容器内与外界没有热量交换)
 A、处与处反应①的平衡常数K相等 B、反应②的焓变 C、处的的体积分数大于处 D、混合气从起始到通过处,CO的生成速率小于的生成速率
A、处与处反应①的平衡常数K相等 B、反应②的焓变 C、处的的体积分数大于处 D、混合气从起始到通过处,CO的生成速率小于的生成速率 -
5、室温下,通过下列实验探究的性质.已知 , .
实验1:将气体通入水中,测得溶液 .
实验2:将气体通入溶液中,当溶液时停止通气.
实验3:将气体通入酸性溶液中,当溶液恰好褪色时停止通气.
下列说法正确的是( )
A、实验1所得溶液中: B、实验2所得溶液中: C、实验2所得溶液经蒸干、灼烧制得固体 D、实验3所得溶液中: -
6、室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项
实验过程及现象
实验结论
A
用溶液分别中和等体积的溶液和溶液,消耗的溶液多
酸性:
B
向溶液中滴加几滴溴水,振荡,产生淡黄色沉淀
氧化性:
C
向浓度均为的和混合溶液中滴加少量溶液,振荡,产生白色沉淀
溶度积常数:
D
用pH试纸分别测定溶液和溶液pH,溶液pH大
结合能力:
A、A B、B C、C D、D -
7、在给定条件下,下列制备过程涉及的物质转化均可实现的是( )A、制备:溶液和 B、金属Mg制备:溶液 C、纯碱工业:溶液 D、硫酸工业:
-
8、化合物Z是一种药物的重要中间体,部分合成路线如下:

下列说法正确的是( )
A、X分子中所有碳原子共平面 B、最多能与发生加成反应 C、Z不能与的溶液反应 D、Y、Z均能使酸性溶液褪色 -
9、碱性锌锰电池的总反应为 , 电池构造示意图如图所示.下列有关说法正确的是( )
 A、电池工作时,发生氧化反应 B、电池工作时,通过隔膜向正极移动 C、环境温度过低,不利于电池放电 D、反应中每生成 , 转移电子数为
A、电池工作时,发生氧化反应 B、电池工作时,通过隔膜向正极移动 C、环境温度过低,不利于电池放电 D、反应中每生成 , 转移电子数为 -
10、阅读下列材料,完成问题:
倠化剂能改变化学反应速率而不改变反应的焓变,常见倠化剂有金属及其氧化物、酸和碱等.倠化反应广泛存在,如豆科植物固氮、石墨制金刚石、和制(二甲醚)、倠化氧化等.催化剂有选择性,如与反应用Ag催化生成
 (环氧乙烷)、用催化生成 . 催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞.我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向.(1)、下列说法正确的是( )A、豆科植物固氮过程中,固氮酶能提高该反应的活化能 B、与反应中,Ag催化能提高生成的选择性 C、制反应中,能加快化学反应速率 D、与反应中,能减小该反应的焓变(2)、下列化学反应表示正确的是( )A、汽车尾气处理: B、电催化为的阳极反应: C、硝酸工业中的氧化反应: D、和催化制二甲醚:(3)、下列有关反应描述正确的是( )A、催化氧化为 , 断裂键 B、氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变分解的历程 C、丁烷催化裂化为乙烷和乙烯,丁烷断裂键和键 D、石墨转化为金刚石,碳原子轨道的杂化类型由转变为
(环氧乙烷)、用催化生成 . 催化作用能消除污染和影响环境,如汽车尾气处理、废水中电倠化生成、氯自由基催化分解形成臭氧空洞.我国在石油催化领域领先世界,高效、经济、绿色是未来催化剂研究的发展方向.(1)、下列说法正确的是( )A、豆科植物固氮过程中,固氮酶能提高该反应的活化能 B、与反应中,Ag催化能提高生成的选择性 C、制反应中,能加快化学反应速率 D、与反应中,能减小该反应的焓变(2)、下列化学反应表示正确的是( )A、汽车尾气处理: B、电催化为的阳极反应: C、硝酸工业中的氧化反应: D、和催化制二甲醚:(3)、下列有关反应描述正确的是( )A、催化氧化为 , 断裂键 B、氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变分解的历程 C、丁烷催化裂化为乙烷和乙烯,丁烷断裂键和键 D、石墨转化为金刚石,碳原子轨道的杂化类型由转变为 -
11、明矾可用作净水剂.下列说法正确的是( )A、半径: B、电负性: C、沸点: D、碱性:
-
12、实验室进行铁钉镀锌实验.下列相关原理、装置及操作不正确的是( )



 A、配制溶液 B、铁钉除油污 C、铁钉除锈 D、铁钉镀锌
A、配制溶液 B、铁钉除油污 C、铁钉除锈 D、铁钉镀锌 -
13、反应可用于壁画修复.下列说法正确的是( )A、的结构示意图为
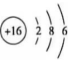 B、中既含离子键又含共价键
C、中元素的化合价为
D、的空间构型为直线形
B、中既含离子键又含共价键
C、中元素的化合价为
D、的空间构型为直线形
-
14、我国探月工程取得重大进展.月壤中含有Ca、Fe等元素的磷酸盐,下列元素位于元素周期表第二周期的是( )A、O B、P C、Ca D、Fe
-
15、将煤干馏可以得到焦炭等化工产品,用焦炭生产水煤气的反应为:
(反应吸热)
将不同量的和分别加入到体积为的恒容密闭容器中,进行反应,得到如下数据:
实验组
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
C
CO
1
650
0.01
0.02
0.008
5
2
800
0.02
0.03
0.017
3
(1)、实验1中,从反应起始至平衡时的平均反应速率;(2)、分析表中数据,解释实验2比实验1更快达到平衡的原因。(3)、一定温度下,下列事实能判断该反应达到平衡状态的是____。(双选)A、容器中的压强不再改变 B、 C、(4)、焦炭可用于制备电石等。电石的主要成分是 , 其与水反应生成和(用结构简式表示)。(5)、制备电石还需要用到。组成的三种元素原子半径按从大到小的顺序排列为____。A、 B、 C、 D、(6)、合成氨的原料气和通常是以焦炭、水和空气为原料来制取的。其主要反应是:①
②
③
某次生产中将焦炭、和空气(设空气中和的体积比为4:1)混合反应,所得气体产物经分析,组成如下表:
气体 CO
体积()(标准状况)
20
12
60
1.0
通入空气的体积(空气) , 参加反应的的体积。
(7)、上表中。 -
16、淀粉在一定条件下的转化关系如下图:
 (1)、淀粉的化学式为____;A、 B、 C、(2)、淀粉属于____。(双选)A、糖类 B、油脂 C、高分子化合物(3)、上述转化中的产物是乙烯,工业上大量的乙烯主要来源于____;A、煤 B、石油 C、天然气(4)、乙烯在一定条件下可以合成聚合物C,写出C的结构简式。(5)、写出反应②的化学方程式,并指出反应类型。 , 反应类型;(6)、反应①和反应②中,浓硫酸具有的相同作用是。(7)、葡萄糖试纸是一种常用的人体血糖检测工具。
(1)、淀粉的化学式为____;A、 B、 C、(2)、淀粉属于____。(双选)A、糖类 B、油脂 C、高分子化合物(3)、上述转化中的产物是乙烯,工业上大量的乙烯主要来源于____;A、煤 B、石油 C、天然气(4)、乙烯在一定条件下可以合成聚合物C,写出C的结构简式。(5)、写出反应②的化学方程式,并指出反应类型。 , 反应类型;(6)、反应①和反应②中,浓硫酸具有的相同作用是。(7)、葡萄糖试纸是一种常用的人体血糖检测工具。将2%的葡萄糖溶液滴到一张葡萄糖检测试纸(浅蓝色)上,将多余的溶液擦去,静置30~60s,观察到纸条颜色变为____。
A、无色 B、黄色 C、棕红色(8)、烯烃复分解反应可以理解为原烯烃双键断裂,重新组合生成链状或环状烯烃。例如:
请根据烯烃复分解反应的原理完成下列化学方程式:
-
17、海水中含有丰富的卤素资源,其单质及其化合物的用途广泛。(1)、画出氯的原子结构示意图。(2)、氯元素在海水中大量存在,从海水中得到粗盐的方法是。(3)、图a、b、c分别为氯化钠在不同状态下的导电实验的微观示意图(X、Y均表示石墨电极,且与直流电源连接方式相同,“
 ”表示水分子),下列说法正确的是____;
”表示水分子),下列说法正确的是____; A、“
A、“ ”代表 , “
”代表 , “ ”代表
B、X连接电源的负极
C、在三种状态下都存在自由移动的离子
D、图c表示水溶液中的微粒迁移
(4)、工业上通过电解饱和食盐水得到氯气等产品,该电解反应阳极的产物为____。A、 B、 C、(5)、铁丝在氯气中燃烧生成 , 写出反应的化学方程式。
”代表
B、X连接电源的负极
C、在三种状态下都存在自由移动的离子
D、图c表示水溶液中的微粒迁移
(4)、工业上通过电解饱和食盐水得到氯气等产品,该电解反应阳极的产物为____。A、 B、 C、(5)、铁丝在氯气中燃烧生成 , 写出反应的化学方程式。将饱和的溶液滴入沸水中,形成氢氧化铁胶体,观察到的实验现象是;
氢氧化铁胶体粒子的直径大小为。
A.小于 B. C.大于
(6)、碘元素在元素周期表中的位置是;为防人体缺碘,食盐中常添加 , 写出中存在的化学键类型。(7)、酸性条件下,向溶液中加入 , 发生如下反应,标出电子转移的方向和数目。反应结束,向反应液中加入淀粉溶液,可观察到的现象是。
(8)、海水有弱碱性。海水提溴的方法:在苦卤中加入硫酸、再通入氯气,得到含溴的苦卤,再通过一系列操作得到粗溴。
写出通入氯气发生反应的离子方程式。若不加硫酸直接向苦卤中通入氯气,会使氯气的使用量。
A.增大 B.减小
(9)、工业上,通过如下转化可制得晶体:溶液溶液晶体
不考虑副反应的发生,步骤I中会释放出一种单质气体,该气体的化学式是;步骤II为向溶液中加入固体 , 发生复分解反应得到晶体。请该复分解反应能够发生的原因。
-
18、利用分类法研究化学物质可系统、全面认识物质的性质。下列三组物质中,均有一种物质的类别与其他三种不同。
①、、、
②、、、
③、、、
(1)、三种物质依次是:①;②;③。
(2)、这三种物质相互作用可生成一种新物质 , 该反应____氧化还原反应。A、是 B、不是(3)、某实验小组通过以下实验来探究和两种物质的性质。实验一:称取两种固体各 , 分别放入两个小烧杯中,再各滴加蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加2滴酚酞试液。
实验发现固体完全溶解,而固体有剩余,由此可知,相同温度下,溶解度大小:____。
A、> B、<(4)、盛放溶液的烧杯中,滴入酚酞后溶液呈色。(5)、实验二:和两种物质的“套管实验”的实验装置如下图所示。
整个实验过程中,能观察到烧杯B中的现象是;试管中发生反应的化学方程式为。由此可知,热稳定性:。
A.> B.<
(6)、证明热稳定性的实验装置中,能否将、的位置互换?说明理由。(7)、下列实验方案中,不能鉴别和两种白色固体的是____。A、将和配制成浓度均为的溶液,测定并做比较 B、分别加热相同质量的两种固体样品,比较加热前后的固体质量变化 C、分别将这两种物质的溶液与过量的溶液混合(8)、配制一定物质的量浓度的溶液的过程如下图所示。下列说法错误的是____。 A、所配制的溶液中, B、操作2中玻璃棒的下端应该抵在容量瓶的刻度线下方 C、操作4导致所配得溶液浓度偏高 D、操作5中,定容摇匀后发现液面低于刻度线,不再需要加水
A、所配制的溶液中, B、操作2中玻璃棒的下端应该抵在容量瓶的刻度线下方 C、操作4导致所配得溶液浓度偏高 D、操作5中,定容摇匀后发现液面低于刻度线,不再需要加水 -
19、干冰可用于人工增雨作业。(1)、从物质分类角度看,二氧化碳属于____。(双选)A、共价化合物 B、离子化合物 C、酸性氧化物 D、碱性氧化物(2)、写出分子的结构式。(3)、干冰气化过程属于____变化,A、物理 B、化学(4)、该过程____热量,A、吸收 B、放出(5)、气化过程中,微粒间的距离____。A、变大 B、变小(6)、解释干冰可用于人工降雨的原因。(7)、碳元素有三种核素:、、。中的“13”是指。(8)、C和Si是同主族元素,下列事实能说明两者非金属性相对强弱的是____。A、沸点: B、相对原子质量: C、酸性:(9)、甲烷化反应的原理:(正反应为放热反应)。上述反应中,反应物总能量____生成物总能量。A、大于 B、小于
-
20、自然界的氮循环如下图所示。
 (1)、氮分子的电子式为____;A、
(1)、氮分子的电子式为____;A、 B、
B、 (2)、氮气化学性质稳定的原因是。(3)、①、②、③中,属于自然固氮的是____。(双选)A、① B、② C、③(4)、雷雨天转化为的流程为:
(2)、氮气化学性质稳定的原因是。(3)、①、②、③中,属于自然固氮的是____。(双选)A、① B、② C、③(4)、雷雨天转化为的流程为:在雷电作用下转化为的化学方程式为。
(5)、上述转化为的反应中,体现的化学性质为____。A、氧化性 B、还原性 C、氧化性和还原性(6)、也可以通过化合反应转化为 , 写出工业合成氨的化学方程式。(7)、溶于水生成 , 写出在水中的电离方程式。