相关试卷
-
1、下列与实验有关的图标或安全标识对应不正确的是( )




A.护目镜
B.洗手
C.易燃类物质
D.排风
A、A B、B C、C D、D -
2、按物质的组成进行分类,SiO2属于( )A、碱 B、氧化物 C、盐 D、有机物
-
3、一种合成有机物J的路线如图所示。

已知:
 (、为烃基)
(、为烃基)回答下列问题:
(1)、C的化学名称是 , 由B生成C的反应类型是。(2)、E的结构简式为 , D分子中的官能团名称是。(3)、写出I生成J的过程中①的化学反应方程式。(4)、有机物M是J少3个碳原子的同系物。M的同分异构体中,满足以下条件的有种(不考虑立体异构);写出其中核磁共振氢谱有5组峰且峰面积之比为1:1:2:2:6的有机物的结构简式。①苯环上有2个取代基;
②苯环上有2种不同环境的氢原子;
③能发生水解反应,且水解产物之一遇到溶液显紫色。
-
4、我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用反应: , 可减少排放并合成清洁能源。(1)、该反应一般认为通过如下步骤来实现:
①
②
;已知反应①的 , (、为速率常数,与温度、催化剂有关)若平衡后升高温度,则(填“增大”、“不变”或“减小”)
(2)、500℃时,在容积为2L的密闭容器中充入 和 , 发生反应 , 测得时,反应达到平衡,体系的总压强为 , 此时。
和 , 发生反应 , 测得时,反应达到平衡,体系的总压强为 , 此时。①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是(填标号)。
A. B.混合气体密度不再改变
C.的体积分数不再改变 D.与的体积比不再改变
②欲增加的平衡转化率,可采取的措施有(填标号)。
A.充入氦气 B.升高温度
C.充入 D.充入
 和
和③从反应开始到平衡,的平均反应速率;的转化率为;求该温度下反应的平衡常数。(注:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
-
5、实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:

已知:①温度过高,间溴苯甲醛易被氧化。
②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质
溴
苯甲醛
1,2-二氯乙烷
间溴苯甲醛
沸点/℃
58.8
179
83.5
229
相对分子质量
160
106
99
185
步骤1:将一定配比的无水、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后装入三颈烧瓶(如图所示),缓慢滴加足量经浓硫酸干燥过的液溴,控温反应一段时间,冷却。

步骤2:将反应后的混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用溶液洗涤。
步骤3:向经洗涤的有机层加入适量无水固体,放置一段时间后过滤出晶体。
步骤4:分离有机层,减压蒸馏有机相,收集相应馏分。
(1)、实验装置中盛装液溴的仪器名称是 , 锥形瓶中的试剂为(填化学式)溶液,其作用为。(2)、步骤1反应过程中,为提高原料利用率,适宜的温度范围为____(填字母)。A、>229℃ B、58.8~179℃ C、<58.8℃(3)、有同学建议将装置中温度计换成搅拌器,那么温度计应移到(填位置)。(4)、步骤2中用溶液洗涤,是为了除去溶于有机层的(填化学式)。(5)、步骤4中采用减压蒸馏技术,其目的是。(6)、若实验结束后得到3.7g间溴苯甲醛。则本实验中间溴苯甲醛产率为。 -
6、纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含及少量、、、)为原料制备纳米氧化锌的工艺流程如下:
 (1)、“浸取”时盐酸不宜过量太多的原因有。(2)、“氧化除杂”所得“滤渣1”的成分含和。
(1)、“浸取”时盐酸不宜过量太多的原因有。(2)、“氧化除杂”所得“滤渣1”的成分含和。①与发生反应的离子方程式为。
②判断该步骤已完成的现象是。
(3)、写出除铜过程中发生的离子反应方程式。(4)、晶体有立方和六方两种晶型,晶胞结构如题图1所示。下列关于两种晶胞的说法正确的有____(填标号)。 A、立方硫化锌中与最近的有12个 B、都与4个紧邻 C、1个晶胞都含有4个(5)、“沉锌”得到碱式碳酸锌,化学式为。
A、立方硫化锌中与最近的有12个 B、都与4个紧邻 C、1个晶胞都含有4个(5)、“沉锌”得到碱式碳酸锌,化学式为。①“沉锌”的离子方程式为。
②碱式碳酸锌加热升温过程中固体的质量变化如图-2所示。350℃时,剩余固体中已不含碳元素,此时剩余固体的成分及物质的量之比是。

-
7、某废水处理过程中始终保持 , 通过调节使和形成硫化物而分离,体系中与关系如下图所示,c为、、和的浓度,单位为。已知:。下列说法正确的是( )
 A、④为与的关系曲线 B、 C、p点生成的沉淀中含有和 D、
A、④为与的关系曲线 B、 C、p点生成的沉淀中含有和 D、 -
8、与催化重整生成和 , 可减少温室气体排放,同时得到高热值的燃料。重整时涉及的主要反应如下:①;②。在恒压密闭容器中,起始时通入 , 实验测得和的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
 A、曲线A表示的平衡转化率随温度的变化 B、若压强恒为 , 则800K时反应②的压强平衡常数 C、X点时,对于反应②有: D、若在恒压、绝热容器中进行反应,反应达平衡时充入 , 达新平衡后保持不变
A、曲线A表示的平衡转化率随温度的变化 B、若压强恒为 , 则800K时反应②的压强平衡常数 C、X点时,对于反应②有: D、若在恒压、绝热容器中进行反应,反应达平衡时充入 , 达新平衡后保持不变 -
9、中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是( )
 A、放电时,纸张中的纤维素作为锂电池的负极 B、充电时,若阳极放出 , 则有回到电源正极 C、开关K闭合给锂电池充电,X对应充电电极上的反应为 D、放电时,由正极经过有机电解质溶液移向负极
A、放电时,纸张中的纤维素作为锂电池的负极 B、充电时,若阳极放出 , 则有回到电源正极 C、开关K闭合给锂电池充电,X对应充电电极上的反应为 D、放电时,由正极经过有机电解质溶液移向负极 -
10、丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是( )
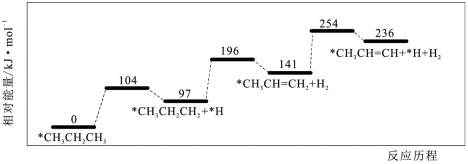 A、1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和 B、在该条件下,所得丙烯中不含其它有机物 C、该过程中发生了碳碳键的断裂与形成 D、相同条件下在该催化剂表面,比脱氢更困难
A、1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和 B、在该条件下,所得丙烯中不含其它有机物 C、该过程中发生了碳碳键的断裂与形成 D、相同条件下在该催化剂表面,比脱氢更困难 -
11、聚合硫酸铁(SPFS)是水处理中重要的絮凝剂,SPFS可以表示为。下图是以废铁屑为原料制备SPFS的一种工艺流程,下列说法错误的是( )
 A、酸浸釜中加入的酸最好是稀硫酸 B、每生成1mol SPFS消耗 C、在聚合釜中,随着水的加入中变小 D、减压蒸发的优点是蒸发温度低,SPFS不易分解
A、酸浸釜中加入的酸最好是稀硫酸 B、每生成1mol SPFS消耗 C、在聚合釜中,随着水的加入中变小 D、减压蒸发的优点是蒸发温度低,SPFS不易分解 -
12、短周期主族元素X、Y、Z、W、M的原子序数依次增大,这五种元素组成一种常用的增味剂T,其结构如图所示。下列叙述正确的是( )
 A、、的键角相等 B、简单氢化物的沸点:W>Y>Z C、第一电离能:Y<Z<W D、工业上电解熔融制备单质M
A、、的键角相等 B、简单氢化物的沸点:W>Y>Z C、第一电离能:Y<Z<W D、工业上电解熔融制备单质M -
13、某同学在实验室探究的性质:常温下,配制溶液,测得其为9.7;取少量该溶液滴加溶液至 , 滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )A、溶液呈碱性的原因是的水解程度大于电离程度 B、加入促进了的电离 C、反应的离子方程式是 D、反应后的溶液中存在:
-
14、酚酞是一种常见的酸碱指示剂,其分子结构如图所示。下列说法不正确的是( )
 A、酚酞的分子式为 B、酚酞分子中不存在手性碳,并且分子中所有碳原子不可能共平面 C、1mol酚酞与浓溴水反应,最多可消耗 D、1mol酚酞与溶液反应,最多可消耗
A、酚酞的分子式为 B、酚酞分子中不存在手性碳,并且分子中所有碳原子不可能共平面 C、1mol酚酞与浓溴水反应,最多可消耗 D、1mol酚酞与溶液反应,最多可消耗 -
15、一种利用磁铁矿()制备铁红的流程如下:

下列说法正确的是( )
A、往滤液A中滴加少量酸性溶液,可观察到紫红色褪去 B、可以用溶液和氯水检验滤液A中是否有 C、在空气中煅烧的反应方程式为 D、最终得到铁红中的元素的质量小于原磁铁矿中的元素的质量 -
16、下列过程对应的离子反应方程式书写正确的是( )A、溶液与过量澄清石灰水混合: B、向明矾溶液中通入过量氨气: C、用稀硝酸洗涤试管内壁的银镜: D、向溶液中加入少量溶液:
-
17、下列除杂试剂及除杂方法错误的是( )
选项
物质(括号内为杂质)
除杂试剂
除杂方法
A
饱和溶液
洗气
B
——
加热、灼烧
C
盐酸
过滤
D
——
A、A B、B C、C D、D -
18、下列化学用语或图示表达正确的是( )A、乙烯分子中的键:
 B、中C原子最高能级的电子云轮廓图
B、中C原子最高能级的电子云轮廓图 C、的VSEPR模型:
C、的VSEPR模型: D、的电子式可以表示为
D、的电子式可以表示为
-
19、下列生活中的现象与物质结构关联不正确的是( )A、焰色试验与电子跃迁有关 B、植物油加氢制硬化油与植物油中含有酯基有关 C、橡胶老化与碳碳双键有关 D、金属可加工成各种形状与金属键有关
-
20、化学与生活密切相关。下列叙述错误的是( )A、二甲苯可作油漆的清洗剂 B、聚乙炔可用于制备优良的绝缘高分子材料 C、天然气作为化工原料可用于制备甲醇和氨 D、含增塑剂的聚氯乙烯(PVC)薄膜不能用来生产食品包装材料