相关试卷
-
1、卤族元素是形成化合物的常见元素。请回答:(1)、含Na、Cl、Al三种元素的某化合物,其晶体部分结构如图所示。其化学式是 , 晶体类型是。
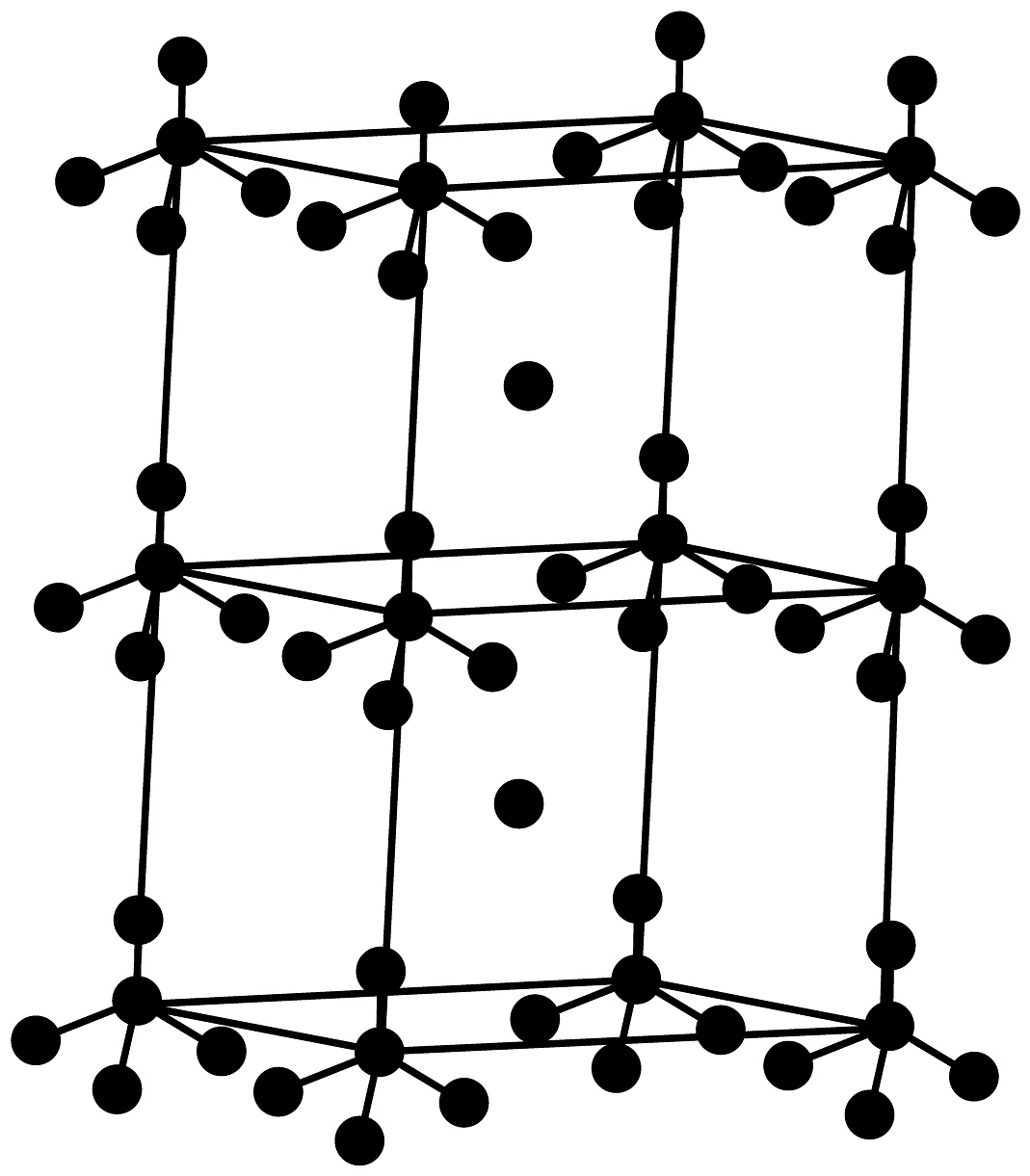 (2)、下列说法错误的是___________。A、电负性: B、第一电离能: C、离子半径: D、的简化电子排布式:(3)、一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
(2)、下列说法错误的是___________。A、电负性: B、第一电离能: C、离子半径: D、的简化电子排布式:(3)、一种比率光生探针M与铜离子配位,可用于小鼠脑内Cu(Ⅱ)的高时空分辨率动态成像。反应如下所示:
①M中C的杂化方式为。
②M中键角∠F-B-FBF3中键角∠F-B-F(填“>”、“<”、“=”),请说明理由。
(4)、在水中,氟化氢是一种弱酸,但氟化氢却是酸性很强的溶剂,其酸度与无水硫酸相当,能够给予氟化氢质子的化合物是很少的。如HNO3在HF溶剂中存在如下反应:。则HNO3在HF溶剂中呈(填“酸性”、“中性”、“碱性”) -
2、根据实验目的设计实验方案并进行实验,观察到相关现象,其中方案设计或结论正确的是
实验目的
方案设计
现象
结论
A
探究脱氧剂(主要成分是Fe粉)是否变质
取少量样品溶于盐酸,滴加KSCN溶液
无明显现象
脱氧剂没有变质
B
探究反应物浓度对反应:速率的影响
向A、B两支各盛有2 mL 0.2 mol/L H2C2O4溶液的试管中同时4 mL 0.01 mol/L KMnO4溶液、4 mL 0.02 mol/L KMnO4溶液,测定颜色褪去所需时间分别为和
褪色时间:
浓度增大,该反应速率加快
C
探究温度对水解平衡的影响
缓加热0.5 mol/L CH3COONa溶液到60℃,并用传感器测定溶液的pH,溶液的pH逐渐减小
溶液的pH逐渐减小
温度升高,水解平衡逆向移动
D
探究亚硫酸和次氯酸的酸性
向次氯酸钙的溶液中通入少量SO2
出现白色沉淀
酸性:H2SO3>HClO
A、A B、B C、C D、D -
3、沉淀转化在生产和科研中具有极其重要的应用,重晶石(BaSO4)是一种制备钡化合物重要的化工原料。已知:25℃时, , , H2CO3的电离常数 , , 下列说法不正确的是A、将足量BaSO4固体投入pH>11的Na2CO3溶液中,能生成BaCO3沉淀 B、反应的平衡常数约为0.042 C、向含BaSO4(s)的溶液中通入CO2气体,溶液中逐渐减小 D、向相同浓度和的混合溶液中滴加BaCl2溶液,两者可能同时沉淀
-
4、用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液为混合溶液。下列叙述不正确的是A、用浓硫酸作电解液更有利于电解形成氧化膜 B、电解质溶液中加入H2C2O4 , 有利于得到较厚的氧化膜 C、阳极的电极反应为: D、每生成0.01 mol氧化物,同时生成标准状况下672 mL H2
-
5、前四周期主族元素X、Y、Z、Q、W,原子序数依次增大。基态X和Y原子的s能级与p能级的电子数相等,且X、Q、W位于同一族。Y、Z、Q位于同一周期,Z的M层上存在2个未成对电子。下列A、熔化ZX2和QX2晶体时破坏的作用力不同 B、简单离子半径:X>Y C、WX2中心原子W为sp2杂化,空间结构为V形 D、简单氢化物沸点:H2W>H2Q>H2X
-
6、一种合成香豆素的原理如图:

下列说法正确的是
A、水杨醛分子和有机物M中所有原子可能共平面 B、1 mol香豆素最多能与5 mol H2发生加成反应 C、乙酸酐分子中σ键和π键数目比为5:1 D、可用溴水鉴别有机物M和水杨醛 -
7、下列离子方程式书写不正确的是A、氢氧化钠溶液与过量的碳酸氢钙溶液反应: B、向含溶质a mol的FeBr2溶液中通入b mol Cl2 , 充分反应,当时,反应的离子方程式为: C、向NaHSO3溶液中滴入酸化的溶液产生白色沉淀: D、将CuCl溶于的混合液中,久置后得到深蓝色溶液:
-
8、下列说法正确的是A、乙烷和氯气在光照条件下发生取代反应制得纯净的氯乙烷 B、可以用红外光谱仪区分乙醇和二甲醚 C、溴乙烷与NaOH乙醇溶液混合共热,将产生的气体通入酸性KMnO4溶液中,溶液褪色,可证明溴乙烷发生了消去反应 D、“杯酚”与C60发生化学反应、不与C70反应,从而分离C60和C70
-
9、下列装置所示的实验中,能达到实验目的的是
 A、图Ⅰ可以比较Na2CO3和NaHCO3的热稳定性 B、图Ⅱ用于实验室做NH3的喷泉实验 C、图Ⅲ可以证明酸性:CH3COOH>H2CO3>C6H5OH D、图Ⅳ用于检验乙醇消去产物中的乙烯
A、图Ⅰ可以比较Na2CO3和NaHCO3的热稳定性 B、图Ⅱ用于实验室做NH3的喷泉实验 C、图Ⅲ可以证明酸性:CH3COOH>H2CO3>C6H5OH D、图Ⅳ用于检验乙醇消去产物中的乙烯 -
10、下列说法不正确的是A、氯气可用于自来水的杀菌、消毒,利用了氯气的漂白性 B、节日燃放的五彩缤纷的烟花是利用了锂、钠、钾、钡等金属元素的焰色 C、聚乙炔中的C原子采取sp2杂化,其中未杂化的p轨道相互平行且重叠,可用于制备导电高分子材料 D、壳聚糖具有生物可降解性,可制成药物载体、手术缝合线、环保包装袋
-
11、从苯甲醛和KOH溶液反应后的混合液中分离出苯甲醇和苯甲酸的过程如下:

已知甲基叔丁基醚的密度为 , 下列说法错误的是
A、“萃取”过程的萃取剂也可以选择乙醇 B、“有机层”从分液漏斗上口倒出 C、“操作X”为蒸馏,“试剂Y”可选用盐酸 D、实验所得的苯甲酸粗产品,可以利用重结晶进一步提纯 -
12、室温下,下列溶液中一定能大量共存的离子组是A、强碱性溶液:、、、 B、加入铝粉有氢气产生的溶液:、、、 C、中性溶液:、、、 D、强酸性溶液:、、、
-
13、高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,工业上制备高铁酸钠的其中一种化学原理为: , 下列说法不正确的是(设为阿伏加德罗常数的值)A、反应中电子转移数目为时,生成的质量为166 g B、NaClO是还原剂,是氧化剂 C、根据该原理可得Na2FeO4在碱性环境中能稳定存在 D、NaCl是还原产物
-
14、下列表示正确的是A、的名称:2-乙基丁烷 B、气态BeCl2的空间结构名称为:V形 C、的能量最低时的价层电子排布图可能为:
 D、用电子式表示HCl的形成过程:
D、用电子式表示HCl的形成过程:
-
15、回收铝制饮料罐得到铝与从铝土矿制铝相比,前者能耗仅为后者的3%-5%,下列说法不正确的是A、铝制饮料罐的回收再利用可以节约大量能源,缓解能源紧张的问题 B、铝表面容易生成一层致密的氧化铝保护膜 C、硬铝的硬度大但强度较小,不适合制造飞机的外壳 D、电解熔融Al2O3时加入冰晶石,目的是降低Al2O3的熔化温度
-
16、下列物质溶于水能导电但属于非电解质的是A、HCl B、Cl2 C、CaCO3 D、NH3
-
17、单液流电池属于沉积型电池,它不带要隔膜或离子交换膜,从而大幅降低了电池成本和电池设计的复杂性,一种单液流电池工作原理如图所示,下列说法错误的是
 A、放电时,储液罐中溶液的不断增大 B、充电时,电极与电源的正极相连 C、放电时,正极反应式为 D、充电时,若电极增重 , 电解质溶液增加离子数为
A、放电时,储液罐中溶液的不断增大 B、充电时,电极与电源的正极相连 C、放电时,正极反应式为 D、充电时,若电极增重 , 电解质溶液增加离子数为 -
18、二水四氯合钴酸铵的制备反应为 , 下列说法正确的是A、基态原子核外电子的空间运动状态有27种 B、键角: C、该反应中所涉及的元素位于p区的有4种 D、中含有离子键、配位键、键等
-
19、马钱苷酸作为秦艽的药用活性成分,应用于痛风定片和骨刺消痛胶囊等药物当中,结构简式如图所示。下列说法正确的是
 A、马钱苷酸分子中一定含有平面环状结构 B、马钱苷酸最多消耗的物质的量之比为 C、马钱苷酸能使酸性溶液和溴水褪色且原理相同 D、马钱苷酸能发生消去、酯化、加成等反应
A、马钱苷酸分子中一定含有平面环状结构 B、马钱苷酸最多消耗的物质的量之比为 C、马钱苷酸能使酸性溶液和溴水褪色且原理相同 D、马钱苷酸能发生消去、酯化、加成等反应 -
20、中华文化源远流长,下列有关说法错误的是A、“斜月沉沉藏海雾,碣石潇湘无限路”,诗中的“海雾”可发生丁达尔效应 B、“大邑烧瓷轻且坚,扣如哀玉锦城传”,诗中的“瓷”属于传统无机非金属材料 C、“以曾青涂铁,铁赤色如铜”,句中的“曾青”为氢氧化铜 D、“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。句中的“法”指蒸馏