相关试卷
-
1、某小组探究的催化氧化,实验装置如图,③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后产生白烟。

下列分析正确的是
A、①中固体药品可用代替,②中固体药品可为与 B、③、④中现象说明③中的反应是 C、④中白烟的主要成分是 D、一段时间后,⑤中溶液可能变蓝 -
2、有机物Ⅰ结构对称,是一种优良的抗菌药成分,其合成路线如下。

已知:
①
②

回答下列问题:
(1)、化合物A的分子式为。(2)、反应①中,化合物A与气体x反应,生成化合物B,原子利用率100%。x为。(3)、芳香族化合物M为B的同分异构体,其能够发生银镜反应、水解反应,且在核磁共振氢谱上只有4组峰,则M的结构简式为 , 其含有的官能团名称为。(4)、关于由D→E的说法中,不正确的是________。A、反应过程中,有C-O单键的断裂和C=C双键的形成 B、HCHO为平面结构,分子中存在由p轨道“头碰头”形成的π键 C、化合物D中含有氧原子,能与水形成氢键,因此其易溶于水 D、化合物E中,碳原子采取、杂化,但不存在顺反异构(5)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
的溶液
b
水解反应
(6)、以甲苯、乙醛为含碳原料,利用反应③和④的原理,合成化合物W( )。基于自己设计的合成路线,回答下列问题:
)。基于自己设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为(写结构简式)。
(b)相关步骤涉及到芳香烃制卤代烃,其化学方程式为(注明反应条件)。
-
3、氰化物是指含有氰基或氰根离子的一类化合物,广泛应用于工业与农业中。(1)、工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ:
反应Ⅱ:
则反应Ⅲ:
(2)、在一定温度条件下,向1L恒容密闭容器中加入2mol和2mol发生反应Ⅲ,10min时反应达到平衡, 此时体积分数为30%。①0~10min内用表示的平均反应速率为。若保持温度不变,再向容器中加入和各1mol,则此时(填“>”“=”或“<”)。
②由实验得到的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的点(填字母标号)。
(3)、可做氧化废水中的催化剂,氧化过程中总氰化物(、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是。 (4)、常温下(-溶液体系中存在平衡关系:;;; , 平衡常数依次为、、、。含Cd物种的组分分布分数δ、平均配位数与的关系如图所示。
(4)、常温下(-溶液体系中存在平衡关系:;;; , 平衡常数依次为、、、。含Cd物种的组分分布分数δ、平均配位数与的关系如图所示。
已知:(过程中HCN浓度几乎不变),; , , , ;平均配位数 , 其中M代表中心离子,L代表配体。
①曲线Ⅱ代表的含Cd微粒为。
②的平衡常数为。
③下列有关说法中,正确的是。
A.降低pH,有利于生成
B.pH=7时,
C.平衡后加水稀释,与的浓度之比增大
④a点时,。(写出计算过程,结果保留2位有效数字)。
-
4、五氧化二饥广泛用于冶金、化工等行业。某废钒催化剂主要含有、、CaO、、、等,采取如下工艺流程回收其中的钒制备;

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀时()的pH
12.4
3.7
2.2
7.5
沉淀完全时()的pH
13.8
4.7
3.2
9.0
回答下列问题:
(1)、基态V原子的价电子轨道表示式为。(2)、浸出渣的主要成分是 , “酸浸还原”中;和均转化为 , 写出转化为反应的离子方程式为。(3)、“氧化”中被氧化的元素主要有(填元素符号)。(4)、“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式。(5)、“沉钒”中需要加入过量 , 其原因是。晶体未经洗涤直接进行“煅烧”,将导致产品中混有杂质。(6)、工艺中可循环利用的物质有。(7)、一定温度下,溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
①偏钒酸钠的化学式为。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为。
③若碳化钒合金的密度为 , 阿伏加德罗常数值为 , 则晶胞参数nm。
-
5、铁氰化钾()是一种氰配合物,易溶于水,可检验。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)、制备铁氰化钾。用氧化制备 , 装置如图所示。
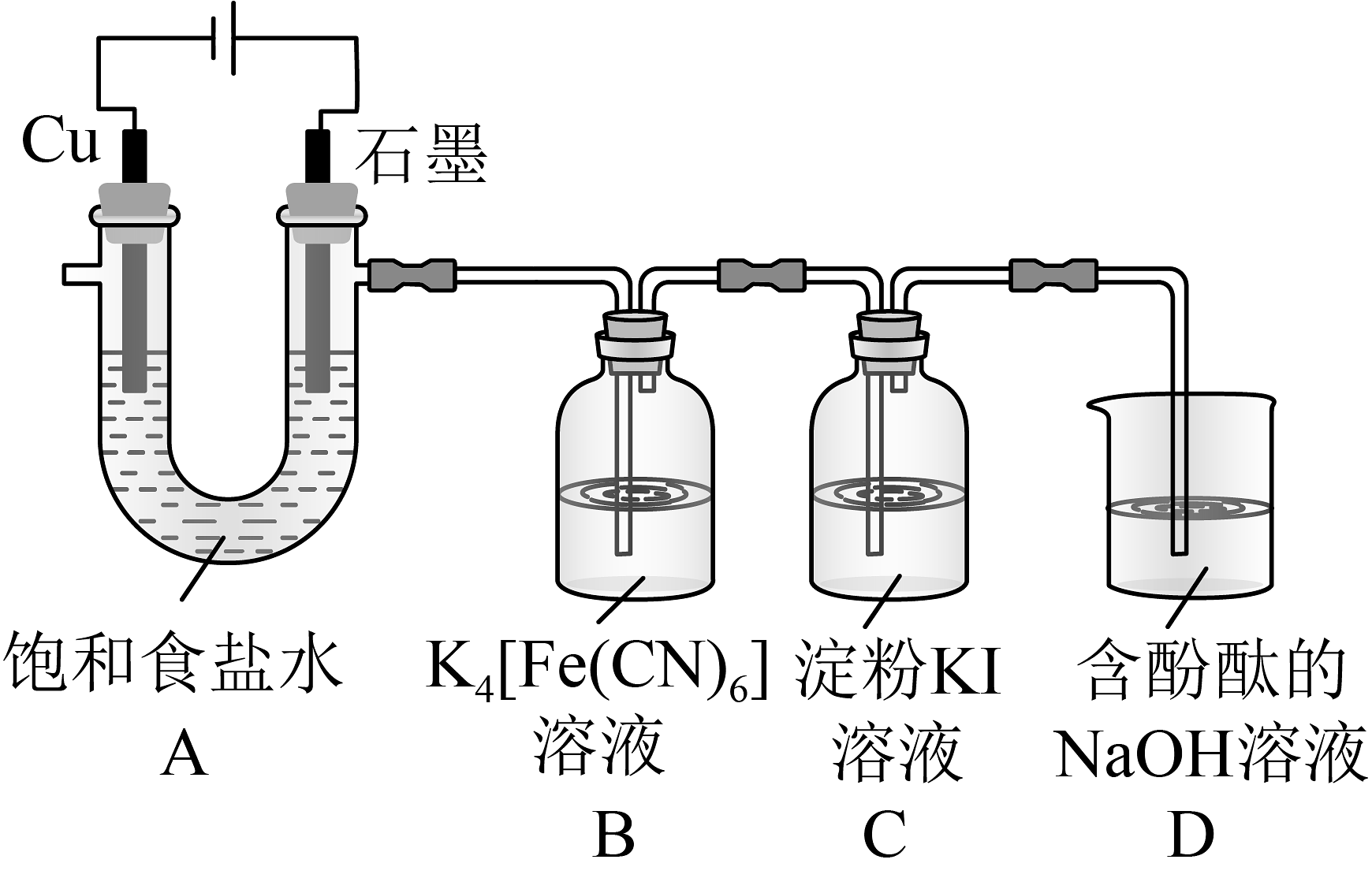
①装置A中Cu电极上的电极反应为。实验测得石墨电极上生成的体积小于Cu电极上生成气体的体积,其原因可能是。
②装置B中发生反应的化学反应方程式为。
(2)、探究铁氰化钾的性质。查阅资料,提出猜想:猜想1:具有氧化性;
猜想2:溶液中存在化学平衡。
设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知)。
实验
实验操作
实验现象
Ⅰ
向2mL饱和KI溶液中滴加5~6滴溶液,振荡,再滴加几滴淀粉溶液
无明显现象
Ⅱ
向2mL溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液
溶液变成蓝色
Ⅲ
溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸
滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红
Ⅳ
向浓度均为、的混合溶液中放入一根无锈铁丝
产生蓝色沉淀
Ⅴ
向溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同)
产生蓝色沉淀
①铁氰化钾晶体中各种微粒间的相互作用不包括(填编号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.键 f.范德华力
②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是。
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:。
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是。
(3)、铁氰化钾可用于测定硫酸钴晶体中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液mL。反应的方程式为。样品中钴的含量(以钴的质量分数ω计)(4)、铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途。 -
6、1,3-丁二烯与HBr发生加成反应机理如图。反应Ⅰ和反应Ⅱ都经过同一中间体,进一步发生基元反应②和基元反应③得到两种不同的加成产物。下列说法错误的是
 A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加
A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加 -
7、下列方案设计、现象和结论均正确且具有因果关系的是
选项
方案设计
现象和结论
A
室温下,用pH计测定0.1mol/L的、两种溶液的pH
溶液的pH较大,则电负性:F>Cl
B
向盛有0.2mol/L溶液的试管中加入0.1mol/L的溶液
试管口出现红棕色气体,则被还原为
C
将注射器充满气体,再往里推活塞压缩体积
气体颜色加深,则加压平衡向生成气体的方向移动
D
2mL0.1mol·L-¹的溶液中滴加2滴同浓度NaOH的溶液,再滴加4滴同浓度的
白色沉淀转化为红褐色沉淀,则
A、A B、B C、C D、D -
8、X原子不含中子,Y元素位于第四周期且基态原子中有5个未成对电子,基态W原子的s能级与p能级的电子总数相等,ZW与氮气分子具有相同的电子数,四种元素形成的配合物XY(ZW)5、结构如下图所示。下列说法不正确的是
 A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形
A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形 -
9、以黄铜矿(主要成分为 , 能导电)为原料,用(溶液作浸取剂提取的原理示意图如下。(结构式为
 )下列说法正确的是
)下列说法正确的是 A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为:
A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为: -
10、表示阿伏加德罗常数的值,有关反应的叙述正确的是A、1LpH=1的溶液中含有的数目为 B、1mol与足量NaOH溶液反应转移电子数为 C、标准状况下,22.4L与充分反应,生成物的分子数为 D、1mol与足量NaOH溶液反应, 所得溶液中数为
-
11、宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式能完全表示相应事实的是A、向溶液中滴加过量的氨水: B、将还原性铁粉加入过量的稀硝酸中: C、向溶液中加入溶液: D、模拟侯氏制碱法制备晶体:
-
12、以石墨为电极材料,按如图装置进行实验,关闭K后,反应开始。下列说法错误的是
 A、石墨电极A为正极,电极附近溶液颜色逐渐变浅 B、a中产生白色沉淀,溶液中、均减小 C、b中溶液先变蓝,后褪色,体现了的氧化性 D、M换用阴离子交换膜,化学能转化为电能效率降低
A、石墨电极A为正极,电极附近溶液颜色逐渐变浅 B、a中产生白色沉淀,溶液中、均减小 C、b中溶液先变蓝,后褪色,体现了的氧化性 D、M换用阴离子交换膜,化学能转化为电能效率降低 -
13、四环素(如图)是一种广谱抗生素,临床主要用于肺炎、百日咳等。关于该有机物的说法中不正确的是
 A、属于芳香族化合物 B、能与发生取代反应和加成反应 C、能与溶液反应生成 D、既能与强酸反应,又能与强碱反应
A、属于芳香族化合物 B、能与发生取代反应和加成反应 C、能与溶液反应生成 D、既能与强酸反应,又能与强碱反应 -
14、部分含氮、硫物质的分类与相应化合价关系如图所示。下列推断不合理的是
 A、e的浓溶液具有强氧化性,不能干燥气体c B、部分食品中添加适量c可起漂白、防腐和抗氧化等作用 C、将c和h同时通入到溶液中会产生白色沉淀 D、g和f可以通过催化转化生成无毒气体
A、e的浓溶液具有强氧化性,不能干燥气体c B、部分食品中添加适量c可起漂白、防腐和抗氧化等作用 C、将c和h同时通入到溶液中会产生白色沉淀 D、g和f可以通过催化转化生成无毒气体 -
15、劳动开创未来,成就梦想。下列劳动项目和涉及的化学知识描述正确的是
选项
劳动项目
化学知识
A
帮厨活动:用草木灰和生石灰等制作松花蛋
蛋白质在碱性环境中发生盐析
B
家务劳动:用热的纯碱溶液去除衣服上的油污
的水溶液具有碱性
C
学农活动:将糯米蒸煮后加入酒曲酿制成米酒
葡萄糖在酵母菌作用下水解成乙醇
D
社区服务:演示用泡沫灭火器灭火
盐酸与小苏打反应产生大量
A、A B、B C、C D、D -
16、化学是一门以实验为基础的科学,下列有关实验药品、装置或操作合理的是


A.用于制备氯气
B.测定盐酸物质的量浓度

C.蒸干溶液制备
D.配制溶液时转移溶液
A、A B、B C、C D、D -
17、化学与人类生活、科技、社会密切相关。下列新闻事件的解读正确的是
选项
新闻事件
化学解读
A
长征二号F遥十三运载火箭使用“偏二甲肼和”作推进剂
起氧化剂作用
B
化妆护肤品中常添加少量吸水性强的丙二醇
丙二醇是乙醇的同系物
C
速滑馆的冰面是采用超临界流体跨临界直冷制冰技术打造
跨临界直冷制冰技术是化学变化
D
科学家发现多层魔角石墨烯形成稳健超导性
石墨烯是有机高分子材料
A、A B、B C、C D、D -
18、化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是A、“尿不湿”中的高吸水性树脂,其主要成分聚丙烯酸钠属于天然有机高分子 B、2023年诺贝尔化学奖授予量子点研究,直径为2~20nm的硅量子点属于胶体 C、“煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于物理变化 D、“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的主要材料是硅
-
19、广东省博物馆集结了岭南文化的精髓,囊括历史、艺术、革命、与自然的多元魅力。下列文物主要成分属于无机非金属材料的是


A.新石器时代三足陶盘
B.西周兽面纹青铜岙


C.明雪梅双鹤图
D.潮汕百鸟朝凤木雕
A、A B、B C、C D、D -
20、某课题组设计合成一种多元酸内酯X,合成路线如下:

已知:①

②Cope重排反应:

请回答:
(1)、写出F中含有官能团的名称。(2)、写出D的结构简式。(3)、下列说法正确的是_______。A、A→B和D→E均经历Cope重排 B、化合物X的分子式为:C13H18O8 C、化合物C中含有4个手性碳原子 D、B→C的反应类型为取代反应(4)、写出G→X的化学反应方程式。(5)、写出4种同时符合下列条件的化合物C的同分异构体的结构简式(不包括立体异构体)。①含有1个六元环(不含其他环结构)
②1H-NMR谱和IR谱检测表明:分子中共有5种不同化学环境的氢原子,含碳氧双键。
(6)、以化合物 和
和 为原料,设计合成
为原料,设计合成 的路线(用流程图表示,无机试剂、有机溶剂任选)。
的路线(用流程图表示,无机试剂、有机溶剂任选)。