相关试卷
-
1、根据实验目的设计方案并进行实验,下列有关方案设计、实验现象或结论都正确的是
实验目的
方案设计
现象
结论
A
比较Cu和Fe的金属性强弱
取同浓度的①、②溶液,滴加同浓度氨水
①先沉淀后溶解,②沉淀后不溶解
金属性:Cu<Fe
B
检验己烯中的碳碳双键
取少量己烯,加入溴的四氯化碳溶液,振荡
上下两层均无色
己烯中含碳碳双键
C
比较配离子的稳定性
向盛有少量蒸馏水的试管里加2滴 , 然后再加2滴硫氰化钾溶液
溶液由黄色变血红色
与形成的配离子更稳定
D
比较温度对反应速率的影响
将2mL 0.1mol/L 溶液(A)浸入0℃水浴中、2mL 0.05mol/L 溶液(B)浸入50℃水浴中,再同时滴加0.1mol/L稀硫酸2mL
B溶液比A溶液先出现浑浊
温度越高,反应速率越快
A、A B、B C、C D、D -
2、感光材料CdS,常采用往溶液中通入至饱和后[],通过调节溶液pH来生产。下列说法不正确的是
已知:①、及、。②CdS晶体的晶胞如图所示。
 A、Cds的饱和溶液中, B、欲使沉淀的滤液中达到国家Ⅱ类地表水质量控制标准[],应控制溶液的pH≥1 C、溶液中缓慢滴加少量溶液,得到、CdS混合沉淀 D、在CdS晶体中离子的配位数为4(与离子最近且等距离的)
A、Cds的饱和溶液中, B、欲使沉淀的滤液中达到国家Ⅱ类地表水质量控制标准[],应控制溶液的pH≥1 C、溶液中缓慢滴加少量溶液,得到、CdS混合沉淀 D、在CdS晶体中离子的配位数为4(与离子最近且等距离的) -
3、已知基元反应的速率符合质量作用定律,如基元反应 , (k为速率常数)。卤代烃RX发生水解反应有两种历程,能量变化如下图所示,下列说法不正确的是
 A、若RX的水解速率 , 则反应按历程1进行 B、调节NaOH浓度,观察分层现象消失的用时变化,可确定RX的水解历程 C、相同条件下,按反应历程2,碘代烷水解速率要快于氯代烷 D、取水解液,加溶液,根据沉淀颜色可判断卤代烃RX中的卤素原子
A、若RX的水解速率 , 则反应按历程1进行 B、调节NaOH浓度,观察分层现象消失的用时变化,可确定RX的水解历程 C、相同条件下,按反应历程2,碘代烷水解速率要快于氯代烷 D、取水解液,加溶液,根据沉淀颜色可判断卤代烃RX中的卤素原子 -
4、X、Y、Z、M、Q五种前四周期元素,原子序数依次增大,X的s能级电子数量是p能级的两倍,Z元素形成的某种单质是极性分子,基态M的价电子排布式是 , 含Z、M的物质常用于自来水消毒,的3d能级处于半充满状态。下列说法正确的是A、含氧酸的酸性:X<Y<M B、X、Z可形成原子最外层均满足结构的共价化合物 C、过量单质Q与单质M反应生成 D、同周期元素中,第一电离能比Y小的元素共有4种
-
5、微生物脱盐池是在微生物燃料电池的基础上发展而来的新兴生物电化学系统,示意图如图所示。下列说法正确的是
 A、该装置能同时实现海水淡化、化学能转化为电能 B、当消耗标况下氧气11.2L时,透过X、Y交换膜的离子总数是个 C、负极反应为 D、Y为阴离子交换膜
A、该装置能同时实现海水淡化、化学能转化为电能 B、当消耗标况下氧气11.2L时,透过X、Y交换膜的离子总数是个 C、负极反应为 D、Y为阴离子交换膜 -
6、F可用于制造人工角膜,具有良好的生物相容性,化学性质稳定,合成路线如下:

下列说法不正确的是
A、由A生成B发生加成反应 B、E分子中杂化的C原子数多于杂化的C原子数 C、C易溶于水,分子中含有两种亲水基团 D、D的结构简式可能为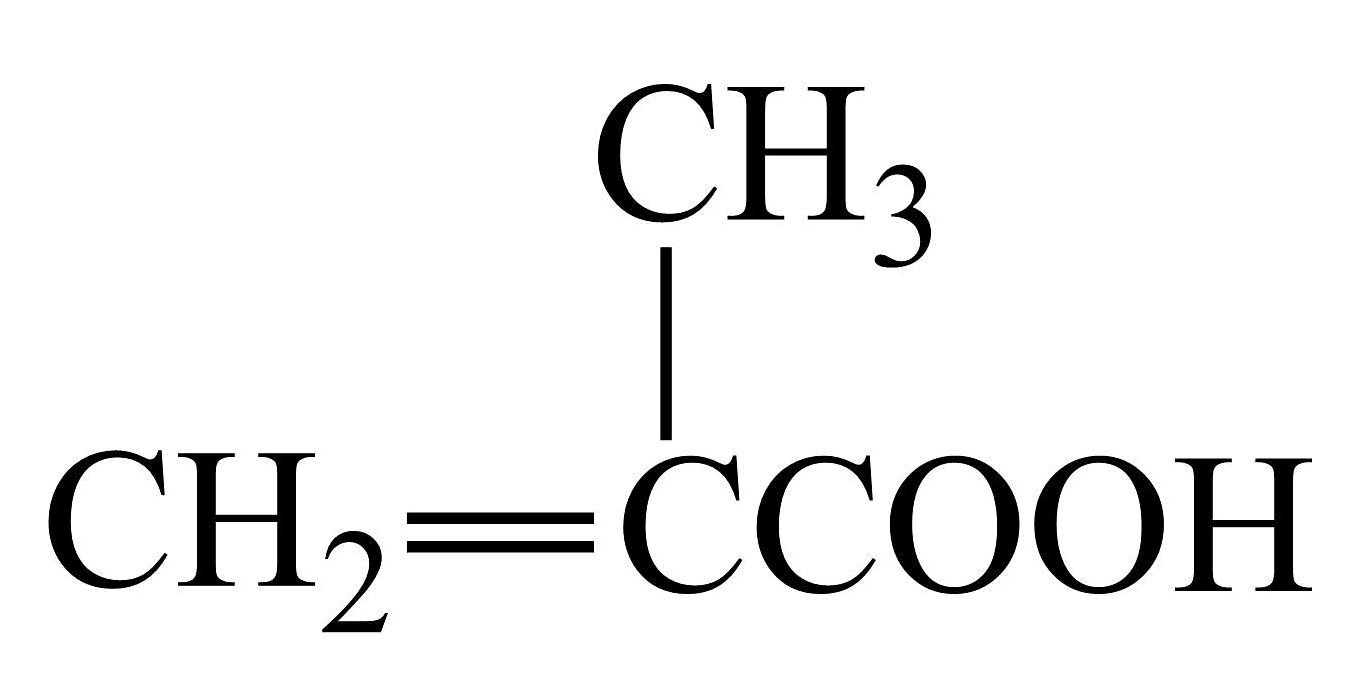
-
7、下列说法不正确的是A、质谱法可精确测定相对分子质量,也可确定简单分子的分子式 B、X射线衍射实验可测定青蒿素的分子结构 C、可用新制氢氧化铜悬浊液鉴别环己烷、乙醛和苯甲酸溶液 D、核酸是由许多核苷酸单体形成的不可水解的天然高分子化合物
-
8、下列化学反应与方程式不相符的是A、含等物质的量的和的溶液混合的离子方程式:
B、铅酸蓄电池充电时的阳极反应: C、表示气体燃烧热的热化学方程式: D、对苯二甲酸与乙二醇合成涤纶:n

-
9、下列实验装置使用或实验结果不正确的是


A.图①装置用电石和饱和食盐水反应制备乙炔
B.图②装置和混合一段时间后有油状液体生成


C.图③装置往溶液滴加足量氨水,反应后再加95%乙醇出现深蓝色晶体
D.图④装置用于探究水溶性
A、A B、B C、C D、D -
10、根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是
材料
组成或结构变化
性质变化与解释
A
钢铁
加入适量铬、镍等合金元素
可在铁表面形成一层致密的镍、铬氧化膜,增强铁的抗腐蚀性能
B
苯酚
通过与硝酸反应,在苯环上引入3个硝基
硝基的吸电子作用使三硝基苯酚O-H键极性增强,羟基上的H更易电离
C
橡胶
在橡胶中添加炭黑
炭黑具有还原性,可增强橡胶的抗老化性能
D
纤维素
用乙酰基取代纤维素上的羟基
纤维素链上的羟基减少,纤维素吸水能力下降
A、A B、B C、C D、D -
11、下列说法正确的是A、有毒,不能用作食品添加剂 B、石油工业中可以通过结构的调整,使链状烃转化为芳香烃 C、液体润湿全部滴定管内壁后,将液体从滴定管上部倒出 D、焰火、激光、LED灯光都与原子核外电子从基态到激发态释放能量有关
-
12、下列说法正确的是A、pH=11的氨水和pH=3的盐酸混合后的溶液,若 , 则溶液呈中性 B、在100℃时,pH约为6的纯水呈酸性 C、25℃时,将pH=8的NaOH溶液加水稀释100倍,所得溶液的pH=6 D、0.1溶液的pH小于7不能说明为弱电解质
-
13、我国古代四大发明之一的黑火药,由硫磺粉、硝酸钾和木炭粉按一定比例混合而成,其爆炸反应为。下列说法不正确的是(为阿伏加德罗常数的值)A、生成1mol 转移电子的数目为4 B、该反应的气态产物均是非极性分子 C、氧化产物与还原产物的物质的量之比为2∶3 D、火药爆炸过程中会产生能形成酸雨的气体
-
14、下列表示不正确的是A、基态N原子的价层电子排布图:
 B、分子的VSEPR模型:
B、分子的VSEPR模型: C、用电子式表示的形成:
C、用电子式表示的形成: D、2,2,3-三甲基己烷的键线式:
D、2,2,3-三甲基己烷的键线式:
-
15、侯氏制碱法将氨碱法制取碳酸钠和合成氨相互联合。下列说法不正确的是A、合成氨工业可为制取碳酸钠提供 B、氨碱法将通入氨的饱和氯化钠溶液 C、碳酸钠固体溶于水吸热 D、比热稳定性好
-
16、下列物质中不属于电解质的是A、HI B、 C、KOH D、
-
17、有机物X是一种重要的医药中间体,一种合成路线如下:

已知:
 。
。请回答:
(1)、B的官能团名称是。(2)、C的结构简式是。(3)、下列说法正确的是________(填序号)。A、甲苯转化为A的反应条件为 B、B可通过分子内反应生成盐 C、D在酸性条件下水解会生成 D、E→X转化只涉及取代反应(4)、写出G→H的化学方程式。(5)、设计以A和HCHO为有机原料合成B的路线(用流程图表示,无机试剂任选)。(6)、写出4种同时符合下列条件的甲苯的同分异构体的结构简式(不考虑立体异构)。①分子有2个环且环间共用2个碳原子,不存在“”结构。
②核磁共振氢谱显示分子中有3种不同氢原子。
-
18、二氧化氯是一种绿色氧化剂,可作漂白剂和饮用水消毒剂。易溶于水(相同条件下,在水中的溶解度约为的5倍,与水的反应可忽略)。某兴趣小组采用如下装置制备,原理为:。

请回答:
(1)、装稀硫酸的仪器的名称是。(2)、抽气泵作用是:①抽入空气稀释气体;②。(3)、在水中的溶解度大于的原因是。(4)、已知:、被还原的程度随pH的不同而变化,具体情况如下:①;②。取装置II中的溶液1.00mL,稀释至20.00mL,加过量KI后用标准溶液滴定,消耗标准液amL。将滴定后溶液用稀硫酸调溶液pH至 , 补加KI且除酸后再次滴定,又消耗标准溶液bmL(注:两次滴定均只发生反应)。求纯度(用含a、b的式子表示)。(5)、装置III中可加入的试剂有________(填序号)。A、饱和食盐水 B、溶液 C、NaOH和溶液 D、溶液(6)、下列说法不正确的是________(填序号)。A、垫上石棉网,用酒精灯煮沸装置I内溶液以加快反应 B、抽气泵的抽气速率对的产率没有影响 C、待装置II的进气管中不再产生气泡,再关闭抽气泵 D、冷却装置I中反应后的溶液,得到的晶体可作化肥 -
19、具备高储氢密度和低成本优势,被认为是极具应用潜力的储氢材料。请回答:(1)、通过水解反应可高效制氢,反应有:
反应1:
反应2:
反应3:
则:
(2)、等质量的在不同环境下发生反应I的产氢率如下图所示:
①在下发生水解,前3min放出(已换算为标准状况),则水解反应中消耗速率为(计算结果保留3位小数)。
②在溶液中的产氢率明显快于纯水,已知该现象只与有关。溶液能加快产氢速率的原因是。
(3)、在300-400℃和2.4~4MPa氢气压强下,Mg可与反应:。①恒容密闭容器中加入及足量 , 在四种温度下反应5min,的转化率如下表所示:
温度/℃
300
330
360
400
转化率
10%
50%
50%
33.3%
400℃时,压强平衡常数(是用组分的平衡压强代替浓度而求得的平衡常数),下列说法正确的是(填序号)。
A.与的总能量低于的能量
B.若在350℃下反应5min,转化率大于50%
C.若360℃时反应持续至10min,转化率增大
D.将中的化学能转化为电能时,参与负极反应
②贮氢合金中氢镁原子个数比为 , 当氢镁原子个数比为时恒温压缩容器,请画出气体压强p与x的变化曲线。

-
20、某矿石的组成为 , 以此为原料实现如下转化:

已知:矿石与HF反应时,元素化合价均未发生变化。
请回答:
(1)、下列说法正确的是________(填序号)。A、是由极性键形成的极性分子 B、的氧化性弱于 C、矿石中Si与O形成相互独立的正四面体结构 D、固体A中含有(2)、与矿石中金属阳离子的配位能力由强到弱的顺序是。(3)、生成深蓝色溶液的化学方程式为。(4)、遇酸会迅速分解,请设计实验证明氧化产物与还原产物。遇酸分解的离子方程式为。