相关试卷
-
1、“黄鸣龙还原法”是首例以中国科学家命名的有机化学反应,反应机理如图(R、R'代表烃基)。下列说法正确的是( )
 A、过程②③均为消去反应 B、若用发生该反应,过程③生成了 C、过程④的反应历程可表示为
A、过程②③均为消去反应 B、若用发生该反应,过程③生成了 C、过程④的反应历程可表示为 D、还原
D、还原
-
2、W、X、Y、Z是原子序数依次增大的四种短周期主族元素,W与X同周期且第一电离能 , X基态原子的s和p轨道电子数相等;Y基态原子的电离能数值为 , , , ;Z基态原子半径在同周期元素原子中最小;下列说法正确的是( )A、电负性: B、最简单氢化物的稳定性、沸点均是 C、简单离子半径: D、W、X都能与Y形成离子化合物
-
3、电导率是衡量电解质溶液导电能力大小的物理量。室温下,的。向浓度均为的和的混合溶液中滴加的溶液,测得溶液电导率与加入溶液体积的关系如图所示。下列说法正确的是( )
 A、a点溶液中约为 B、由bc段电导率变化趋势可知,的导电能力强于 C、b点溶液中: D、该温度下的溶液在c点与d点之间
A、a点溶液中约为 B、由bc段电导率变化趋势可知,的导电能力强于 C、b点溶液中: D、该温度下的溶液在c点与d点之间 -
4、氨是一种无碳燃料,同时它是工业界的重要化学品,科学家研发了一种水溶液体系电池,该电池能有效地捕获 , 将其转化为 , 再将产生的电解制氨,装置如图所示。下列说法正确的是( )
 A、电极b为正极,发生氧化反应 B、为增强丙中水的导电性,可加入适量盐酸 C、每捕获 , 理论上丙室质量减少 D、c电极反应式为
A、电极b为正极,发生氧化反应 B、为增强丙中水的导电性,可加入适量盐酸 C、每捕获 , 理论上丙室质量减少 D、c电极反应式为 -
5、化合物丙是合成药物盐酸沙格雷酯的重要中间体,其合成路线中的前两步反应如图。下列说法不正确的是( )
 A、甲、乙、丙在水中溶解度最大的是甲 B、甲分子能和甲醛在一定条件下发生缩聚反应 C、由甲生成乙发生的是加成反应 D、化合物丙最多有26个原子共平面
A、甲、乙、丙在水中溶解度最大的是甲 B、甲分子能和甲醛在一定条件下发生缩聚反应 C、由甲生成乙发生的是加成反应 D、化合物丙最多有26个原子共平面 -
6、某温度下,向恒容密闭容器中按的比例充入和 , 同时发生两个反应:① , ②。反应体系中组分、的物质的量浓度c随时间的变化情况如图所示)。下列说法正确的是( )
 A、时,的反应速率为 B、平衡时,W的选择性比M的大 C、反应①的活化能比反应②的活化能更大 D、平衡后,充入 , 压强增大,速率增大
A、时,的反应速率为 B、平衡时,W的选择性比M的大 C、反应①的活化能比反应②的活化能更大 D、平衡后,充入 , 压强增大,速率增大 -
7、下列装置可以用于相应实验的是( )
A
B


模拟侯氏制碱法制备
制备晶体
C
D


分离胶体
乙醇在浓硫酸作用下,加热到制备乙烯
A、A B、B C、C D、D -
8、下列有关电极方程式或离子方程式正确的是( )A、向溶液中通入 B、铅酸蓄电池充电时的阳极反应: C、溶液中加入产生沉淀: D、硅酸钠溶液中通入二氧化碳:
-
9、工业上拜耳法生产用铝土矿(主要成分为 , 含少量、等)为原料,其工艺流程如图:

下列说法正确的是( )
A、碱浸过程中发生复杂的氧化还原反应 B、物质X为 C、滤液2只含溶液,可以循环利用 D、可用过量代替氢氧化铝晶种沉铝 -
10、如图所示为探究性质的微型实验,滤纸①~④分别浸泡了相关试剂,实验时向试管中滴入几滴浓硫酸。下列说法正确的是( )
 A、滤纸①先变红后褪色 B、滤纸②褪色证明具有漂白性 C、滤纸③褪色取出放置一段时间后颜色可能恢复 D、滤纸④上有褪色固体生成,证明具有还原性
A、滤纸①先变红后褪色 B、滤纸②褪色证明具有漂白性 C、滤纸③褪色取出放置一段时间后颜色可能恢复 D、滤纸④上有褪色固体生成,证明具有还原性 -
11、在刚性容器中发生反应:。为阿伏加德罗常数的值,若消耗(标准状况) , 下列叙述错误的是( )A、转移的电子数为 B、生成的氧化产物分子数为 C、反应后容器内气体密度减小 D、将标准状况下溶于水,溶液中的数目为
-
12、化学与生活密切相关,下列说法正确的是( )A、HB铅笔芯的成分为二氧化铅 B、钢的含碳量越高,硬度和脆性越大 C、活性炭具有除异味和杀菌作用 D、维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化
-
13、某元素基态原子的轨道上有2个电子,则该基态原子的价层电子排布可能是( )A、 B、 C、 D、
-
14、下列化学用语表述错误的是( )A、中子数为10的氧原子: B、4-氯丁酸的结构简式: C、用单线桥表示电子转移过程:
 D、用电子式表示的形成:
D、用电子式表示的形成:
-
15、铬(Cr)和钒(V)具有广泛用途。铬钒渣中铬主要以形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如图所示:

已知:最高价铬酸根在碱性介质中以存在,在酸性介质中以存在;“煅烧”后铬的主要存在形式为。
回答下列问题:
(1)、中Cr的化合价为价;“浸取”前将煅烧后的固体进一步粉碎,你认为该操作的目的是。(2)、若在实验室中进行煅烧铬钒渣,一般不能用陶瓷坩埚,理由是;“煅烧”时,转化为的反应中,氧化剂与还原剂的物质的量之比为。(3)、“浸取”后分离出水浸渣的操作名称为。(4)、“沉淀”时加入适量的稀硫酸将溶液调至弱碱性,目的是。(5)、“分离钒”步骤中,将溶液pH调到1.8左右,此时铬的主要存在形式为 , 在“还原”步骤中溶液将还原为 , 自身转化为 , 试写出该反应的离子方程式:。(6)、若取10kg铬钒渣(其中Cr元素的质量分数为13%)按上述流程制备固体,在整个流程中Cr元素的利用率()为95%,则制得固体的质量为(保留3位有效数字)kg。 -
16、认识有机物一般先从结构入手,然后学习有机物的性质及转化,在此基础上进一步了解有机物的用途。
Ⅰ.图1中显示的是几种烃中的碳原子相互结合的方式。
 (1)、图1中,互为同分异构体的是(填标号,下同),互为同系物的是(只填一组)。下列关于B的同系物性质的叙述正确的是。
(1)、图1中,互为同分异构体的是(填标号,下同),互为同系物的是(只填一组)。下列关于B的同系物性质的叙述正确的是。a.所有同系物的含氢质量分数相同
b.最简单的同系物可用作植物生长调节剂
c.都是易燃物,燃烧产物一定为二氧化碳和水
d.均能因发生加成反应而使溴水和酸性溶液褪色
(2)、Ⅱ.乙醇在化学工业、医疗卫生、食品工业、农业生产等领域都有广泛的应用。某学习小组设计的乙醇催化氧化的实验装置如图2所示(加热与夹持装置已省略)。
装置A为制备氧气的发生装置,则装置A的锥形瓶中盛放的固体药品可能为____(填标号)。
A、 B、KCl C、 D、(3)、实验过程中,装置C硬质玻璃管中总反应的化学方程式为。(4)、以乙醇为原料可合成某种高分子涂料,其转化关系如图3所示。
有机物A的结构简式为;反应Ⅱ的化学方程式为。
-
17、二氧化碳的捕集、利用与封存已成为我国能源领域的一个重要战略方向。
已知:相关物质的燃烧热如表。
名称
化学式(状态)
△H/()
氢气
(g)
-285.8
乙烯
(g)
-1411.0
(1)、请写出表示(g)燃烧热的热化学方程式:; 。(2)、恒温条件下,向容积为1L的恒容密闭容器中,充入1mol和3mol , 发生反应:。反应过程中部分物质的物质的量浓度随时间变化如图。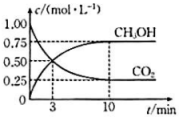
①3min时,(填“>”“<”或“=”);0~3min内,氢气的平均反应速率为。
②10min时,的转化[]为 , 此时容器中。
③10min时,容器内压强与反应起始时容器内压强之比为。
-
18、在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度是120℃。某兴趣小组设计实验,合成无水并完成乙烯的制备及收集。
Ⅰ.无水的制备[氯化铝遇水极易发生反应生成和HCl]:
 (1)、装置B的作用为 , 硬质玻璃管直接接入收集器的优点是;装置F的作用是。(2)、Ⅱ.乙烯的制备:
(1)、装置B的作用为 , 硬质玻璃管直接接入收集器的优点是;装置F的作用是。(2)、Ⅱ.乙烯的制备:
实验操作:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL,无水乙醇,点燃酒精灯。
盛装无水乙醇的仪器名称为 , 加入药品后,开始实验前,应先打开止水夹(填“1”“2”或“1和2”),反应进行一段时间后,当观察到(描述现象),再关闭该止水夹。
(3)、装置D中球形于燥管的作用是;D中发生反应的化学方程式为。 -
19、下列情境中的实验方案、现象及结论均正确的是( )
选项
方案
现象
结论
A
向淀粉溶液中滴加稀硫酸,水浴加热,加入新制
溶液变蓝
淀粉没有发生水解
B
常温下,将Cu片加入盛有浓的试管中
无明显现象
常温下,Cu在浓中发生钝化
C
向a试管中加入2mL5%的溶液和2滴1溶液,向b试管中加入2mL3%的溶液
试管a中反应更剧烈
可以加快的分解
D
用电流表测试由Mg、Al、稀硫酸构成的简易电池
铝片上产生大量气泡
铝片作正极
A、A B、B C、C D、D -
20、设为阿伏加德罗常数的值。下列说法正确的是( )A、一定条件下,0.1mol和0.15mol充分反应,转移的电子总数为0.6 B、常温常压下,11.2L中含有的C—H键的数目为3 C、标准状况下,22.4L与足量氯气完全反应,生成的数目为0.1 D、常温下,100g质量分数为46%的乙醇溶液中,氧原子数目为4