相关试卷
-
1、黄铁矿高温煅烧发生以下反应:4FeS2+11O2=2Fe2O3+8SO2 , 下列说法不正确的是( )A、FeS2作还原剂 B、在工业制硫酸中,上述反应在沸腾炉中进行 C、Fe2O3和SO2既是氧化产物又是还原产物 D、生成4molSO2转移电子的数目为20NA
-
2、为确定置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )A、Na2SO3溶液(BaCl2) B、FeCl2溶液(KSCN) C、Kl(淀粉溶液) D、HCHO溶液(石蕊试液)
-
3、化学与人类健康关系密切,下列说法正确的是( )A、在葡萄酒中添加适量SO2的主要目的是调节葡萄酒的酸度 B、制作豆腐时可以用石膏或胆矾“点卤” C、氯化镁、亚硝酸钠、山梨酸钾、三聚氰胺等均可以用作食品添加剂 D、膳食纤维是人体七大营养素之一,但难以在人体内水解为葡萄糖加以吸收利用
-
4、氯乙烯在一定条件下可反应生成聚氯乙烯
 下列说法不正确的是( ) A、上述转化过程为加聚反应 B、该反应的单体为
下列说法不正确的是( ) A、上述转化过程为加聚反应 B、该反应的单体为 C、聚氯乙烯和氯乙烯不是同系物
D、聚氯乙烯化学性质比氯乙烯稳定
C、聚氯乙烯和氯乙烯不是同系物
D、聚氯乙烯化学性质比氯乙烯稳定
-
5、下列说法不正确的是( )A、硫酸亚铁是优良的净水剂 B、工业上可使用液氨作制冷剂 C、工业上用二氧化硅在高温下与焦炭反应可直接制得高纯度的硅 D、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
-
6、冷敷袋俗称冰袋,在日常生活中有降温、保鲜和镇痛等多种用途,下列不能作为冷敷袋盛装的主要物质的是( )A、生石灰+水 B、冰 C、硝酸铵+水合碳酸钠 D、硝酸铵+水
-
7、在pH=1含Ba2+的溶液中,还能大量存在的离子是( )A、[Al(OH)4]- B、CO32- C、Cl- D、
-
8、下列化学用语表述正确的是( )A、乙醛的官能团:-COH B、用电子式表示水分子的形成过程:
 C、
C、 的名称:2-甲基-4-乙基戊烷
D、中子数为10的氧原子:
的名称:2-甲基-4-乙基戊烷
D、中子数为10的氧原子:
-
9、碳酸钠俗称纯碱,是一种重要的化工原料。下列说法不正确的是( )A、热的纯碱溶液可以去油污 B、向碳酸钠固体中加入少量水后,伴有放热现象 C、碳酸钠的热稳定性比碳酸氢钠的强 D、向氨化的饱和食盐水中通入足量的CO2后有碳酸钠晶体析出
-
10、下列物质对应的化学式不正确的是( )A、芒硝:Na2SO4·10H2O B、冰晶石:Na3AlF6 C、绿矾:CuSO4·5H2O D、生石膏:CaSO4·2H2O
-
11、不能与CuBr2溶液发生反应的是( )A、AgNO3溶液 B、新制氯水 C、氨水 D、FeCl3溶液
-
12、下列变化过程中,加入氧化剂可以实现的是( )A、Fe2O3→Fe B、NO2→NO C、Cl-→Cl2 D、SO32-→SO2
-
13、下列物质溶于水能导电且属于非电解质的是( )A、NH3 B、NaCl C、Cl2 D、CH3CH2OH
-
14、某些地区的自来水含有Fe3+ , 实验室可以通过蒸馏自来水的方法获得少量纯净的水,需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、
-
15、“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )A、丝绸 B、陶瓷 C、中草药 D、茶叶
-
16、石灰石的化学式为( )A、CaCO3 B、Na2CO3 C、Na2O2 D、CaCl2
-
17、脱落酸是一种抑制植物生长的激素,其衍生物L的合成路线如图。
 (1)、D的分子式为;过程的目的是。(2)、写出的反应方程式:。(3)、的过程中E中的(填官能团名称,下同)变为F中的。(4)、M是C的同分异构体,符合下列条件的M有种。
(1)、D的分子式为;过程的目的是。(2)、写出的反应方程式:。(3)、的过程中E中的(填官能团名称,下同)变为F中的。(4)、M是C的同分异构体,符合下列条件的M有种。①遇显紫色 ②有手性碳
(5)、依据上述合成路线的原理,利用其中原料,设计如图乙路线,合成有机化合物K,其结构简式如图甲所示:甲:

乙:

①H的结构简式是。
②试剂和条件:a是。
③的反应类型是。
-
18、催化加氢制甲醇,在减少排放的同时实现了的资源化,在某催化加氢制甲醇的反应体系中,发生的主要反应有:
反应Ⅰ.
反应Ⅱ.
反应Ⅲ.
回答下列问题:
(1)、反应Ⅰ、Ⅱ、Ⅲ以物质的量分数表示的平衡常数K与温度T变化关系如图所示。据图判断,0(填“>”“<”或“=”),的数值范围是(填序号)。A. B. C. D.
 (2)、在一定条件下,选择合适的催化剂只进行反应Ⅰ,控制和初始投料比为时,在不同温度下、、 , 达到平衡后,的转化率分别为、、 , 已知反应速率 , 、分别为正、逆向反应速率常数,x为物质的量分数。最大的是温度(填“”“”或“”)。(3)、在固定容积的容器中通入和发生上述反应,初始压强为p,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示:
(2)、在一定条件下,选择合适的催化剂只进行反应Ⅰ,控制和初始投料比为时,在不同温度下、、 , 达到平衡后,的转化率分别为、、 , 已知反应速率 , 、分别为正、逆向反应速率常数,x为物质的量分数。最大的是温度(填“”“”或“”)。(3)、在固定容积的容器中通入和发生上述反应,初始压强为p,反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示:
①图中X、Y分别代表、(填化学式)。
②图中时,反应Ⅰ的平衡常数1(填“>”“<”或“=”)。
③温度一定时,通入惰性气体,压强增大,平衡转化率(填“增大”“减小”或“不变”)。
④某温度达平衡时,容器中的物质的量为 , 的转化率为 , 反应Ⅱ平衡常数(用平衡分压代替平衡浓度,分压=总压×物质的量分数,化为最简比)。
-
19、钡盐沉淀法处理酸性含铬废水并回收铬元素的工艺路线如图:

已知:室温下相关物质的如下表:
化合物
(1)、位于周期表中区,其基态原子的简化电子排布式为。(2)、向废水中加入破氰剂 , 可以提高镍元素的去除率,氧化生成和无毒无味气体,使转化为两种沉淀除去,该反应过程中氧化剂与还原剂物质的量之比为。(3)、已知水溶液中(橙色)可转化为(黄色),该可逆反应用离子方程式可表示为;当钡盐投入量为理论投入量的2倍,用石灰乳将含铬废水预调至不同 , 废水中去除率随预调变化如图。与预调相比,时的去除率显著提高,可能的原因有(任写一条)。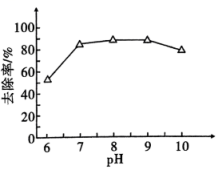 (4)、沉淀2与足量反应的离子方程式为。(5)、根据国家标准,含的浓度降至以下才能排放,则加入可溶性钡盐后的废水中应使的浓度不小于。
(4)、沉淀2与足量反应的离子方程式为。(5)、根据国家标准,含的浓度降至以下才能排放,则加入可溶性钡盐后的废水中应使的浓度不小于。 -
20、亚硝酰氯( , 熔点为 , 沸点为)是有机物合成中的重要试剂,为红褐色液体或黄色气体,遇水发生反应:。可由与在一定条件下反应得到,相关实验装置如图所示。
 (1)、装置Ⅱ中试剂为 , 装置Ⅳ的作用为 , 装置的连接顺序为。(2)、实验时先打开分液漏斗活塞滴入稀硝酸,当观察到Ⅴ中时,开始向装置中通入。(3)、Ⅵ中溶液用于吸收气体,反应产生黑色沉淀,写出该反应的离子方程式:。(4)、通过以下实验步骤测定制得样品纯度(杂质不参与以下反应):
(1)、装置Ⅱ中试剂为 , 装置Ⅳ的作用为 , 装置的连接顺序为。(2)、实验时先打开分液漏斗活塞滴入稀硝酸,当观察到Ⅴ中时,开始向装置中通入。(3)、Ⅵ中溶液用于吸收气体,反应产生黑色沉淀,写出该反应的离子方程式:。(4)、通过以下实验步骤测定制得样品纯度(杂质不参与以下反应):a.将Ⅴ中所得液体溶于水,配制成溶液;取出于锥形瓶中;
b.加入溶液(过量),使完全转化为沉淀;
c.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
d.加入指示剂,用标准溶液滴定过量的溶液,重复实验操作三次,消耗标准溶液的体积平均为。[已知 , ]
①滴定选用的指示剂是(填序号)。
A. B. C. D.
②的纯度为。(保留四位有效数字)