相关试卷
-
1、某电解质溶液中部分微观粒子的结构如图,“---”表示微粒间存在较强静电作用。A、B、C、D、E、F为原子序数依次增大的短周期元素。下列说法不正确的是( )
 A、工业上采用电解的方法冶炼D单质 B、同周期元素中,有一种元素的第一电离能介于B和C之间 C、最简单氢化物的沸点:C>F D、未成对电子数:A>E
A、工业上采用电解的方法冶炼D单质 B、同周期元素中,有一种元素的第一电离能介于B和C之间 C、最简单氢化物的沸点:C>F D、未成对电子数:A>E -
2、叔丁基溴在乙醇中反应的能量变化如图所示。

反应1:
反应2:
下列说法不正确的是( )
A、在乙醇中反应生成时,反应的催化剂是 B、在乙醇中反应生成时,增加催化剂的用量,可以提高转化为的选择性,减少副反应 C、在乙醇中反应生成时,决速步反应活化能为 D、升高温度,与乙醇反应转化率下降,与反应转化率升高 -
3、太阳能驱动和制备的装置如图。下列说法不正确的是( )
 A、阳极区电极反应式为 B、溶液中电流从a极流向b极 C、阳极区中补充可提高制备效率 D、理论上,每生成标况下时,阴极区溶液质量增加22g
A、阳极区电极反应式为 B、溶液中电流从a极流向b极 C、阳极区中补充可提高制备效率 D、理论上,每生成标况下时,阴极区溶液质量增加22g -
4、苯氧乙酸是制备某种香料的中间体,其制备原理如下图所示:

下列说法正确的是( )
A、环氧乙烷只能由乙烯氧化法制得 B、苯氧乙酸含有3种含氧官能团 C、苯氧乙醇的结构简式可能为 D、步骤2可以选用或作为氧化剂
D、步骤2可以选用或作为氧化剂
-
5、下列方程式与所给事实相符的是( )A、将少量通入溶液中: B、银氨溶液中加入足量盐酸产生沉淀: C、利用与制备沉淀: D、加热氯化铜溶液,溶液由绿色变为黄绿色:
-
6、有关有机物检测,下列说法正确的是( )A、酸性高锰酸钾溶液可以用于鉴别苯、己烷与苯乙烯 B、咖啡因的分子结构可以通过X射线衍射技术最终测定 C、质谱仪可用于确定丙醇中有几种化学环境的氢原子 D、光照条件下可以与发生取代反应的烃一定是烷烃
-
7、下列实验装置使用正确的是( )A、装置①可用于硫酸钠的焰色试验
 B、装置②可产生喷泉现象
B、装置②可产生喷泉现象 C、装置③可用于在铁制镀件表面镀铜
C、装置③可用于在铁制镀件表面镀铜 D、装置④可验证氨气能与酸反应
D、装置④可验证氨气能与酸反应
-
8、为阿伏加德罗常数的值,下列说法正确的是( )A、和固体混合物中,阳离子总数大于 B、足量的浓盐酸与反应,转移电子的数目为 C、50g46%的乙醇水溶液中含有的氢原子数为 D、的溶液中离子数为
-
9、实验室制取(一水合碘酸钙)的实验流程如图所示:

已知:常温下微溶于水,难溶于乙醇。下列说法不正确的是( )
A、四氯化碳的作用增大的溶解度,以提高利用率 B、操作1的名称为分液 C、加入后水层中的杂质为 D、操作2可以在冷却后加入乙醇促进产品析出 -
10、常温下,下列各组离子在指定条件下能大量共存的是( )A、溶液中:、、、 B、水溶液中:、、、 C、使紫色石蕊变红的溶液:、、、 D、使酚酞变红的溶液:、、、
-
11、三氟化溴遇水立即发生反应。下列有关该反应的说法正确的是( )A、氧化剂与还原剂的物质的量之比为2∶3 B、反应中每转移生成 C、反应中生成的两种酸都是强酸 D、中心原子价层电子对数为4
-
12、下列表述不正确的是( )A、富勒烯与金刚石互为同素异形体 B、乙炔中碳原子杂化轨道电子云轮廓图:
 C、五氯化磷的电子式中每个原子都满足最外层8电子结构
D、的名称:3-甲基-5-乙基庚烷
C、五氯化磷的电子式中每个原子都满足最外层8电子结构
D、的名称:3-甲基-5-乙基庚烷
-
13、下列关于铁及其化合物的叙述不正确的是( )A、红热的铁与水蒸气反应生成氢氧化铁和氢气 B、在空气里受热,能迅速被氧化成 C、隔绝空气的条件下,向溶液中加入后得到红褐色沉淀 D、溶液可用于有机物中酚羟基的检验
-
14、下列物质属于强电解质的是( )A、氨气 B、硬脂酸钠 C、醋酸 D、石灰水
-
15、苯乙烯是生产塑料与合成橡胶的重要原料。氧化乙苯脱氢的反应为:(1)、已知:

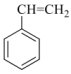
反应I:


反应II:
则。
(2)、下列关于氧化乙苯脱氢反应说法正确的是____(填标号)。A、恒温恒容下,若体系气体的平均相对分子质量不变,则反应达到平衡状态 B、及时分离出水蒸气,有利于提高平衡混合物中苯乙烯含量 C、恒温恒容下,反应达平衡后,再充入少量 , 平衡将向左移动 D、升高温度,正反应速率增大,逆反应速率减小(3)、常压下,乙苯和吸附在催化剂表面的活性中心,并发生反应。控制投料比[(乙苯)]分别为1:1、5:1和10:1,乙苯平衡转化率与反应温度的关系如图所示。
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越(填“高”或“低”)。
②实验发现,相同温度下,当投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是(答出一条即可)。
(4)、700K时,向恒容密闭容器中加入过量和一定量乙苯,此时反应I和II不发生。初始容器内压强为(此时未分解),平衡时容器内压强 , 则平衡时苯乙烯的分压为(以含有的代数式表示)。[已知:①为以分压表示的平衡常数,分压=总压物质的量分数。②时,(5)、催化氧化乙苯脱氢制苯乙烯可能存在两种机理:
①机理一可表示为下列两个基元反应(表示催化剂),请补全反应ii:
i:


ii:。
机理二认为乙苯在催化剂表面先发生反应I,再发生反应II。
②用代替乙苯,分别在催化剂A和B表面进行模拟实验,以验证催化剂的作用机理。实验前,两催化剂均吸附有少量;实验中,两催化剂表面依次通过。用质谱仪对气相体系中各物质进行实时检测结果如下表。其中“+”和“-”分别表示检测到和未检测到相应产物。实验检测结果如下表所示。
催化剂种类
A
B
通入的气体
CO检验结果
+(结果a)
−
+(结果c)
+
检验结果
+(结果b)
−
+(结果d)
−
已知:i.Ar不参与反应,且不与催化剂作用;
ii.质谱仪工作时,有少量产生于质谱仪中的分子碎片。
实验中检测到各物质的物质的量:结果结果 , 结果结果 , 结果结果。由此可推测,在催化剂B的作用下,主要存在机理(填“一”或“二”);通入后,气体检测结果进一步佐证了在催化剂B作用下上述机理的存在,同时进一步排除了另一种机理,试加以说明。
-
16、在生产生活中应用广泛。某化学兴趣小组在实验室设计系列与相关实验。(1)、I.制备:小组同学用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制备 , 发现制得气体不纯,开展如下探究。
制得的中可能混有气体杂质和(填化学式,不考虑水蒸气)。(2)、小组同学设计了如图所示装置探究气体成分。
①装置C中品红溶液的作用是。
②装置G的名称为。
(3)、II.改进实验后,该小组设计如图装置验证的化学性质。
能验证具有氧化性的实验现象为。
(4)、为验证的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案一:向第一份溶液加入品红溶液,红色褪去;方案二:向第二份溶液加入溶液,产生白色沉淀;
方案三:向第三份溶液中加入溶液,有白色沉淀生成。
上述方案中合理的是方案。
III.小组欲探究是否与气体反应,设计了下列实验装置图。(已知:石棉线是一种耐火材料,不参与反应)

A中发生反应的化学方程式为。
(5)、实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的气体,则镁与除了发生反应: , 还可能发生的反应方程式为。 -
17、由硫铁矿烧渣(主要成分为、和)得到绿矾(),然后制取透明氧化铁的流程如下:

已知:i.透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(),难溶于水,在碱性条件下较稳定;ii.能将中的硫元素氧化为+6价。
回答下列问题:
(1)、“滤渣”中的主要成分是。(2)、“还原”过程中涉及的主要离子方程式为。(3)、流程中“ ”的目的是。 (4)、“氧化”过程中,氧化剂与还原剂的物质的量的比值为。(5)、“沉淀”采用分批加入溶液,并不断搅拌,这样操作不但可以得到色泽纯正的 , 而且还可以。(6)、透明氧化铁作为电极材料可制备锂离子电池(另一极为金属锂和石墨的复合材料)。如图所示,室温下,对该电池进行循环充放电,成功地实现了对磁性的可逆调控。充电时,对应电极连接外接电源的极。放电时,该电池的正极反应式为。
”的目的是。 (4)、“氧化”过程中,氧化剂与还原剂的物质的量的比值为。(5)、“沉淀”采用分批加入溶液,并不断搅拌,这样操作不但可以得到色泽纯正的 , 而且还可以。(6)、透明氧化铁作为电极材料可制备锂离子电池(另一极为金属锂和石墨的复合材料)。如图所示,室温下,对该电池进行循环充放电,成功地实现了对磁性的可逆调控。充电时,对应电极连接外接电源的极。放电时,该电池的正极反应式为。
-
18、以石油气为原料生产香料H的合成路线如下图所示。A在常温常压下为气态烷烃,且在一定条件下可发生裂解。B是沼气的主要成分,F的水溶液常用于杀菌消毒。

回答下列问题:
(1)、化合物F的官能团名称为。(2)、化合物C发生加聚反应后,产物的结构简式为。(3)、反应②的反应条件为。(4)、反应④的化学方程式为。(5)、X是A的同系物且比A多一个碳原子。X的同分异构体中,室温下为气态的分子系统命名为。(6)、H的羧酸同分异构体还有种。(7)、某烃相对分子质量比A大46,其一氯代物只有1种,且不能与的发生加成反应使其褪色,则的结构简式为。 -
19、工业丙烷脱氢制丙烯的原理为。不同压强下,在密闭容器中丙烷平衡转化率随温度变化关系如图所示。下列说法错误的是( )
 A、该反应为吸热反应 B、压强大小关系: C、 , 该反应以物质的量分数表示的化学平衡常数 D、 , , 若进料组成中充入氩气,则点将下移
A、该反应为吸热反应 B、压强大小关系: C、 , 该反应以物质的量分数表示的化学平衡常数 D、 , , 若进料组成中充入氩气,则点将下移 -
20、石墨烯电极材料可在光照条件下产生电子()和空穴(),其制氧效果优越。原理如图所示。下列叙述正确的是( )
 A、放电时电势高低: B、放电时,电子流向:离子交换膜 C、放电时存在反应:(空穴 D、充电效率与光照产生的电子和空穴量有关
A、放电时电势高低: B、放电时,电子流向:离子交换膜 C、放电时存在反应:(空穴 D、充电效率与光照产生的电子和空穴量有关