相关试卷
-
1、化学大大推动了体育事业的发展,下列说法正确的是A、聚酯纤维中的涤纶可制作运动服,涤纶是合成纤维。 B、杭州亚运会运动场地防滑涂层用到了石墨烯,石墨烯属于有机高分子材料 C、受伤时所喷的氯乙烷能镇痛和局部麻醉的作用,是因为氯乙烷易分解且吸收热量 D、1,3-丁二烯可用作运动鞋鞋底的原料,聚1,3-丁二烯不能使高锰酸钾溶液褪色
-
2、化学创造美好生活。下列说法正确的的是A、葡萄糖在酶的催化下水解为乙醇,可用作燃料 B、植物油催化加氢发生加成反应,可用于制人造奶油 C、制作豆腐的原理是利用盐卤等物质使豆浆中的蛋白质变性 D、五彩斑斓的霓虹灯光与原子核外电子跃迁有关,属于吸收光谱
-
3、物质的组成和结构决定性质和变化,关于下列事实的解释中错误的是
选项
事实
解释
A
金刚石的硬度大
金刚石为空间网状结构
B
水的热稳定性强于氨
水分子间形成的氢键数目与强度均大于氨
C
碱金属中的熔点最高
碱金属中锂离子的半径最小,形成的金属键最强
D
在水中的溶解度比的大
和均为极性分子,为非极性分子
A、A B、B C、C D、D -
4、湛江有很多美食,如炭烧生蚝、白切鸡、田艾籺等,田艾籺面皮通常选用糯米粉,甜馅里主要有椰丝或芝麻糖。下列有关说法正确的是A、生蚝烧制过程中只发生了物理变化 B、椰丝中的纤维素可以在人体内分解,提供能量 C、白切鸡中的蛋白质是由氨基酸脱水缩合而成的大分子 D、糯米粉含有大量的淀粉,淀粉与纤维素互为同分异构体
-
5、设为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,11.2L中含有的质子数为5 B、常温常压下,共含0.2个原子的和混合气体,其体积大于2.24L C、2.3g与含0.01的稀硫酸充分反应,转移电子数为0.02 D、2.0的溶液中含4个
-
6、某盐X含有三种元素,其相对分子质量为134,常用于焰火的黄色发光剂。气体A的密度与相同,盐D与X组成元素完全相同。在一定条件下有如下转化关系:

请回答:
(1)、盐X所含元素为(请填写元素符号),盐X的化学式为。(2)、写出B转化为C的离子方程式。(3)、盐X隔绝空气加热分解生成A和D的化学方程式为。 -
7、最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A、CO和O生成CO2是吸热反应 B、在该过程中,CO断键形成C和O C、CO和O生成了具有极性共价键的CO2 D、状态Ⅰ →状态Ⅲ表示CO与O2反应的过程 -
8、2019年诺贝尔化学奖颁给研究锂电池的科学家,一种用作锂电池电解液的锂盐结构如图所示。其中,X位于第三周期,X原子的电子数为Z原子的两倍,W、Z、Y位于同一周期。下列说法不正确的是
 A、非金属性: B、X的氧化物对应的水化物均为强酸 C、Y的氢化物可用于刻蚀玻璃 D、中,Z的化合价为+2价
A、非金属性: B、X的氧化物对应的水化物均为强酸 C、Y的氢化物可用于刻蚀玻璃 D、中,Z的化合价为+2价 -
9、下列说法不正确的是A、用溴的四氯化碳溶液鉴别乙烯和乙烷 B、用酸性高锰酸钾溶液鉴别乙醇、乙酸和苯 C、用分液法分离乙酸乙酯和碳酸钠溶液混合物 D、苯、乙醇、四氯化碳和植物油都能用于萃取碘水中的碘
-
10、物质的组成和结构决定其性质和变化。下列事实解释错误的是
选项
事实
解释
A
食用油在空气中久置出现“哈喇”味
分子中含有的碳碳双键被氧化
B
用质谱仪检测乙酸时,谱图出现了质荷比为120的峰
两个乙酸分子通过范德华力形成了二聚体
C
缺角的NaCl晶体在饱和NaCl溶液中变为完美的立方体
晶体具有自范性
D
在溶液中滴加少量溶液,红色褪去
与生成配合物的稳定性较强
A、A B、B C、C D、D -
11、下图是碳及其化合物的“价一类”二维图,f为、。下列说法正确的是
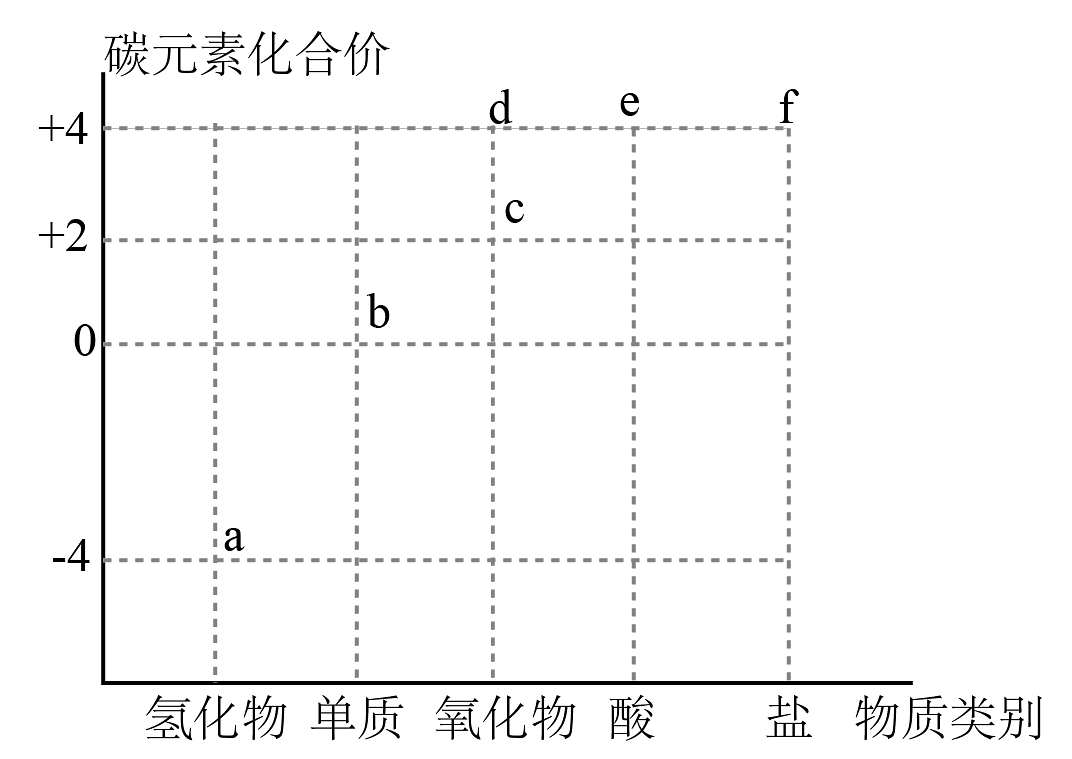 A、a只能被氧化,c是酸性氧化物 B、d的水溶液能导电,d属于电解质 C、d→f的转化一定不是氧化还原反应 D、向饱和溶液中通入d有沉淀析出
A、a只能被氧化,c是酸性氧化物 B、d的水溶液能导电,d属于电解质 C、d→f的转化一定不是氧化还原反应 D、向饱和溶液中通入d有沉淀析出 -
12、定量实验是学习化学的重要途径,下列操作规范且能达到定量实验目的的是
 A、用图1所示装置测定中和反应的反应热 B、用图2所示装置测定硫酸溶液的浓度 C、用图3所示装置配制100mL一定物质的量浓度的硫酸溶液 D、用图4所示装置加热硫酸铜晶体测定晶体中结晶水的含量
A、用图1所示装置测定中和反应的反应热 B、用图2所示装置测定硫酸溶液的浓度 C、用图3所示装置配制100mL一定物质的量浓度的硫酸溶液 D、用图4所示装置加热硫酸铜晶体测定晶体中结晶水的含量 -
13、某无色澄清溶液中可能含有①、②、③、④、⑤、⑥、⑦中的若干种,依次进行下列实验,且步骤Ⅱ、Ⅲ所加试剂均过量,观察到的现象如表格所示。下列结论正确的是
步骤
操作
现象
Ⅰ
取样,滴加几滴紫色石蕊溶液,振荡
溶液变成红色
Ⅱ
取样,先滴加稀盐酸,再滴加溶液
生成白色沉淀
Ⅲ
过滤Ⅱ中所得混合物,向滤液中滴加和的混合液
生成白色沉淀
A、一定含有的离子是②③⑥ B、一定没有的离子是④⑤ C、可能含有的离子是①③ D、可能含有的离子是①②⑦ -
14、工业上处理低品位黄铜矿[二硫化亚铁铜()含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾()和胆矾()。相关流程如图所示。

已知:①生物堆浸使用的氧化亚铁硫杆菌(细菌)在为范围内可保持活性。
②常温下,金属离子沉淀(离子浓度小于时可认为沉淀完全)的如下表。
金属离子
开始沉淀时的
1.6
4.2
6.3
完全沉淀时的
3.1
6.2
8.3
下列说法错误的是
A、研磨的目的是使反应快速而充分 B、可用KSCN溶液检验溶液中是否含有 C、生物堆浸过程中,应控制溶液的在 D、常温下, -
15、在电场作用下双极膜能够将解离成H+和OH- , 工业上可利用双极膜电渗析法制备葡萄糖酸(一元弱酸),制备原理如下图所示。下列说法不正确的是
 A、电极a和电源正极相连 B、b极的电极反应式为 C、电解结束后阴极室溶液碱性增强 D、当b极生成标准状况下22.4L时,理论上可生成1mol葡萄糖酸
A、电极a和电源正极相连 B、b极的电极反应式为 C、电解结束后阴极室溶液碱性增强 D、当b极生成标准状况下22.4L时,理论上可生成1mol葡萄糖酸 -
16、酞菁钴被广泛应用于光电材料、光动力学光敏材料等方面。酞菁钴(II)结构如图所示(Co均形成单键,部分化学键未画明)。下列说法错误的是( )
 A、酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H B、酞菁钴(II)中碳原子的杂化方式只有sp2杂化 C、1号和3号N原子的VSEPR模型均为平面三角形 D、2号和4号N原子与Co(Ⅱ)是通过配位键结合
A、酞菁钴(II)中三种非金属元素的电负性大小顺序为N>C>H B、酞菁钴(II)中碳原子的杂化方式只有sp2杂化 C、1号和3号N原子的VSEPR模型均为平面三角形 D、2号和4号N原子与Co(Ⅱ)是通过配位键结合 -
17、常温下,用0.100mol/L的NaOH溶液滴定20.00mL同浓度的CH3COOH溶液,滴定曲线如图所示,下列说法错误的是
 A、a点溶液中,c(CH3COOH)+c(CH3COO-)=0.1mol/L B、b点溶液中,一定存在c(CH3COO-)>c(Na+) C、c点溶液中,V1<20.00mL D、d点溶液中,共有5种微粒
A、a点溶液中,c(CH3COOH)+c(CH3COO-)=0.1mol/L B、b点溶液中,一定存在c(CH3COO-)>c(Na+) C、c点溶液中,V1<20.00mL D、d点溶液中,共有5种微粒 -
18、浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图所示的实验,请判断下列说法正确的是
 A、物质甲可以是碱石灰,用于检验生成的水 B、装置乙中会生成淡黄色沉淀,体现了的还原性 C、装置丙中溶液的紫色褪去,体现了的漂白性 D、装置戊中溶液不褪色,装置己中出现浑浊,说明产物中含有
A、物质甲可以是碱石灰,用于检验生成的水 B、装置乙中会生成淡黄色沉淀,体现了的还原性 C、装置丙中溶液的紫色褪去,体现了的漂白性 D、装置戊中溶液不褪色,装置己中出现浑浊,说明产物中含有 -
19、图为实验室制取乙炔并验证其性质的装置图。下列说法不正确的是
 A、逐滴加入饱和食盐水可控制生成乙炔的速率 B、酸性溶液褪色,说明乙炔具有还原性 C、圆底烧瓶中发生反应的化学方程式为: D、将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔含碳量高
A、逐滴加入饱和食盐水可控制生成乙炔的速率 B、酸性溶液褪色,说明乙炔具有还原性 C、圆底烧瓶中发生反应的化学方程式为: D、将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔含碳量高 -
20、海博麦布是我国首个自主研发的胆固醇吸收抑制剂,结构简式如图所示。下列说法错误的是
 A、该分子存在顺反异构体 B、该分子中含有2个手性碳原子 C、该物质能与反应产生无色气体 D、1mol该物质与浓溴水反应,最多消耗3mol
A、该分子存在顺反异构体 B、该分子中含有2个手性碳原子 C、该物质能与反应产生无色气体 D、1mol该物质与浓溴水反应,最多消耗3mol