相关试卷
-
1、实验室制备CuCl:将按一定物质的量之比混合的CuSO4溶液和NaCl溶液加入到三颈烧瓶中(装置如图1所示,其中夹持仪器已省略),通入SO2 , 充分反应后过滤,得CuCl。CuCl的产率随NaCl和CuSO4的物质的量之比变化如图2所示。已知:CuCl是难溶于水的白色固体,能溶于浓盐酸产生[CuCl2]-。下列说法错误的是
 A、装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2 B、装置b的作用是安全瓶,防止倒吸 C、装置c中的液体可以是NaOH浓溶液,吸收尾气 D、当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]-
A、装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2 B、装置b的作用是安全瓶,防止倒吸 C、装置c中的液体可以是NaOH浓溶液,吸收尾气 D、当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]- -
2、我国科学家开发出在碱性海水里直接电解制氢的技术,工作原理如图1所示。MnOx隔水薄膜可以起到阻挡Cl-与电极催化剂活性中心接触的作用,离子交换膜选择性透过在电极A反应的物质,电极A含有M金属催化剂,发生的电极反应过程如图2所示。下列说法不正确的是
 A、A极的电极反应式为4OH--4e-=O2↑+2H2O B、离子交换膜为阴离子交换膜 C、每转移2 mol电子,理论上电极B产生0.5 mol气体 D、去掉MnOx隔水薄膜后电极A会产生Cl2
A、A极的电极反应式为4OH--4e-=O2↑+2H2O B、离子交换膜为阴离子交换膜 C、每转移2 mol电子,理论上电极B产生0.5 mol气体 D、去掉MnOx隔水薄膜后电极A会产生Cl2 -
3、反应物转化为产物时的能量变化与反应进程的关系如图所示,下列说法正确的是
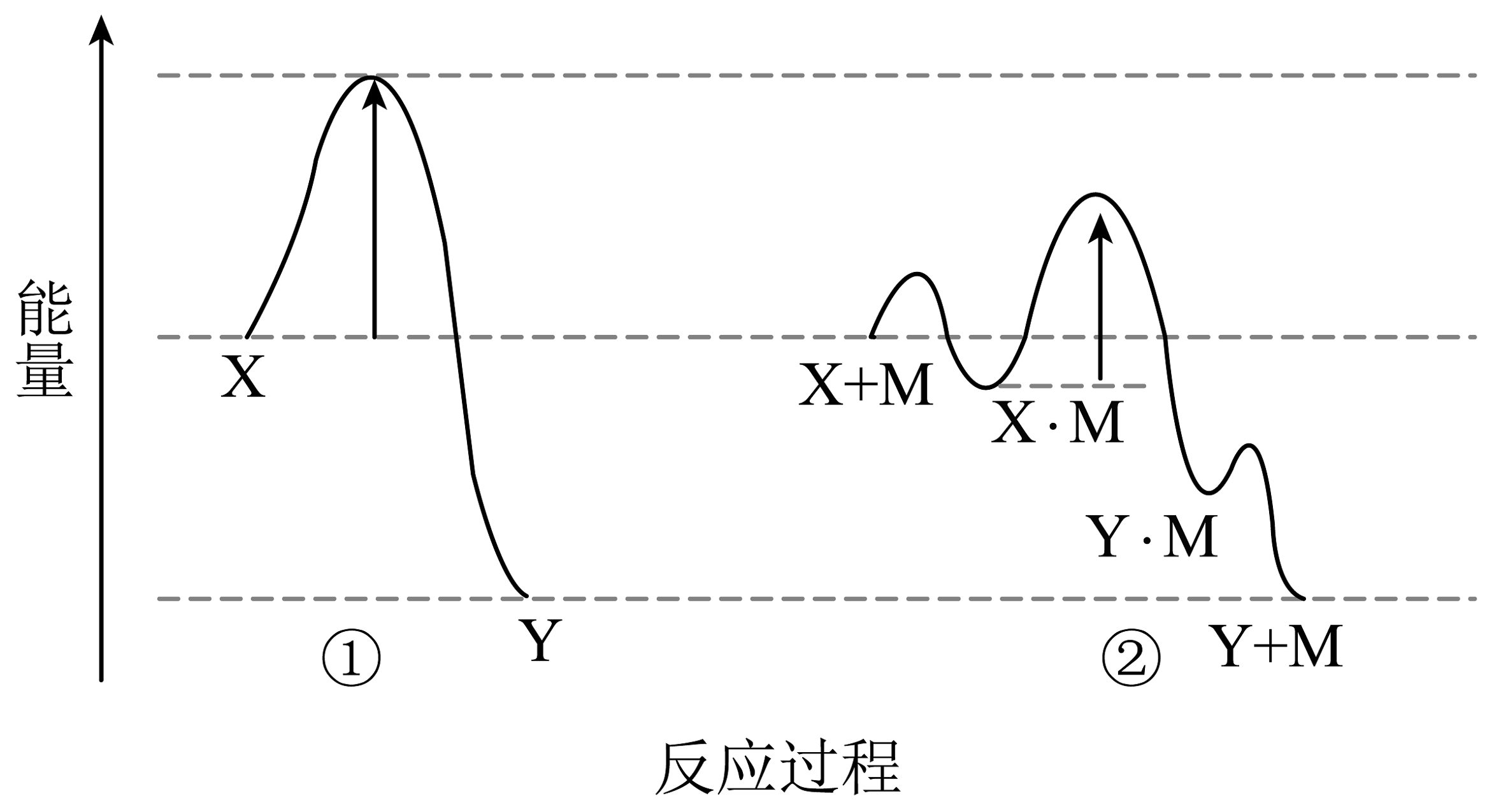 A、该反应是吸热反应 B、M为反应的中间产物 C、其他条件相同时,②的反应速率比①的更快 D、对于反应①,升高温度,Y的平衡产率将增大
A、该反应是吸热反应 B、M为反应的中间产物 C、其他条件相同时,②的反应速率比①的更快 D、对于反应①,升高温度,Y的平衡产率将增大 -
4、从炼钢粉尘(主要含和)中提取锌的流程如下:

“盐浸”过程转化为 , 并有少量和浸出。下列说法错误的是
A、“盐浸”过程若浸液下降,需补充 B、“滤渣”的主要成分为 C、“沉锌”过程发生反应 D、应合理控制用量,以便滤液循环使用 -
5、对物质进行合理分类有助于化学的学习。下列消毒剂的有效成分属于盐的是A、双氧水 B、高锰酸钾溶液 C、二氧化氯 D、医用酒精
-
6、设为阿伏加德罗常数的值。下列说法错误的是A、标准状况下,2.24 L 中所含σ键的数目为 B、14.2 g 和的混合物中所含的数目为 C、0.1 mol 与5.6 g Fe充分反应后,转移电子的数目为 D、高温下,18 g水蒸气与足量碳发生反应,所得混合气体中氢原子数目为
-
7、设为阿伏加德罗常数的值,下列说法正确的是A、溶液中,的数目为 B、与反应时生成的分子数为 C、25℃时,pH=1的乙酸溶液中,由乙酸电离出的氢离子数目为 D、标准状况下,2.24L由和组成的混合气体中含有的原子总数为
-
8、为阿伏加德罗常数的值。下列说法正确的是A、标准状况下,22.4 L NO和11.2 L 在密闭容器中混合,容器内气体分子数为 B、4.6 g乙醇和二甲醚()组成的混合物中,含有0.2个杂化的碳原子 C、在反应中,每生成3 mol 转移的电子数为6 D、标准状况下,11.2 L苯中含有6个键
-
9、NA为阿伏加德罗常数的值,下列说法正确的是A、25℃,101kPa下,22.4L氮气中的共用电子对数目为3NA B、2.0L1.0mol·L−1NH4Cl溶液中,NH的数目为2NA C、0.3mol葡萄糖完全燃烧,生成CO2的数目为1.8NA D、质量比为2:1的SO2和O2充分反应生成SO3小于2NA
-
10、已知反应: , 为阿伏加德罗常数的值,若消耗(标准状况) , 下列叙述错误的是A、转移的电子数为 B、生成的质量为 C、生成的氧化产物分子数为 D、生成的含有孤电子对数为
-
11、利用可将废水中的转化为对环境无害的物质后排放。反应原理为:(未配平)。下列说法正确的是A、X表示 B、可用替换 C、氧化剂与还原剂物质的量之比为 D、若生成标准状况下的气体 , 则反应转移的电子数为(表示阿伏加德罗常数的值)
-
12、在一个恒温、恒容的密闭容器中,有两个可左右自由滑动的密封隔板(a、b),将容器分成三部分,已知充入的三种气体的质量相等,当隔板静止时,容器内三种气体所占的体积如图所示。下列说法中错误的是
 A、分子数目: B、若Y是O2 , 则X可能是CH4 C、气体密度: D、X和Z分子中含有的原子数可能相等
A、分子数目: B、若Y是O2 , 则X可能是CH4 C、气体密度: D、X和Z分子中含有的原子数可能相等 -
13、下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大:
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A、①②③ B、②⑤⑥ C、②③⑥ D、④⑤⑥ -
14、向三个密闭容器中分别充入、、三种气体,下列有关这三种气体的叙述正确的是A、温度、压强相同时,三种气体的密度关系: B、温度、密度相同时,三种气体的压强关系: C、质量、温度、压强均相同时,三种气体的体积关系: D、温度、压强、体积均相同时,三种气体的质量关系:
-
15、下列说法正确的是
①标准状况下,6.02×1023个分子所占的体积约是22.4L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L/mol
⑥标准状况下,体积相同的气体的分子数相同
A、①②⑤ B、④⑥ C、③④⑥ D、①④⑥ -
16、下列说法正确的是A、任何气体的气体摩尔体积都约为22.4 L·mol-1 B、20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数 C、当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况 D、2 mol气体的体积约为44.8 L
-
17、为阿伏加德罗常数的数值。下列有关说法正确的是A、乙烯和环丙烷的混合物中,碳原子总数为 B、25℃,水溶液中的数目等于 C、标准状况下,所含有的分子数为 D、环戊烯(
 )中含有键的数目为
)中含有键的数目为
-
18、溴蒸气与氨气相遇产生“白烟”,化学方程式为 , 用表示阿伏加德罗常数的值,下列说法错误的是A、生成14g 时,反应中还原剂的分子数目为 B、标准状况下,11.2L 参与反应时转移的电子数为 C、的溶液中含有阳离子的数目总和大于 D、该反应中氧化剂和还原剂物质的量之比为
-
19、二氧化氯可用于自来水消毒。实验室用草酸和制取的反应为。设为阿伏加德罗常数的值。下列说法正确的是A、中含有的中子数为 B、每生成 , 转移电子数为 C、溶液中含有的数目为 D、标准状况下,中含键数目为
-
20、下列各物质所含原子数由多到少的顺序是( )
①0.2 molH2SO4 ②0.7 mol CH4 ③11.2 L(STP)CO2 ④9.03×1023个H2O ⑤4g He
A、①③②④⑤ B、②①④⑤③ C、②④①⑤③ D、④②③①⑤