相关试卷
-
1、我国科学家研究发明了电化学“大气固碳”方法,相关装置如图所示。下列说法正确的是
 A、放电时,电极A为负极,该电极可选用含水电解液 B、放电时,电极B上发生的反应是:3CO2+4e-+4Li+=2Li2CO3+C C、充电时,Li+从电极A移向电极B D、充电时,外电路中每通过1mol电子,正极区质量增加33g
A、放电时,电极A为负极,该电极可选用含水电解液 B、放电时,电极B上发生的反应是:3CO2+4e-+4Li+=2Li2CO3+C C、充电时,Li+从电极A移向电极B D、充电时,外电路中每通过1mol电子,正极区质量增加33g -
2、在2L恒容密闭容器中,充入2.0molNO和2.0molSO2 , 在一定条件下发生反应2NO(g)+2SO2(g)N2(g)+2SO3(g),测得平衡体系中NO、SO3的物质的量分数(x%)与温度的关系如图所示。下列说法正确的是
 A、该反应正反应的活化能大于逆反应的活化能 B、T1时,当2v正(SO2)=v逆(N2)时反应达到平衡状态 C、T2时,若反应经ts达到平衡,则v(N2)=mol•L-1•s-1 D、b点时,往容器中再充入NO、SO2各1.0mol,再次平衡时x%(N2)减小
A、该反应正反应的活化能大于逆反应的活化能 B、T1时,当2v正(SO2)=v逆(N2)时反应达到平衡状态 C、T2时,若反应经ts达到平衡,则v(N2)=mol•L-1•s-1 D、b点时,往容器中再充入NO、SO2各1.0mol,再次平衡时x%(N2)减小 -
3、室温下,用0.1mol•L-1的一水合二甲胺[(CH3)2NH•H2O]溶液(一水合二甲胺在水中的电离与一水合氨相似)滴定10.00mL0.1mol•L-1盐酸溶液。溶液pH随加入一水合二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
 A、本实验应该选择酚酞作指示剂 B、x>1,y<7 C、a、b两点的溶液中,Kw不相等 D、b点溶液中存在:2c(Cl-)=c[(CH3)2NH]+c[(CH3)2NH•H2O]
A、本实验应该选择酚酞作指示剂 B、x>1,y<7 C、a、b两点的溶液中,Kw不相等 D、b点溶液中存在:2c(Cl-)=c[(CH3)2NH]+c[(CH3)2NH•H2O] -
4、某种天然沸石的化学式为W[Z2R3Y10]•3X2Y,其中元素X、Y、Z、R、W原子序数依次增大,且占据四个不同周期。Y的基态原子p轨道的电子总数等于s轨道的电子总数,R的晶体是半导体芯片的核心材料,基态W原子的核外电子恰好填满10个原子轨道。下列说法正确的是A、第一电离能:Z<R B、简单离子半径:Y<Z C、最简单氢化物稳定性:Y<R D、X2Y中X-Y-X的键角>109°28'
-
5、下列实验目的对应的实验方案、现象和结论都正确的是
选项
实验目的
实验方案
现象和结论
A
探究金属钠在氧气中燃烧所得固体粉末的成分
取少量固体粉末,加入2~3mL蒸馏水
有气体生成,说明固体粉末为Na2O2
B
探究温度对化学平衡的影响
将装有NO2气体的密闭烧瓶放入热水浴中
气体颜色变深,说明升温使平衡向生成NO2的方向移动
C
探究BaSO4是否属于强电解质
向稀硫酸中滴加等浓度等体积的Ba(OH)2溶液,同时测定溶液电导率变化
电导率下降,说明BaSO4为弱电解质
D
探究菠菜中Fe元素的价态
将菠菜研磨后加入稀硝酸,过滤后取滤液加入KSCN溶液
溶液变为红色,说明菠菜中Fe元素为+3价
A、A B、B C、C D、D -
6、便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2);一种制备NaClO2粗产品的工艺流程如图。已知纯ClO2易分解爆炸,一般用空气稀释到10%以下。
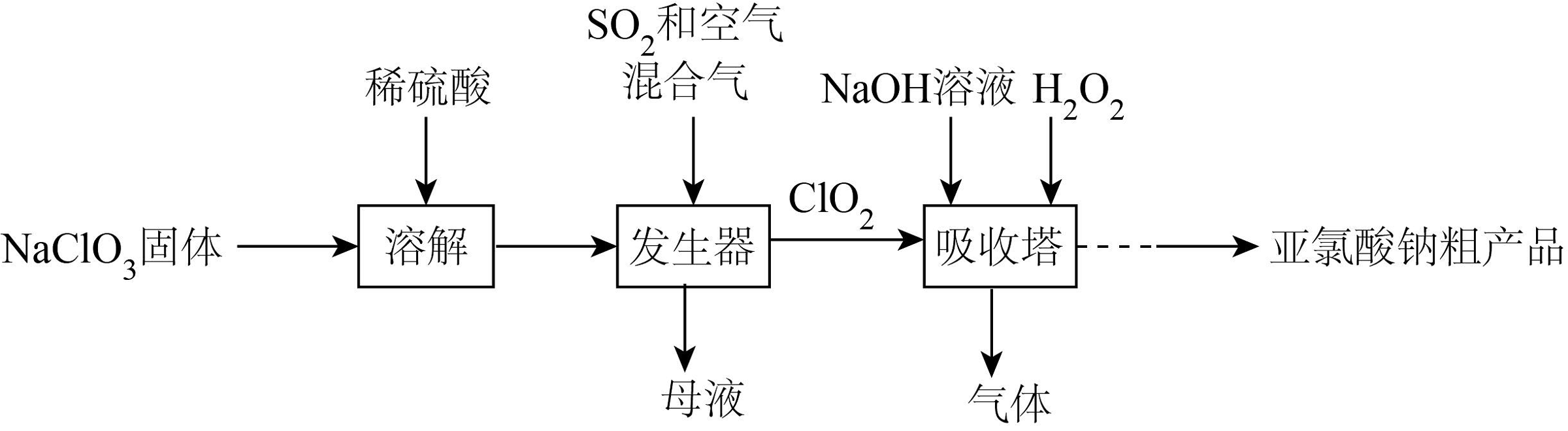
下列说法正确的是
A、溶解过程中可以用盐酸代替稀硫酸 B、流程中H2O2做氧化剂 C、发生器中鼓入空气的主要目的是提供氧化剂 D、吸收塔中温度不宜过高,否则会导致NaClO2产率下降 -
7、甲酸(HCOOH)可在纳米级Pd表面分解为活性H2和CO2 , 经下列历程实现NO的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法不正确的是
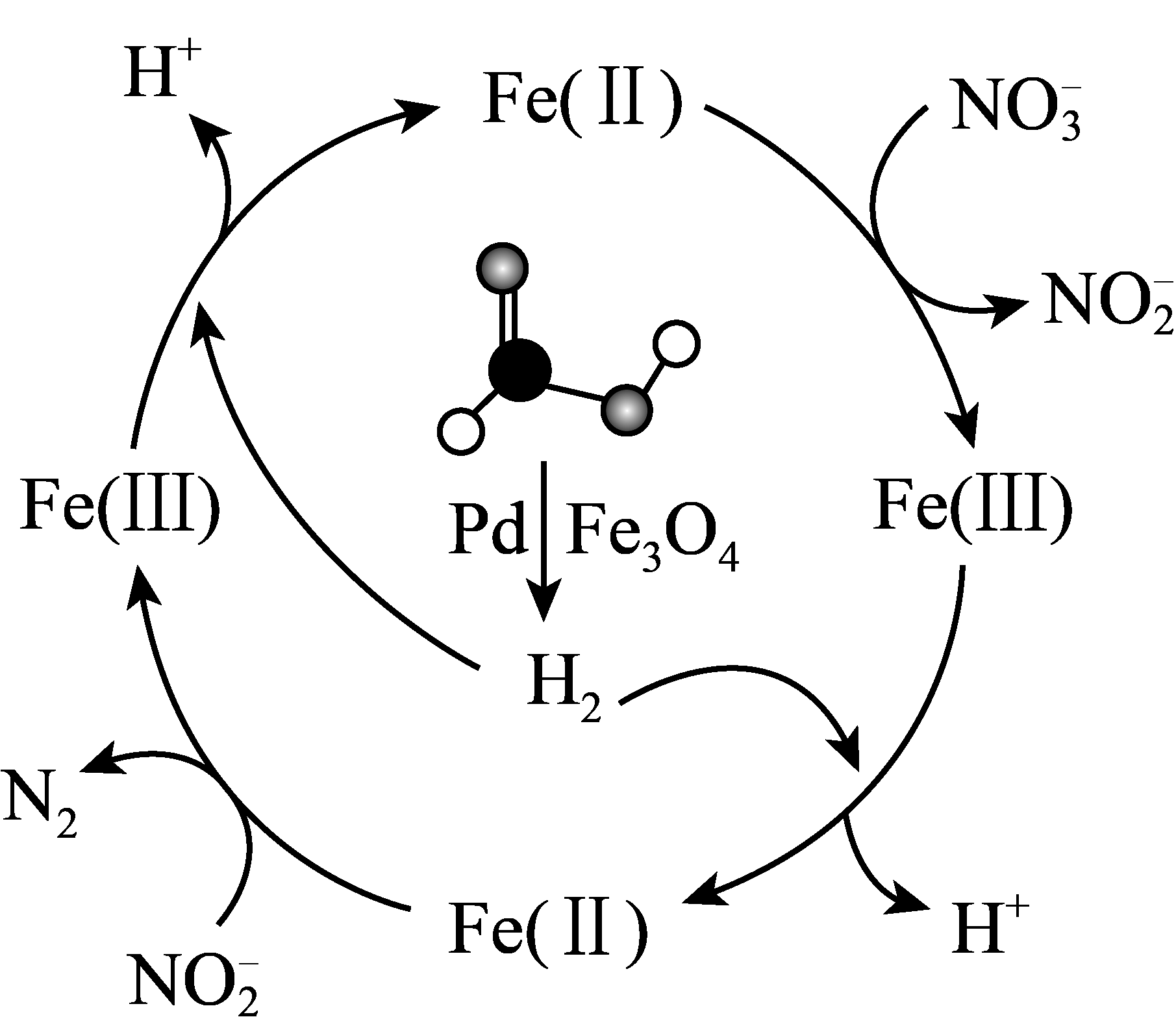 A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、在整个历程中,每1molH2可还原2molNO C、HCOOH分解时,只有极性共价键发生了断裂 D、反应历程中生成的H+可调节体系pH,有增强NO氧化性的作用
A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、在整个历程中,每1molH2可还原2molNO C、HCOOH分解时,只有极性共价键发生了断裂 D、反应历程中生成的H+可调节体系pH,有增强NO氧化性的作用 -
8、下列物质性质实验对应的化学反应的离子方程式书写正确的是A、Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+ B、大理石与醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ C、将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++218OH-+2OH-+O2↑ D、向Ba(OH)2溶液中加入过量NaHSO4溶液:Ba2++OH-+H++SO=BaSO4↓+H2O
-
9、某实验小组为制备并探究SO2的化学性质,下列装置中不能达到实验目的的是




A.制取SO2
B.验证SO2的还原性
C.验证SO2的漂白性
D.吸收尾气
A、A B、B C、C D、D -
10、“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用食醋清除水壶中的水垢
醋酸的酸性强于碳酸
B
制作豆腐的过程中煮沸豆浆
加热条件下,蛋白质可发生变性
C
制作面点时加入食用纯碱
NaHCO3能与发酵过程中产生的酸发生反应
D
清洗铁锅后及时擦干
减缓铁锅因发生吸氧腐蚀而生锈
A、A B、B C、C D、D -
11、海带中含有碘元素,从海带中提取碘的实验过程如图所示:

下列说法正确的是
A、海带中碘元素以I2形式存在 B、操作①可除去海带中的有机物 C、操作③为过滤,操作⑥为萃取 D、操作⑤用到的玻璃仪器有普通漏斗 -
12、绿色有机合成具有原子经济性高、充分利用资源、减少污染等特点。下列说法不正确的是
 A、化合物I分子中所有碳原子可能共平面 B、1mol化合物II最多能与4molH2发生加成反应 C、化合物I和III均能使酸性KMnO4溶液褪色 D、化合物III能与FeCl3溶液发生显色反应
A、化合物I分子中所有碳原子可能共平面 B、1mol化合物II最多能与4molH2发生加成反应 C、化合物I和III均能使酸性KMnO4溶液褪色 D、化合物III能与FeCl3溶液发生显色反应 -
13、安全无小事。下列操作不符合实验安全要求的是A、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗 B、实验中剩余的少量金属钠,可以放回原试剂瓶 C、闻气体时,用手在瓶口轻轻扇动,使少量气体飘进鼻孔 D、苯酚沾到皮肤上,立即用酒精擦洗后再用水冲洗
-
14、结构决定性质。下列性质差异与结构因素不匹配的是
选项
性质差异
结构因素
A
在CCl4中的溶解度:I2>ICl
分子极性
B
熔点:SiC(2830℃)>SiF4(-90℃)
晶体类型
C
沸点:对氨基苯甲醛>邻氨基苯甲醛
氢键类型
D
电离常数Ka:F3CCOOH>Cl3CCOOH
范德华力
A、A B、B C、C D、D -
15、化学推动着社会的进步和人类的发展。下列说法正确的是A、通过煤的干馏等物理变化可以获得多种化工原料 B、红外光谱可用于测定新型材料的相对分子质量 C、植物光合作用涉及氧化还原反应 D、光伏发电系统工作时将电能转化为化学能
-
16、文物是文化传承的重要载体。下列在深圳博物馆展出的文物中,主要材质为有机高分子的是



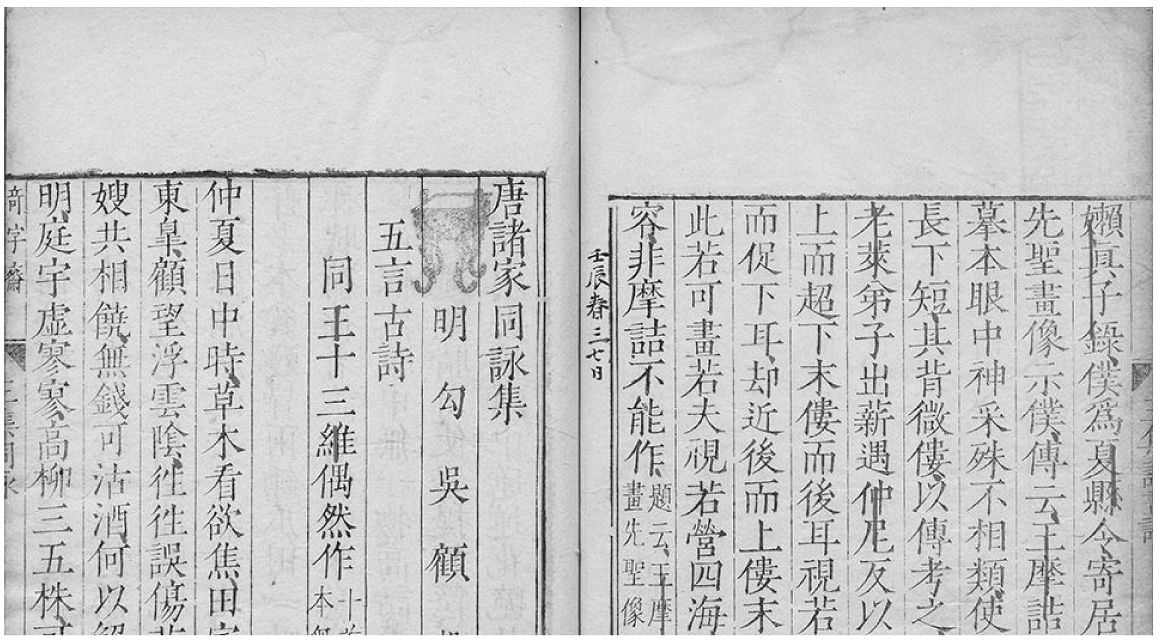
蟠螭纹铜编钟
彩绘仕女陶俑
龙首谷纹玉玦
唐王右丞诗集
A
B
C
D
A、A B、B C、C D、D -
17、含有冠醚环的聚合物膜能够高效吸附分离某些阳离子。一种含冠醚环的聚酰亚胺薄膜吸附分离Li+的过程如图。下列说法正确的是
 A、冠醚环与Li+之间的作用是离子键 B、冠醚环中碳氧键为π键 C、该聚酰亚胺薄膜可在强碱性环境中稳定工作 D、若要设计K+的吸附分离膜,需增大冠醚环孔径
A、冠醚环与Li+之间的作用是离子键 B、冠醚环中碳氧键为π键 C、该聚酰亚胺薄膜可在强碱性环境中稳定工作 D、若要设计K+的吸附分离膜,需增大冠醚环孔径 -
18、T℃时,恒容密闭容器中发生反应PCl3(g)+Cl2(g)PCl5(g) △H<0,下列说法正确的是A、该反应的△S<0,在高温下才能自发进行 B、反应物断键所需总能量大于生成物成键所放出总能量 C、增大反应物浓度能增加单位体积内的有效碰撞次数 D、平衡后,向该容器中充入氦气,平衡向正反应方向移动
-
19、一定条件下白磷和红磷可以相互转化,白磷转化为红磷的能量变化如图所示,下列说法错误的是
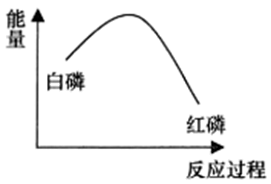 A、白磷转化为红磷是放热反应 B、红磷比白磷稳定性更高 C、等质量的红磷所含有的能量高于白磷 D、相同物质的量的白磷和红磷完全燃烧,白磷释放的热量多
A、白磷转化为红磷是放热反应 B、红磷比白磷稳定性更高 C、等质量的红磷所含有的能量高于白磷 D、相同物质的量的白磷和红磷完全燃烧,白磷释放的热量多 -
20、“能源”是人们生活中不可或缺的一部分,化学能与热能的相互转化是能量合理应用的重要途径。下列属于化学能与热能的转化过程的是
图片


转化过程
太阳能热水器烧水
燃油汽车行驶
选项
A
B
图片


转化过程
氯碱工业制氯气
水力发电
选项
C
D
A、A B、B C、C D、D