相关试卷
-
1、下列我国古代的技术应用中,其工作原理不涉及化学反应的是


A.转轮排字
B.可燃冰作为能源


C.火药使用
D.铁的冶炼
A、A B、B C、C D、D -
2、
Ⅰ.阅读下面两段文字:
A.2019年1月3日,嫦娥四号探测器成功着陆在月球背面,嫦娥四号探测器主体部分使用钛合金①等新材料,太空舱中利用铁酸镍()②和其他物质转化呼出的二氧化碳③等废气。
B.2019年3月10日,我国长征三号乙运载火箭在西昌卫星发射中心成功发射。长征三号乙运载火箭的一子级上部是装有液氧④和四氧化二氮()⑤的氧化剂箱,下部是装有汽油⑥的燃料箱。
(1)上述短文标有序号的物质中,属于混合物的是(填序号,下同),属于单质的是 , 属于氧化物的是 , 主要成分属于有机物的是 , 属于盐的是。II.现有甲、乙、丙三名同学分别进行胶体的制备实验。
甲同学:向溶液中加入少量NaOH溶液。
乙同学:向25mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至液体呈红褐色,停止加热。
丙同学:直接加热饱和溶液。
试回答下列问题:
(2)上述操作中,(填序号)同学的能成功制得胶体。A.甲 B.乙 C.丙
(3)利用胶体的这一性质,可验证有胶体生成且操作最简便。写出生成胶体反应的化学方程式:。(4)可用如图所示的装置除去胶体中的杂质离子来提纯胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入稀硝酸酸化的溶液,若(填实验现象),则说明该胶体中的杂质离子已经完全除去。
-
3、宏观辨识与微观探析相结合是化学特有的认识物质的方法。NaCl溶于水的过程如图所示。下列说法正确的是
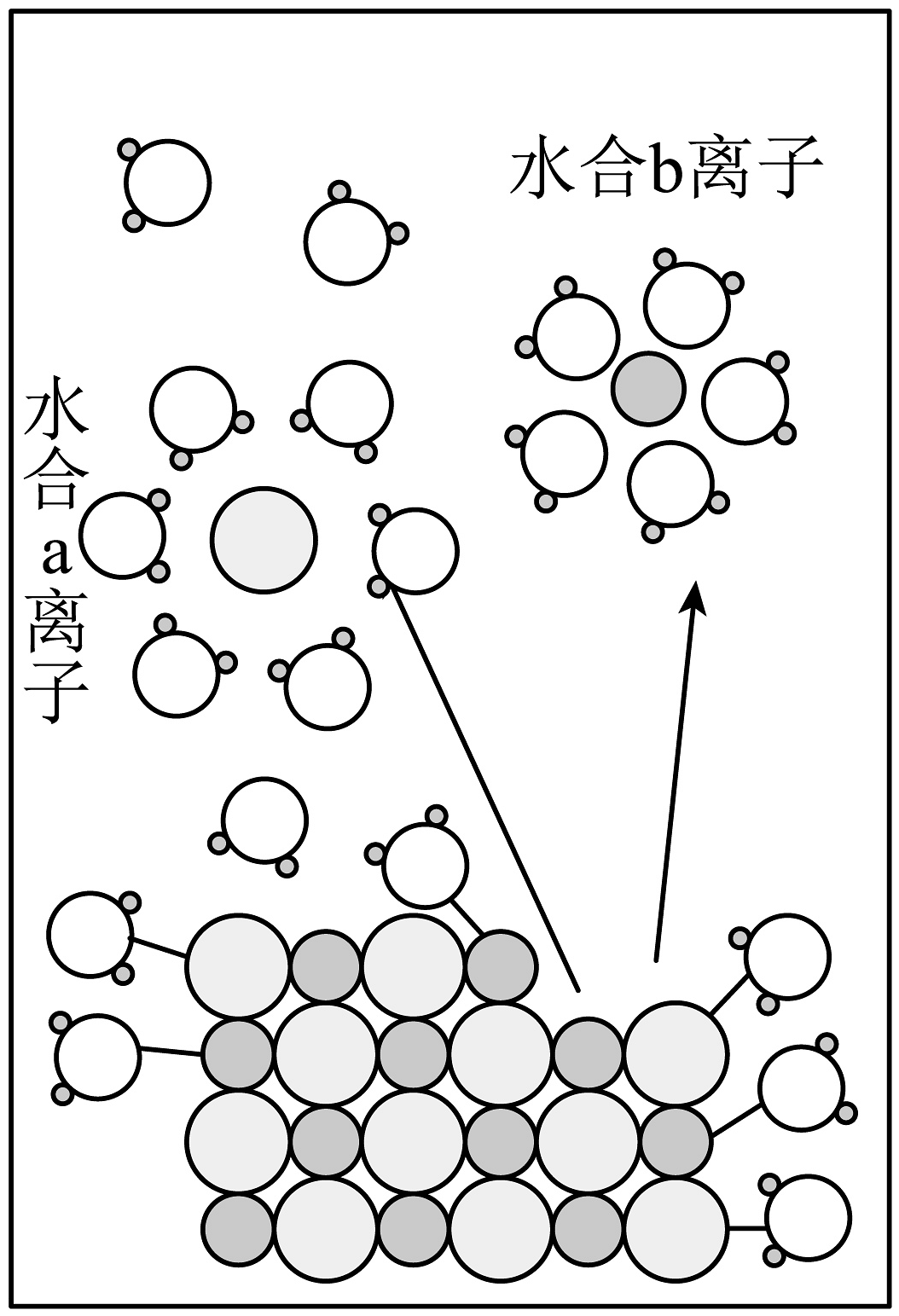 A、图中水合b离子为水合氯离子 B、NaCl溶液导电时,水合钠离子移向与电源负极相连的电极 C、固体NaCl溶于水前不能导电是因为无Na+和Cl- D、NaCl溶于水的电离过程为:NaClNa++Cl-
A、图中水合b离子为水合氯离子 B、NaCl溶液导电时,水合钠离子移向与电源负极相连的电极 C、固体NaCl溶于水前不能导电是因为无Na+和Cl- D、NaCl溶于水的电离过程为:NaClNa++Cl- -
4、化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 , 进一步处理得到产品和 , 实验流程如图:

回答下列问题:
(1)、从A~E中选择合适的仪器制备 , 正确的连接顺序是(按气流方向,用小写字母表示)。 (2)、B中使用雾化装置的优点是。(3)、生成的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体和滤液:
(2)、B中使用雾化装置的优点是。(3)、生成的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体和滤液:①对固体充分加热,产生的气体先通过足量浓硫酸,再通过足量 , 增重 , 则固体的质量为g。
②市场上销售的“苏打水"是一种非常受欢迎的饮用水,其溶质是小苏打。苏打水会因储藏温度过高而分解产生少量使口感发涩,写出一种除去中改善口感的方法(用离子方程式表示)。
③固体保存不当,会发生变质部分转化为 , 下列不能测定变质后的混合物中的质量分数的是。
a.取混合物与足量溶液充分反应,得到溶液
b.取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到固体
c.取混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加
d.取混合物与足量溶液充分反应,过滤、洗涤、烘干,得固体
-
5、现有一定量含有杂质的试样,用下图的实验装置测定试样的纯度。(可供选用的反应物只有固体、盐酸、稀硫酸和蒸馏水)
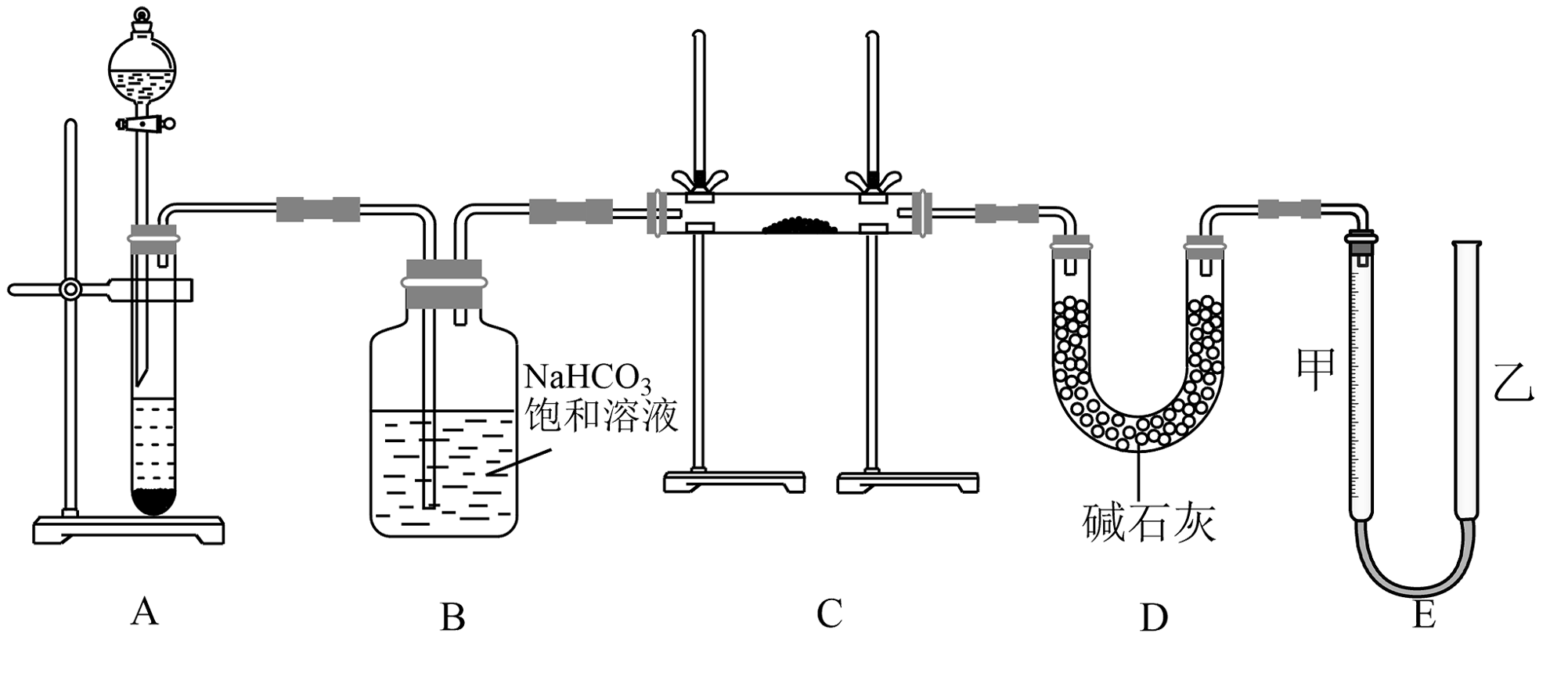
回答下列问题:
(1)、装置A中发生反应的离子方程式。(2)、装置D中碱石灰的作用是。(3)、若开始时测得样品的质量为 , 反应结束后测得气体体积为 , 该条件下此气体密度为。则试样的纯度为。(4)、为了较准确地用E装置测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数求其差值的过程中还应注意___________。A、读数时视线与凹液面最低处保持水平 B、反应结束即可立刻读数,以免氧气溶解到水中影响实验结果 C、实验开始和结束时都应上下移动乙管,使甲、乙两管液面相平再读数 D、实验结束读数时若甲管中液面高于乙管时,所测气体体积偏小(5)、a克下列物质在氧气中充分燃烧后的气体(、120℃)通过足量的充分反应后增重b克,符合的选项有___________。A、 B、 C、 D、 -
6、如图所示物质之间的转化,已知:A是金属单质,且焰色试验为黄色,X为常见温室气体。按要求回答下列问题:
 (1)、D的化学式:。(2)、A→B的离子方程式:。(3)、下列说法正确的是___________。A、氢氧化钙溶液和氯化钙溶液均可鉴别D、E两种溶液 B、若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D C、少量的A放置于敞口容器中最终可变成物质D D、将A投入到E的溶液中,也会有D生成(4)、D和E的固体混合物加热到质量不再变化时,剩余物质的质量为 , 则混合物中D的质量分数为(计算结果精确到0.1)。(5)、设计实验检验B中的阳离子。
(1)、D的化学式:。(2)、A→B的离子方程式:。(3)、下列说法正确的是___________。A、氢氧化钙溶液和氯化钙溶液均可鉴别D、E两种溶液 B、若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D C、少量的A放置于敞口容器中最终可变成物质D D、将A投入到E的溶液中,也会有D生成(4)、D和E的固体混合物加热到质量不再变化时,剩余物质的质量为 , 则混合物中D的质量分数为(计算结果精确到0.1)。(5)、设计实验检验B中的阳离子。 -
7、按要求回答下列问题:(1)、某届奥运会期间,工作人员将“84”消毒液(有效成分为“”)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是与反应产生促进藻类快速生长。该反应说明氧化性:(填“>”或“<”);当参加反应的和两物质的个数比为时,该反应的还原产物为(填字母序号)。
A. B. C. D. E.
(2)、饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为 , 其化学方程式为:。①用双线桥法表示反应中电子转移的方向和数目:。
②该反应中氧化剂和还原剂的个数之比:。
③若除去废液中(不考虑废液中其它物质与反应),则消耗的需要g。
-
8、现有以下物质:①铜 ②液态 ③熔融的烧碱 ④固体 ⑤胶体 ⑥粉末 ⑦ ⑧汽油 ⑨冰醋酸 ⑩(1)、以上物质中属于混合物的是;能导电的电解质是(填序号)。(2)、写出⑥溶于水的电离方程式。(3)、写出将④⑥混合溶于水后发生反应的离子方程式。(4)、往盛有氢氧化钠浓溶液的烧杯中逐滴滴加醋酸溶液,溶液的导电能力随滴入醋酸的体积变化曲线为___________(填字母)。A、
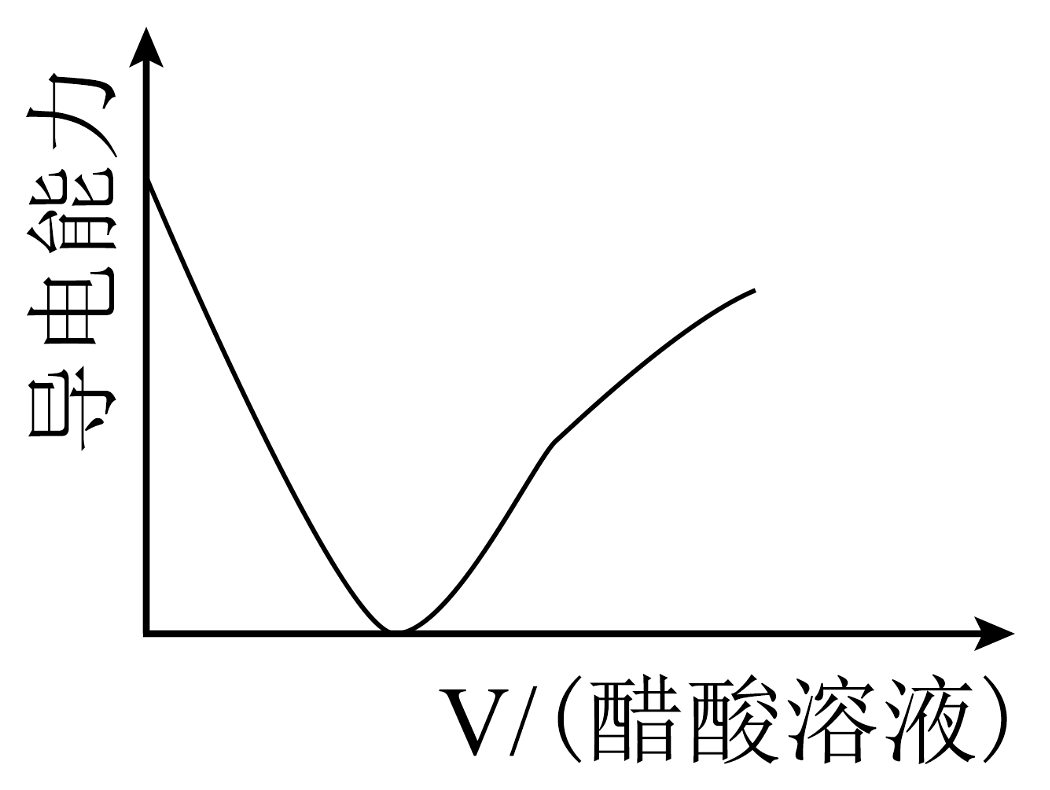 B、
B、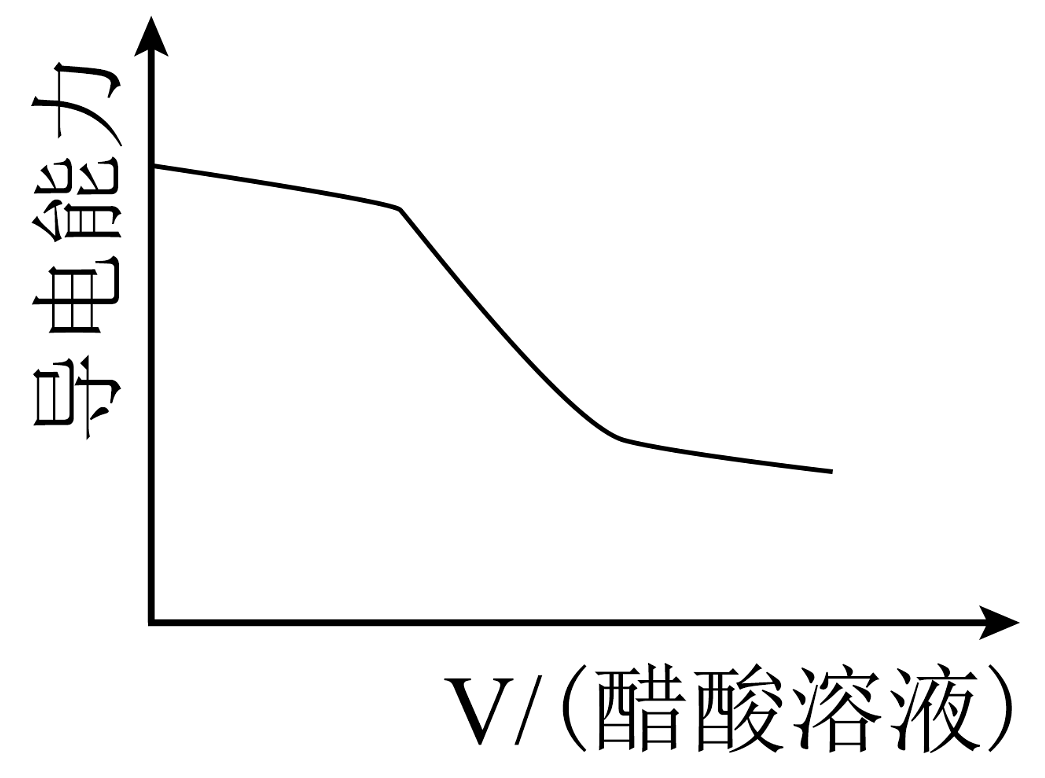 C、
C、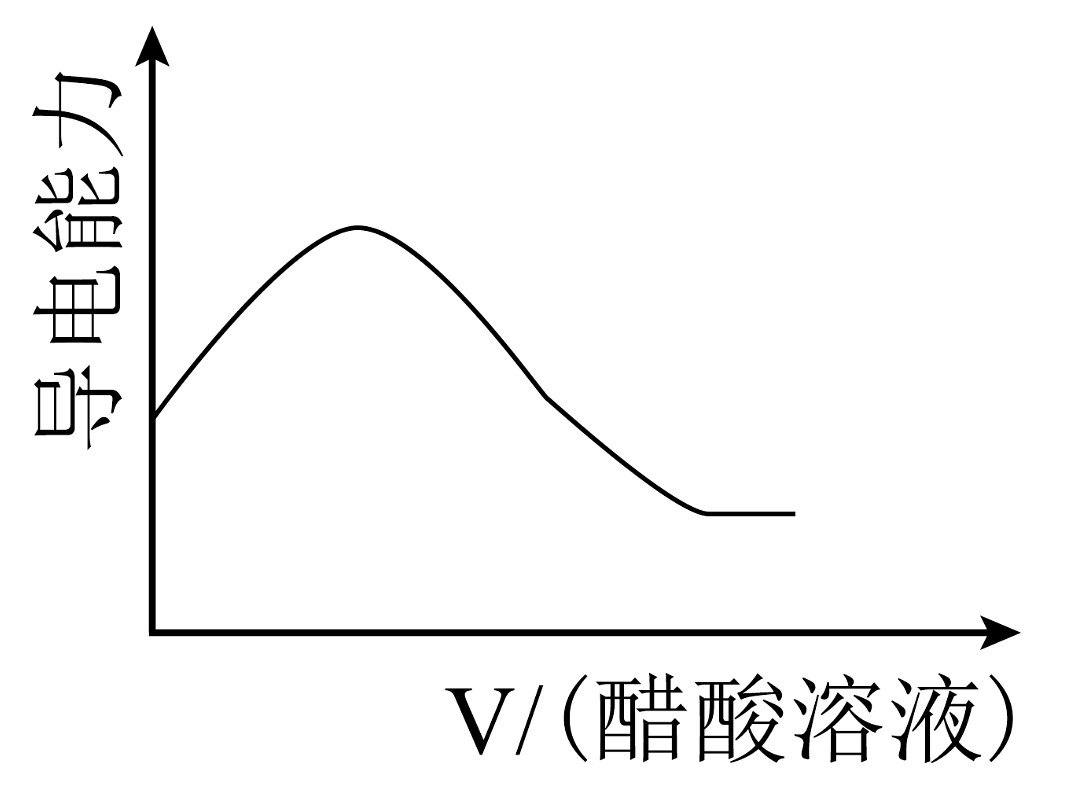 D、
D、
-
9、根据下列实验操作和现象得出的结论或解释正确的是
选项
实验操作和现象
结论或解释
A
向饱和的碳酸钠溶液中通入足量的 , 产生白色沉淀
相同温度下溶解度:碳酸钠>碳酸氢钠
B
向久置的粉末中加入过量稀硫酸,产生了无色气体
全部变质为
C
取钠与氧气反应所得的少量固体,加入蒸馏水,产生气体
固体为
D
用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液一定是钠盐溶液
A、A B、B C、C D、D -
10、一种用氢气制备双氧水的反应原理如图所示,已知在化合物中钯()均以价形式存在,下列有关说法正确的是
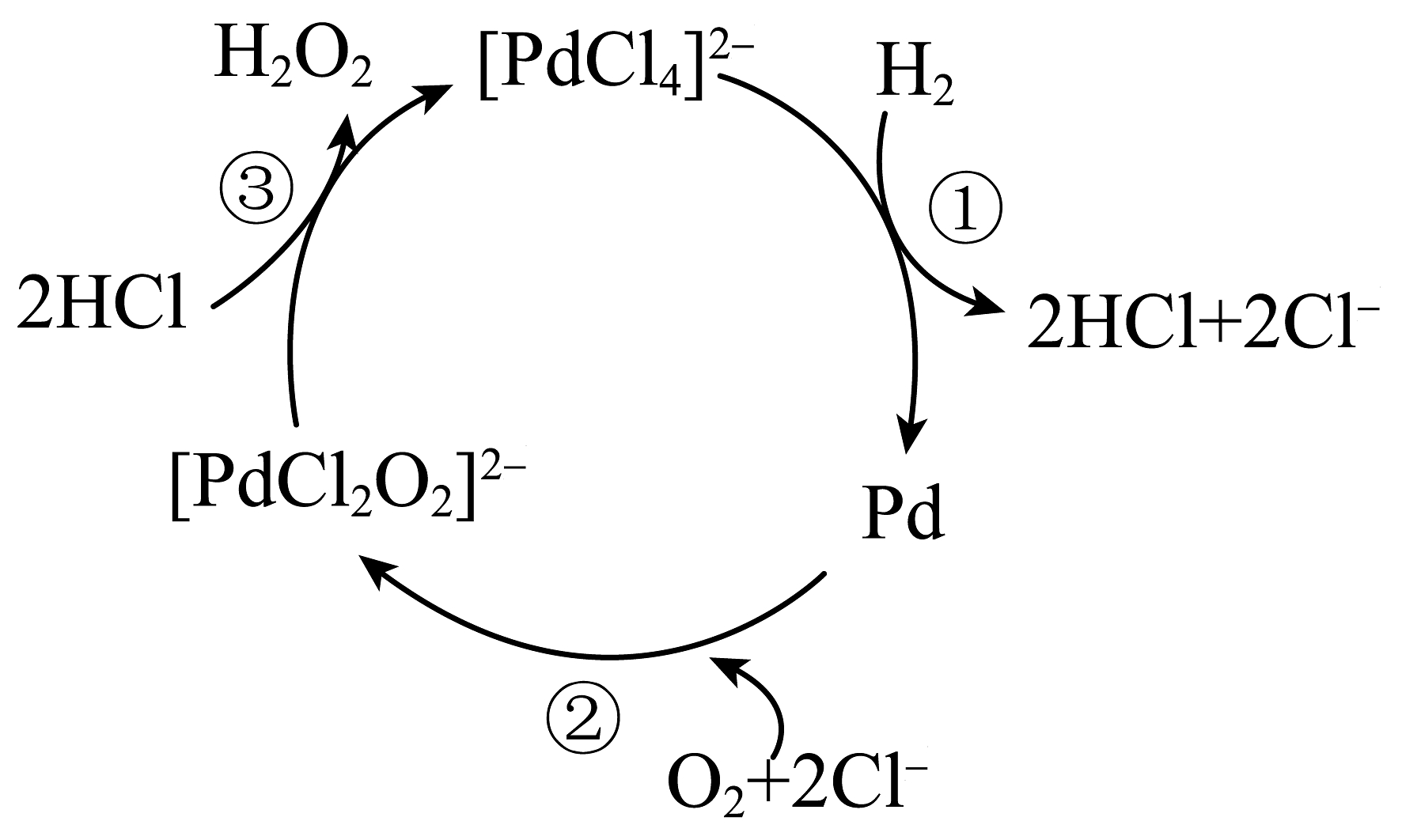 A、反应①②③均为氧化还原反应 B、反应①中为还原产物 C、反应②中每产生1个 , 转移2个电子 D、和均为该反应的催化剂
A、反应①②③均为氧化还原反应 B、反应①中为还原产物 C、反应②中每产生1个 , 转移2个电子 D、和均为该反应的催化剂 -
11、学习化学不是靠一味背诵的,要学会运用合适的方法如“类推”,这样才能事半功倍。下列类推不正确的是A、已知CO2通入Ca(OH)2溶液中溶液变浑浊,CO2通入Ba(OH)2溶液中溶液也会变浑浊 B、已知CO2能与CaO反应生成CaCO3 , CO2也能与BaO反应生成BaCO3 C、已知Na在O2中燃烧生成Na2O2 , 类推Fe在O2中燃烧产物类似 D、已知Na2CO3溶液能与Ca(OH)2溶液反应生成CaCO3沉淀和NaOH,Na2CO3溶液也能与Ba(OH)2溶液反应生成BaCO3沉淀和NaOH
-
12、在酸性溶液中与发生反应,反应产物为、、。已知反应中氧化剂与还原剂的个数之比为 , 则x的值为A、1 B、2 C、3 D、4
-
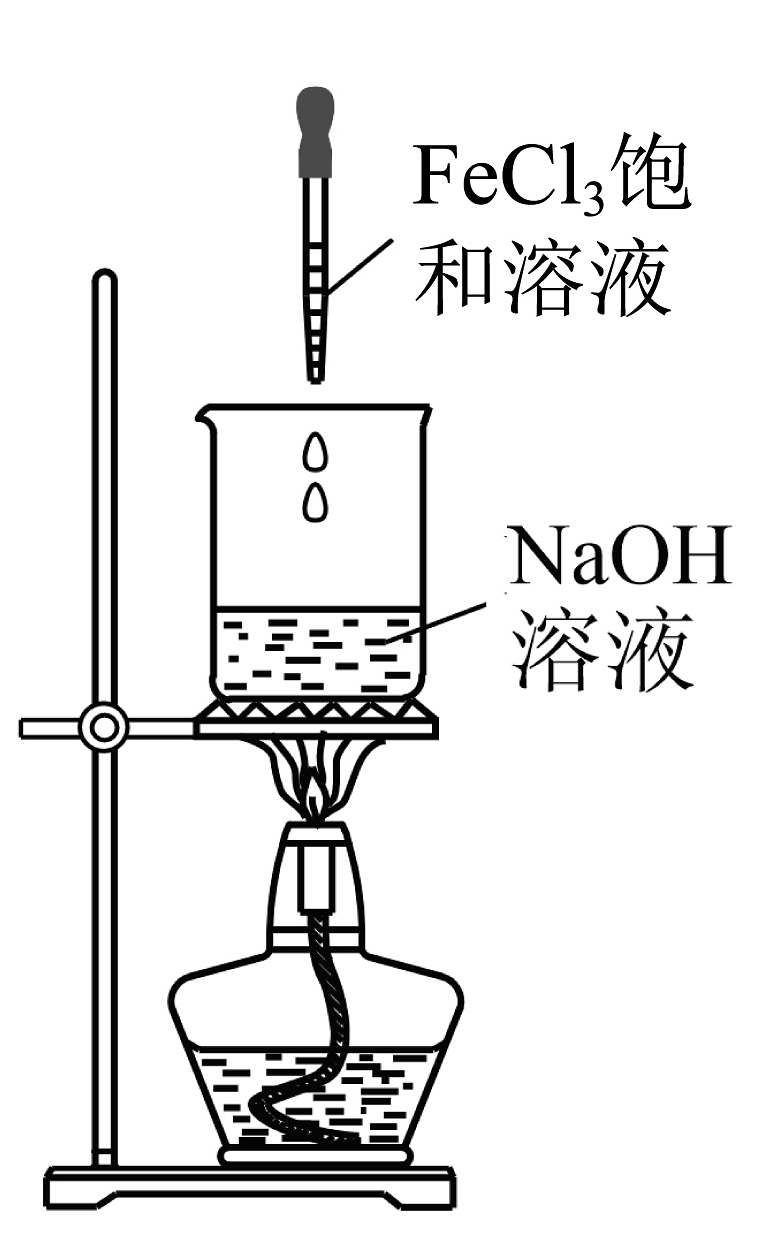
13、下列实验过程能达到实验目的的是
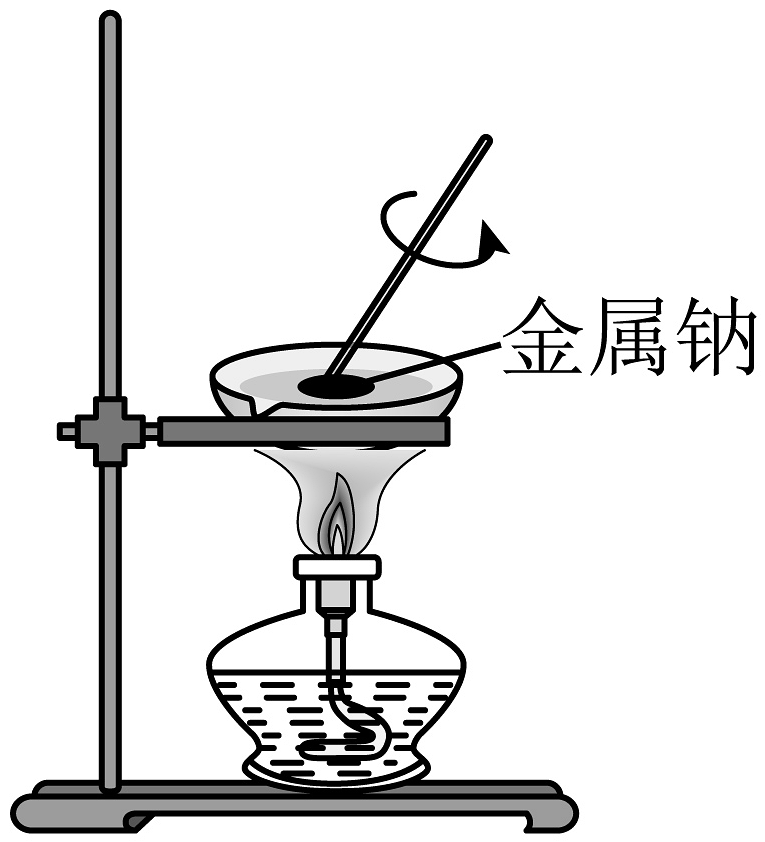
A.钠的燃烧实验
B.制备胶体
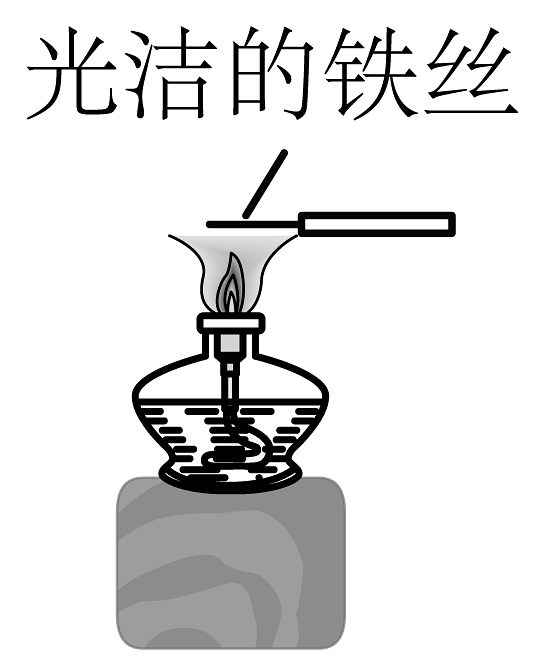
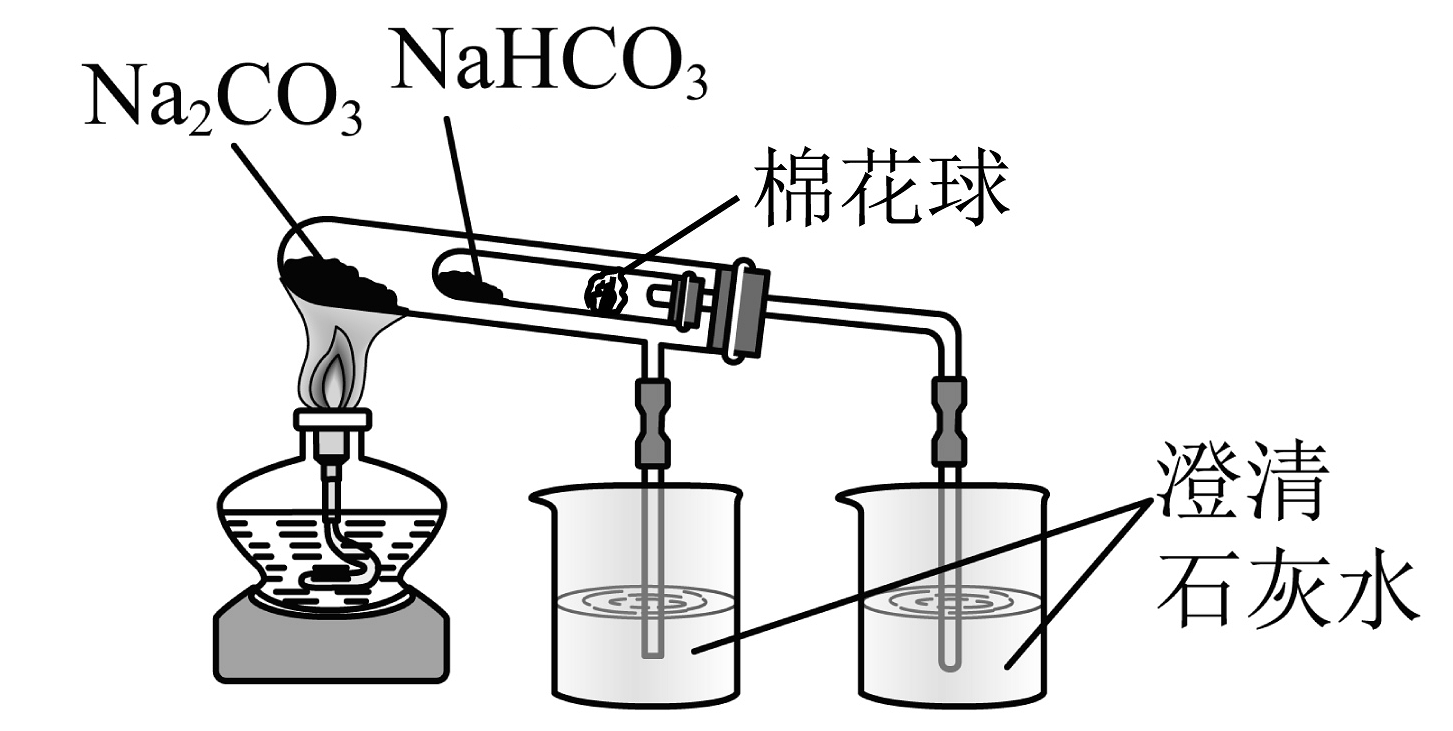
C.观察的焰色试验
D.验证纯碱和小苏打的热稳定性
A、A B、B C、C D、D -
14、硫酸银常用作分析试剂,测定水中化学耗氧量时用作催化剂,具有较好的热稳定性。高温下,硫酸银分解生成三种气体:。下列关于该反应的说法不正确的是A、该反应既是分解反应又是氧化还原反应 B、氧化产物与还原产物的个数之比为 C、每生成1分子 , 转移电子的个数为4 D、将生成的气体通入水中,溶液呈酸性
-
15、在澄清透明的溶液中能大量共存的离子组是A、 B、 C、 D、
-
16、下列离子方程式书写正确的是A、用氢氧化铝治疗胃酸(的盐酸)过多: B、溶液和稀硫酸反应: C、用氢氧化钠溶液吸收少量: D、少量澄清石灰水中滴加足量溶液:
-
17、下列物质在给定条件下的转化均能实现的是A、 B、溶液 C、 D、溶液
-
18、下列反应中,过氧化氢()只作氧化剂的是A、 B、 C、 D、
-
19、下列转化中,需要加入还原剂才能实现的是A、 B、 C、 D、
-
20、下列关于钠及其化合物性质的叙述,不正确的是A、碳酸钠溶于少量水放热,碳酸氢钠溶于少量水吸热 B、过氧化钠呈淡黄色,故可用作呼吸面具的供氧剂 C、等质量的碳酸钠和碳酸氢钠与足量盐酸反应,碳酸氢钠放出的气体量多 D、碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱