相关试卷
-
1、已知:
 。设为阿伏加德罗常数的值,下列说法正确的是 A、中含有的中子数为 B、溶液中含有的数为 C、1mol
。设为阿伏加德罗常数的值,下列说法正确的是 A、中含有的中子数为 B、溶液中含有的数为 C、1mol 分子中含有的键数为
D、1molNa与足量
分子中含有的键数为
D、1molNa与足量 反应,转移电子数为
反应,转移电子数为
-
2、儿茶酸具有抗菌、抗氧化作用,常用于治疗烧伤、小儿肺炎等疾病,可采用如图所示路线合成。下列说法正确的是
 A、X分子中所有原子不可能共平面 B、Y的分子式为 C、不可用浓溴水鉴别X和Z D、1molZ可与发生加成反应
A、X分子中所有原子不可能共平面 B、Y的分子式为 C、不可用浓溴水鉴别X和Z D、1molZ可与发生加成反应 -
3、短周期主族元素X、Y、Z、W的原子序数依次增大;X是地壳中含量最高的元素;Y的氧化物X是光导纤维的主要成分;基态W原子的电子总数是其最高能级电子数的4倍。下列说法错误的是A、第一电离能:Z>W>Y B、简单离子还原性:Z>W>X C、原子半径:Y>W>X D、最高价含氧酸的酸性:Y>Z>W
-
4、某学习小组用醋酸钠固体和浓硫酸共热快速制备醋酸,配制高纯度醋酸溶液,并测定中和热。下列实验操作正确的是


A.醋酸钠固体和浓硫酸共热制醋酸
B.配制一定物质的量浓度的醋酸溶液


C.用NaOH标准溶液滴定未知浓度的醋酸溶液
D.测定醋酸与NaOH反应的中和热
A、A B、B C、C D、D -
5、物质结构决定其性质。下列有关物质结构和性质的描述中,错误的是A、水结成冰密度减小与水分子之间能形成氢键有关 B、利用冠醚识别碱金属离子的特性分离、传递特定离子 C、杂化轨道中s轨道所占百分率: D、氟的电负性大于氯的电负性,使三氟乙酸的酸性小于三氯乙酸的酸性
-
6、实验室制备少量氮气的反应为。下列与该反应有关的化学用语表述错误的是A、基态N原子的价层电子的轨道表示式为
 B、的电子式为
B、的电子式为 C、NaCl的形成过程可表示为
C、NaCl的形成过程可表示为 D、的VSEPR模型为
D、的VSEPR模型为
-
7、碳元素在生产生活及新物质的制备中均具有非常重要的作用。下列关于碳及其化合物的叙述错误的是A、酿制米酒需要添加酒曲作催化剂 B、推广使用新能源汽车可有效减少碳排放 C、我国自主研发的某飞机机身材料使用的碳纤维和环氧树脂属于无机非金属材料 D、横州出土的“鸟纹变形羽人纹铜鼓”表面的铜绿主要成分是碱式碳酸铜
-
8、对于A2+3B2
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( ) A、v(B2)=0.8mol/(L·s) B、v(A2)=0.4mol/(L·s) C、v(C)=0.6mol/(L·s) D、v(B2)=4.2mol/(L·min)
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( ) A、v(B2)=0.8mol/(L·s) B、v(A2)=0.4mol/(L·s) C、v(C)=0.6mol/(L·s) D、v(B2)=4.2mol/(L·min) -
9、一定条件下的密闭容器中: , 平衡时测得A的浓度为0.50 mol/L。保持温度不变,将容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30 mol/L。下列说法正确的是A、 B、平衡向正反应方向移动 C、B的浓度增大 D、C的体积分数减小
-
10、化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是A、将肉类食品进行低温冷藏,能使其永远不会腐败变质 B、在化学工业中,选用催化剂一定能提高反应物的转化率 C、夏天面粉的发酵速率与冬天面粉的发酵速率相差不大 D、茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
-
11、化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:(1)、煤气化过程如下:
反应1:
反应2:
反应3:
①。
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为;使用催化剂,(填“能”或“不能”)改变a的值。
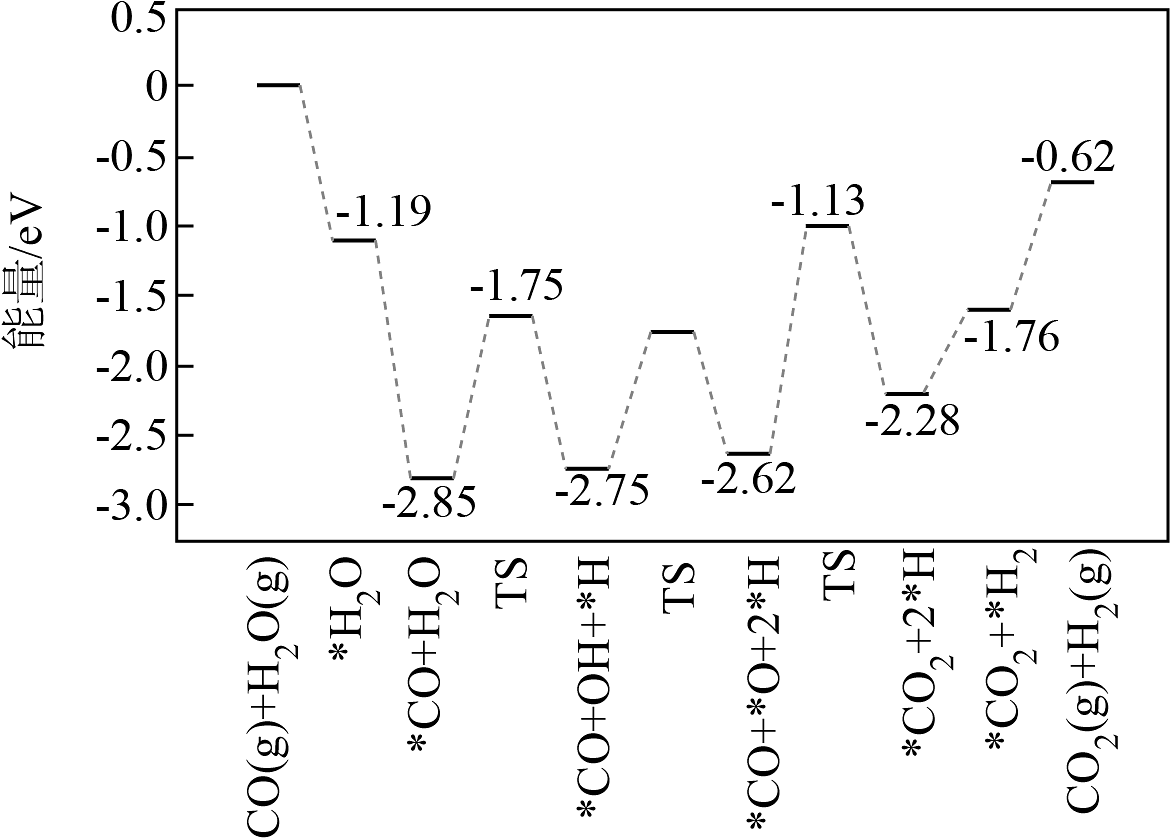 (2)、在一定温度下,向某恒容容器中充入和 , 仅发生反应: 。
(2)、在一定温度下,向某恒容容器中充入和 , 仅发生反应: 。下列情况表明反应已达到平衡状态的是___________(填标号)。
A、的体积分数保持不变 B、混合气体的平均摩尔质量保持不变 C、的转化率保持不变 D、与的物质的量之比不再改变(3)、向2L的恒容密闭容器中充入 , 发生反应: 。其他条件不变时,的平衡转化率随着温度(T)的变化如图所示。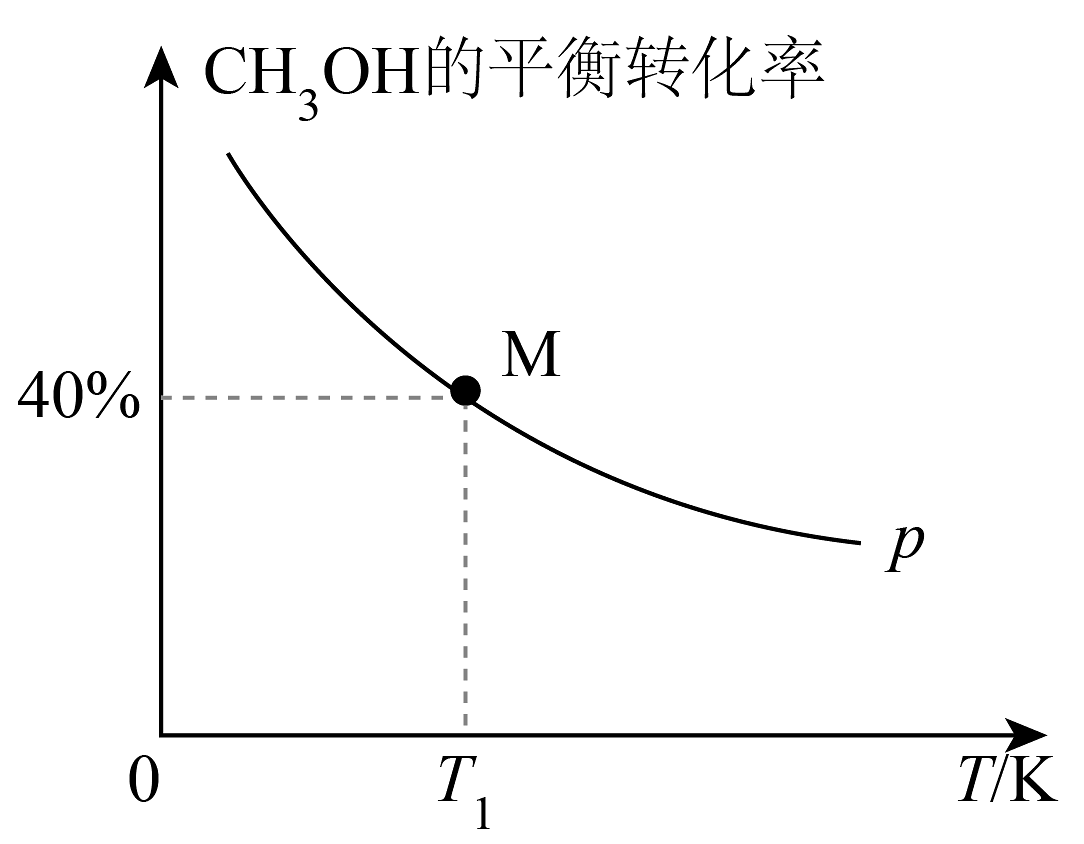
①欲提高的平衡转化率且加快反应速率,下列措施可能有效的是(填标号)。
a.降低温度并及时分离出产物 b.加入合适的催化剂并分离出产物
c.再向容器中充入 d.适当降低温度并加入合适的催化剂
②时,初始压强 , 反应经过20min达到平衡,用表示该段时间内的平均速率为 , 该温度下的平衡常数(用精确到小数点后两位);该温度下,改变投料,某时刻容器内、、 , 则此时(填“>”、“<”或“=”)。
-
12、过量与以下的溶液反应,下列总反应方程式错误的是
溶液
现象
化学方程式
A
产生淡黄色沉淀
B
溶液由棕黄色变浅绿色
C
溶液褪色,产生白色沉淀
D
(含酚酞)
溶液由红色变无色
A、A B、B C、C D、D -
13、已知反应过程a、b如下图所示,下列说法正确的是
 A、E1表示反应过程a的活化能 B、 C、加入催化剂的反应过程为a D、反应过程b的有效碰撞次数小于a
A、E1表示反应过程a的活化能 B、 C、加入催化剂的反应过程为a D、反应过程b的有效碰撞次数小于a -
14、在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是A、CO分子数比CO2分子数少 B、甲容器的体积比乙容器的体积小 C、CO的摩尔体积比CO2的摩尔体积小 D、甲中CO的密度比乙中CO2的密度小
-
15、我国的歼-20战机使用了大量的钛金属,是生产钛的重要中间原料,某小组利用如图所示装置在实验室制备并收集(夹持装置略去)。

已知:①中元素为+4价。
②瓷舟中物质反应后除生成外,同时还生成一种有毒氧化物气体。
③相关物质的部分物理性质如表:
熔点/℃
沸点/℃
水溶性
TiCl4
-23.2
136.4
TiCl4高温时能与O2反应,极易与水反应;能溶于CCl4等有机溶剂
FeCl3
306
315
易与水反应
④的盐酸溶液可吸收而生成黑色颗粒。
回答下列问题:
(1)、该小组利用图(1)所示装置制备。
盛放浓盐酸的仪器名称为 , 圆底烧瓶内所装试剂可为(填编号)。
a. b. c.浓
(2)、将管式炉加热至时,瓷舟中主要发生的化学反应方程式为。(3)、装置单元如图(2)所示,A、B、C中盛装的液体可从下列选项中选择,其正确排序为。
A.的盐酸溶液 B.饱和食盐水 C.溶液 D.浓硫酸
(4)、实验过程中需要先后通入两次,第二次通入作用是。(5)、控温箱的温度在 , 目的是。(6)、以为载体,用和水蒸气反应生成 , 再控制温度可生成纳米。实验室可采用如下方法测定纳米组成:步骤一:取样品纳米 , 用稀硫酸充分溶解得到 , 再用足量单质将还原为 , 过滤并洗涤,将所得滤液和洗涤液合并注入容量瓶,定容得到待测液。
步骤二:取待测液于烧杯中,用图(3)所示装置进行测定(图中电压计的示数与溶液中有关)。向烧杯中逐滴滴入溶液,被氧化为。

①确定与恰好反应的现象为。
②滴入溶液时恰好被反应完全。该样品的组成为。
-
16、在催化剂的作用下,利用合成气(主要成分为和)合成甲醇时涉及了如下反应:
I.
II.
III.
(1)、反应I在(填“高温”、“低温”或“任意温度”)下可自发进行。(2)、若向恒容密闭容器中按初始进料比投入反应物,只发生反应I和II。在不同温度下达到平衡,体系中的选择性和的平衡转化率与温度的关系如图(1)所示。
(已知:的选择性)
回答下列问题:
①某温度下,下列能说明反应II已达平衡状态的是(填序号)。
A.气体的平均摩尔质量不变
B.混合气体密度不再改变
C.体系中和的浓度比不变
D.容器内压强不再改变
②图中表示选择性变化的曲线是(填“a”或“b”)。
③当 , 平衡时的体积分数(答案保留两位有效数字),计算该温度下反应I的(用平衡分压代替平衡浓度,分压=总压各组分的物质的量分数,答案保留两位有效数字)。
④经测定,当温度高于的平衡转化率会升高,其可能的原因为。
(3)、某实验小组依据甲醇燃烧的反应原理,设计如图(2)所示的电池装置,写出该燃料电池负极的电极反应式:。
-
17、某实验小组欲通过测定酸性和(草酸)溶液在单位时间内生成的体积,来探究影响化学反应速率的因素,实验装置如图甲所示:
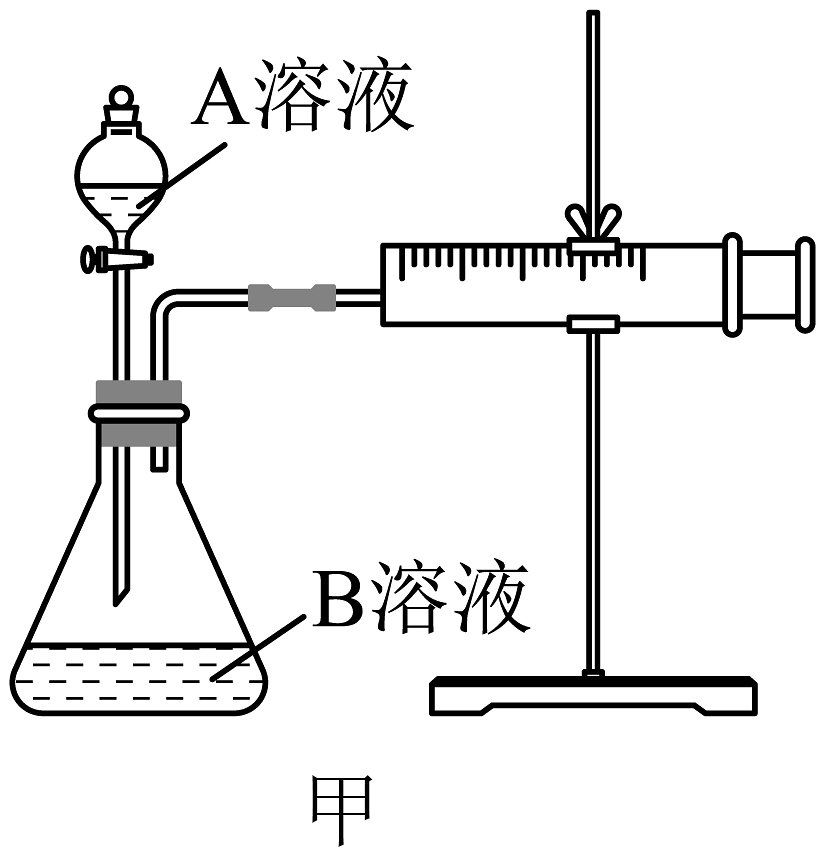
实验序号
A溶液
B溶液
①
溶液
溶液
②
溶液
溶液
回答下列问题:
(1)、检查装置甲气密性的方法。(2)、装置甲中发生反应的离子方程式为:。(3)、该实验探究的是因素对化学反应速率的影响。(4)、小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是: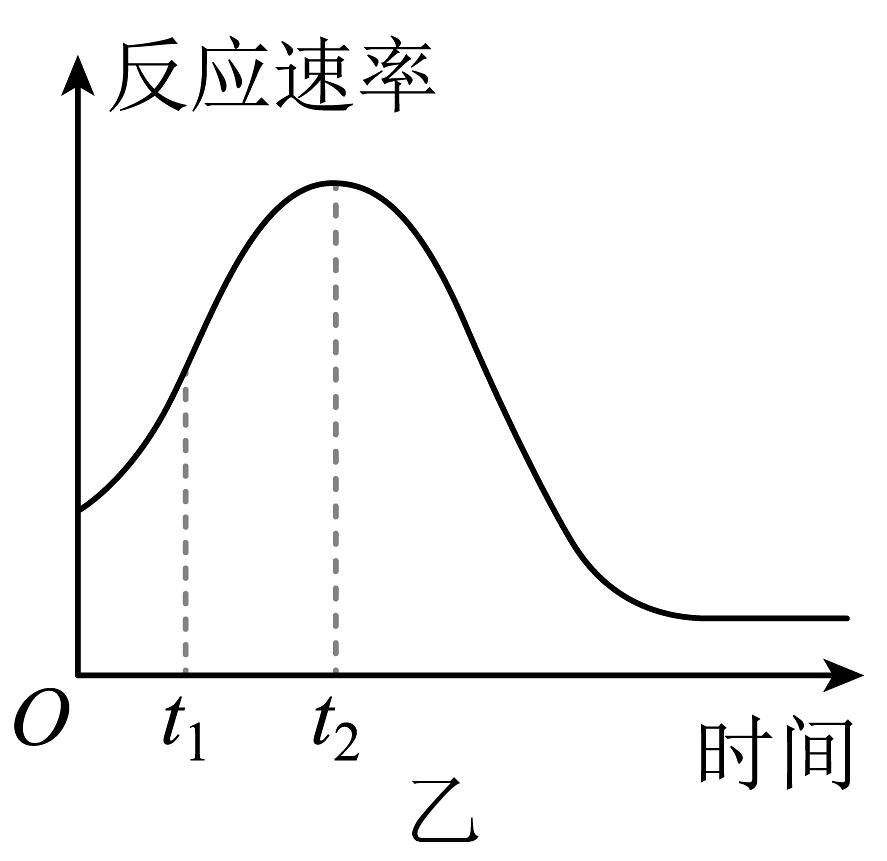
①产物是反应的催化剂;②。
-
18、氨气的性质非常广泛,以下是氨气的部分转化:
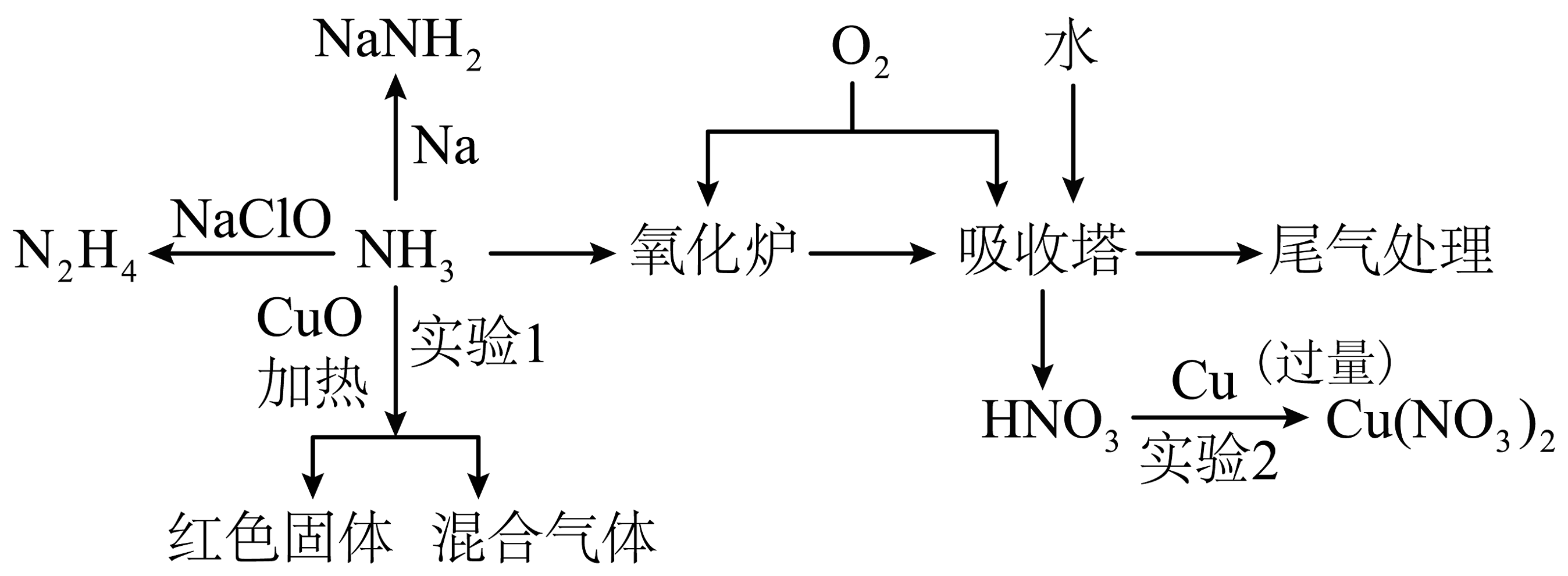
已知:肼又称联氨,还原性强于氨气。
(1)、请写出的电子式。(2)、N2H4可看成二元弱碱,请写出N2H4与足量硫酸生成酸式盐的化学式:。(3)、下列说法不正确的是。A.将投入液氨中制备
B.氨气存在分子间氢键,所以沸点高,是良好的制冷剂
C.为了提高的产量,需加入过量的
D.在氧化炉中直接生成 , 被水吸收后转化为硝酸
E.向实验2结束后的溶液中继续加入稀硫酸,可以观察到又有气泡产生
(4)、若实验2中产生的与体积比为3:1,请写出气体被溶液完全吸收的离子方程式:。(5)、已知实验1的混合气体中含有一种单质。设计用一种试剂(含试纸)验证反应后混合气体中比较活泼的两种气体的方案:。 -
19、下列装置可用于粗略测量物质的燃烧热。25℃时,将9克葡萄糖()放入该装置中充分燃烧,放出的热量能使燃烧室外5kg的水中温度计读数最高至31.7℃,已知水的比热容为。
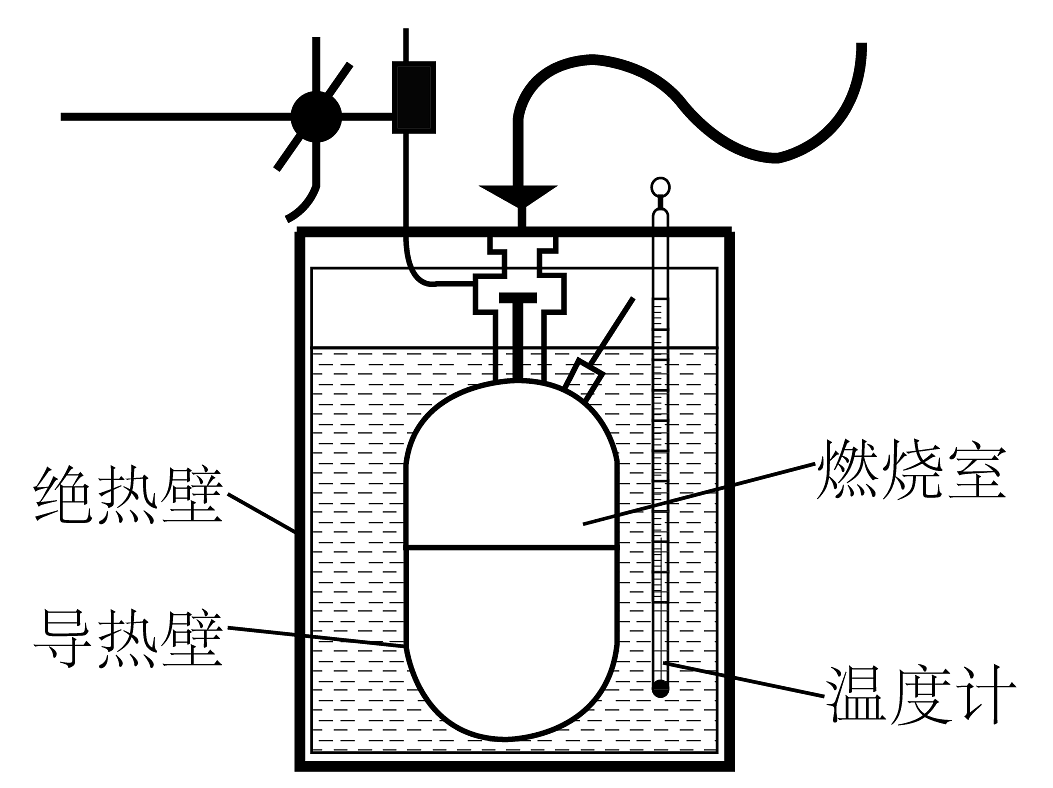 (1)、反应放出的热量Q=kJ(结果取整数)。(2)、写出葡萄糖燃烧热的热化学方程式。
(1)、反应放出的热量Q=kJ(结果取整数)。(2)、写出葡萄糖燃烧热的热化学方程式。 -
20、根据下列实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
实验结论
A
向含0.1molFeI2溶液中通入0.1molCl2 , 再滴加2滴淀粉溶液
溶液变蓝
还原性:Fe2+<I-
B
等体积等物质的量浓度的Na2S2O3与H2SO4溶液在不同温度下反应
温度高的溶液中先出现乳白色浑浊
升高温度,反应速率加快
C
向某固体中加入过量的盐酸,再滴加KSCN溶液
溶液未出现红色
该固体中不含+3价Fe元素
D
将红热的木炭放入浓硝酸中
产生红棕色气体
浓硝酸与碳在加热条件下生成NO2
A、A B、 C、 D、D