相关试卷
-
1、下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
用双氧水滴定KI-淀粉溶液
溶液变蓝
达到滴定终点
B
用湿润的淀粉碘化钾试纸鉴别、溴蒸气
试纸变蓝
该气体为溴蒸气
C
向食用加碘盐中加入食醋和KI溶液,再加入振荡,静置
下层呈紫红色
该食用加碘盐中含有
D

最后试管有浅黄色沉淀
有机物中含有溴原子
A、A B、B C、C D、D -
2、“宏观辨识与微观探析”是化学学科素养之一。下列离子方程式表示正确的是A、向苛性钠溶液中通入少量SO2:SO2+2OH-=SO+H2O B、向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++S2-=CuS↓ C、氯气通入蒸馏水中:Cl2+H2O=Cl-+ClO-+H2O D、氧化铁粉末溶于足量氢碘酸:Fe2O3+6H+=2Fe3++3H2O
-
3、下列实验操作或装置(略去部分夹持仪器)正确的是
 A、实验室制氧气 B、除去中的HCl气体 C、检查装置的气密性 D、碳酸氢钠受热分解
A、实验室制氧气 B、除去中的HCl气体 C、检查装置的气密性 D、碳酸氢钠受热分解 -
4、下列与化学有关的文献或诗文,理解正确的是A、《问刘十九》中写道:“绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 B、“独忆飞絮鹅毛下,非复青丝马尾垂”中的“飞絮”和棉花的化学成分不同 C、《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质,而使殊颜异色得以尚焉……”文中的“麻”“裘”在一定条件下都可以水解生成小分子 D、《傅鹑觚集·太子少傅箴》中记载:“故近朱者赤,近墨者黑。”这里的“朱”指的是朱砂,古代常用的一种红色颜料,其主要成分为Fe2O3
-
5、NaClO2是一种重要的杀菌消毒剂,其一种生产工艺如图,下列说法不正确的是
 A、“反应”步骤中生成ClO2的化学方程式:H2SO4+SO2+2NaClO3=2ClO2+2NaHSO4 B、“电解”所用食盐水由粗盐水精制而成,精制时,为除去杂质SO和Ca2+ , 需要加入适当过量的除杂试剂,添加顺序为为BaCl2、Na2CO3 C、吸收反应NaOH+H2O2+ClO2NaClO2+O2+H2O中,氧化产物是O2 , 氧化剂与还原剂的物质的量之比为1:2 D、270gClO2与过量的NaOH、H2O2完全反应,计算生成的NaClO2的物质的量为4mol
A、“反应”步骤中生成ClO2的化学方程式:H2SO4+SO2+2NaClO3=2ClO2+2NaHSO4 B、“电解”所用食盐水由粗盐水精制而成,精制时,为除去杂质SO和Ca2+ , 需要加入适当过量的除杂试剂,添加顺序为为BaCl2、Na2CO3 C、吸收反应NaOH+H2O2+ClO2NaClO2+O2+H2O中,氧化产物是O2 , 氧化剂与还原剂的物质的量之比为1:2 D、270gClO2与过量的NaOH、H2O2完全反应,计算生成的NaClO2的物质的量为4mol -
6、实验室中利用侯氏制碱法制备Na2CO3和NH4Cl,流程如图。下列说法正确的是
 A、气体N、M分别为和 B、只有“食盐水”可以循环使用 C、为了加速过滤可用玻璃棒搅拌 D、向“母液”中通入NH3有利于析出NH4Cl并提高纯度
A、气体N、M分别为和 B、只有“食盐水”可以循环使用 C、为了加速过滤可用玻璃棒搅拌 D、向“母液”中通入NH3有利于析出NH4Cl并提高纯度 -
7、利用生物基原料合成高分子化合物具有广阔的发展前景。一种利用生物基原料iv合成高分子化合物vⅲ的路线如图所示:
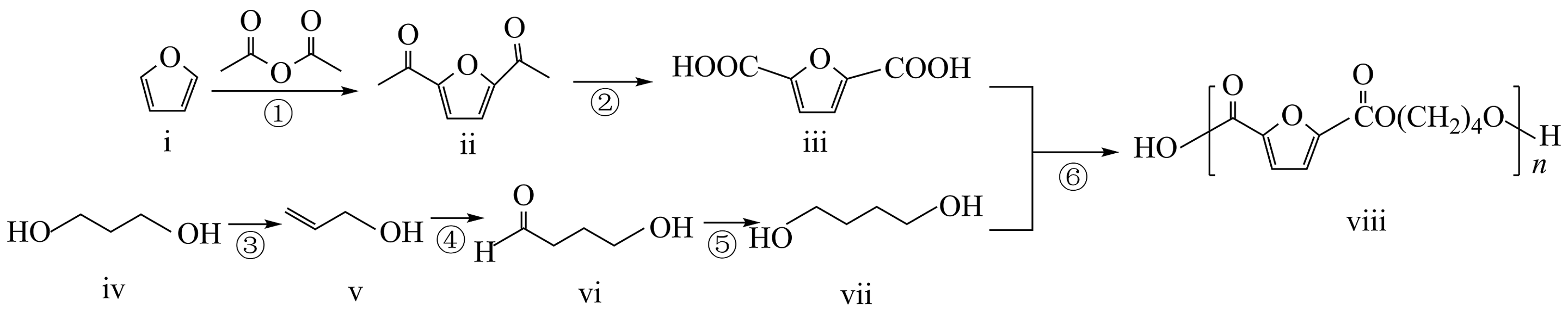 (1)、化合物ii的分子式为 , 化合物iv的名称。(2)、芳香化合物W是化合物ii的同分异构体。W能与碳酸氢钠反应,其核磁共振氢谱显示有四种不同化学环境的氢,且峰面积之比为 , 写出一种符合条件的W的结构简式。(3)、反应④可表示为 , 其中M、N为两种常见的气体,则M、N的化学式分别为、。(4)、根据化合物ⅵ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物ii的分子式为 , 化合物iv的名称。(2)、芳香化合物W是化合物ii的同分异构体。W能与碳酸氢钠反应,其核磁共振氢谱显示有四种不同化学环境的氢,且峰面积之比为 , 写出一种符合条件的W的结构简式。(3)、反应④可表示为 , 其中M、N为两种常见的气体,则M、N的化学式分别为、。(4)、根据化合物ⅵ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新官能团名称
反应类型
a
酯基
取代反应
b
酸性高锰酸钾溶液
(5)、下列关于反应⑥的说法中正确的有___________(填字母)。A、另外一种产物分子的空间结构为V形 B、反应过程中,有双键和单键的形成 C、化合物ⅲ中碳原子均为即杂化,化合物ⅶ中碳原子均为杂化 D、化合物出中存在手性碳原子(6)、以乙烯为有机含碳原料,利用上述流程中反应④的原理,合成化合物 基于你设计的合成路线,回答下列问题:
基于你设计的合成路线,回答下列问题:(a)利用反应④的原理得到的产物的结构简式为。
(b)相关步骤涉及卤代烃的水解反应,其化学方程式为(注明反应的条件)。
-
8、钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含等物质,从中分离提取钒铬的工艺流程如下:

回答下列问题:
(1)、基态钒的电子排布简式为。(2)、“焙烧”时会生成和 , 写出中的化合价。(3)、“酸浸”时为提高浸取速率,可采取的措施有、。(任写两条)。滤渣2的主要成分是和 , 则滤渣1的主要成分为。(4)、“还原”时可用双氧水代替溶液作还原剂,此时溶液中的发生反应的离子方程为。(5)、工业上可用电解还原法处理含的酸性废水。用铁板作阳极,电解过程中废水逐渐上升,都以氢氧化物沉淀析出,达到废水净化的目的。其中阳极的电极反应式为。(6)、某含铬化合物立方晶胞如图所示。
与钙原子最近且等距离的氧原子有个;钙和氧的最近距离为为阿伏加德罗常数的数值,则该晶体密度为(用含a,的代数式表示)。
-
9、下表所示为元素周期表的前四周期部分,代表不同元素。根据图示结合所学知识回答下列问题:
 (1)、中,某元素的电离能情况如图所示,则该元素的价层电子轨道表示式为。
(1)、中,某元素的电离能情况如图所示,则该元素的价层电子轨道表示式为。 (2)、j元素位于周期表第四周期第族,属于区。(3)、X区域元素中基态原子轨道电子数为1的元素符号为。(4)、b、c、d、e四种元素的第一电离能大小顺序为 (用元素符号表示)。(5)、a、c、i形成的既有离子键又有共价键的化合物的电子式为 , 其阳离子的VSEPR模型为。(6)、元素e、i、k形成的最简单氢化物的沸点由高到低的顺序为(填化学式),原因。
(2)、j元素位于周期表第四周期第族,属于区。(3)、X区域元素中基态原子轨道电子数为1的元素符号为。(4)、b、c、d、e四种元素的第一电离能大小顺序为 (用元素符号表示)。(5)、a、c、i形成的既有离子键又有共价键的化合物的电子式为 , 其阳离子的VSEPR模型为。(6)、元素e、i、k形成的最简单氢化物的沸点由高到低的顺序为(填化学式),原因。 -
10、
苯甲酸异戊酯常温下为无色透明油状液体、无毒,是一种可食用的安全香料,也可用作有机溶剂。现以异戊醇(
 )和苯甲酸为原料,浓硫酸作催化剂制备苯甲酸异戊酯,实验装置如图1(分水器可分离生成的水)
)和苯甲酸为原料,浓硫酸作催化剂制备苯甲酸异戊酯,实验装置如图1(分水器可分离生成的水)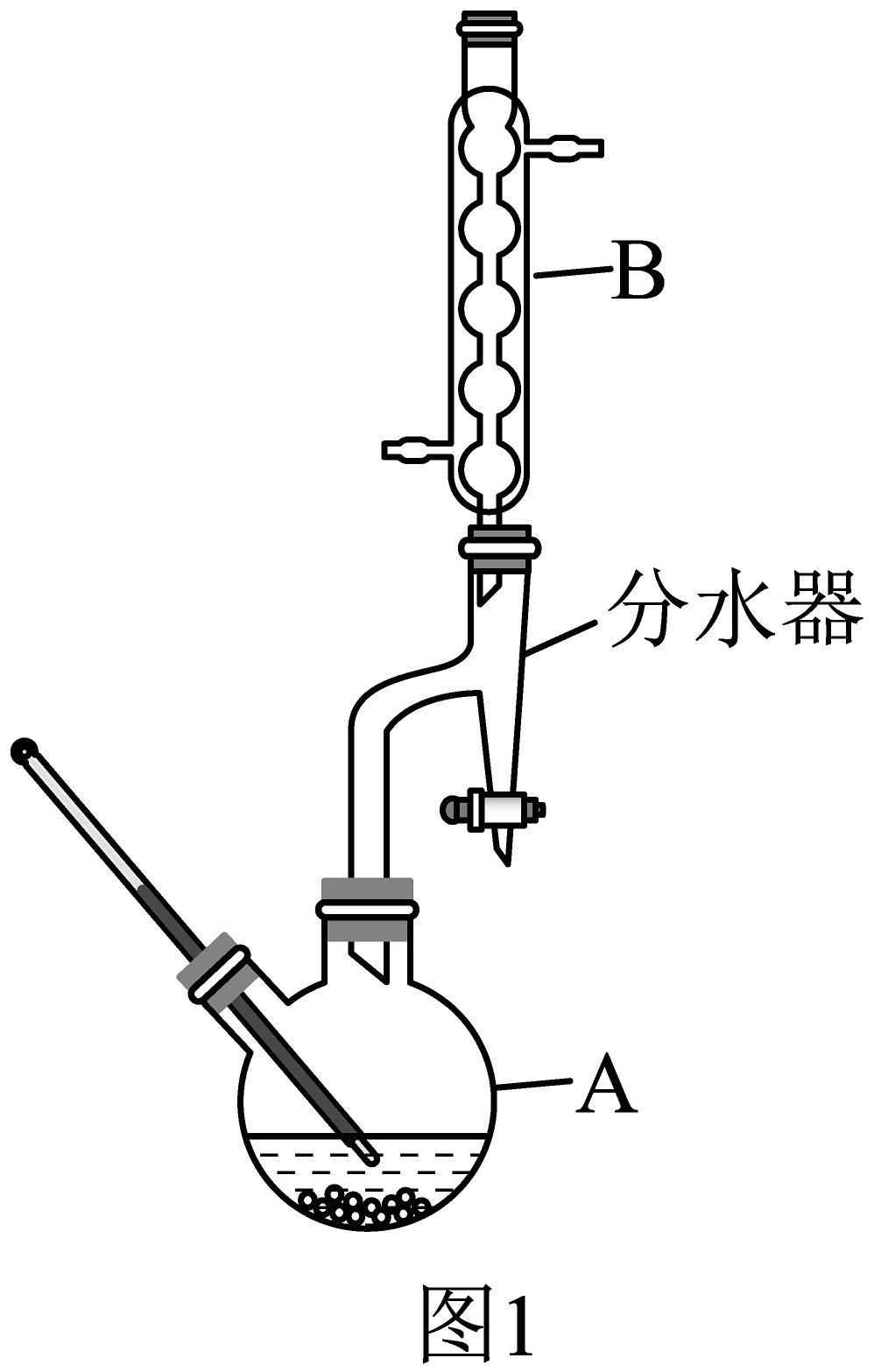
相关物质的部分物理性质见下表:
物质
相对分子质量
密度
熔点
沸点
水溶性
苯甲酸
122
1.26
122
249
微溶于水,溶于醇类
异戊醇
88
0.81
132.5
微溶于水
苯甲酸异戊酯
192
0.99
–
261
不溶于水,与醇类互溶
I.制备苯甲酸异戊酯:
按图1安装好制备装置,检查装置的气密性。将苯甲酸溶于异戊醇(过量,体积共约)中,并转移至A中,再加入浓硫酸,加入几粒沸石,安装仪器,小火加热。
(1)①图1所示实验所用烧瓶容积最适宜的是(填选项字母)。
a. b. c. d.
②A中发生的主要反应的化学方程式为。
③B的作用是;能说明反应结束的实验现象为。
Ⅱ.纯化产品:
将反应后的液体移至蒸馏装置,在油浴中加热(如图2所示):残留液冷却后倒入玻璃仪器C(图3)中,洗涤,得到粗苯甲酸异戊酯,用无水硫酸镁干燥粗苯甲酸异戊酯。再减压蒸馏得到纯品。
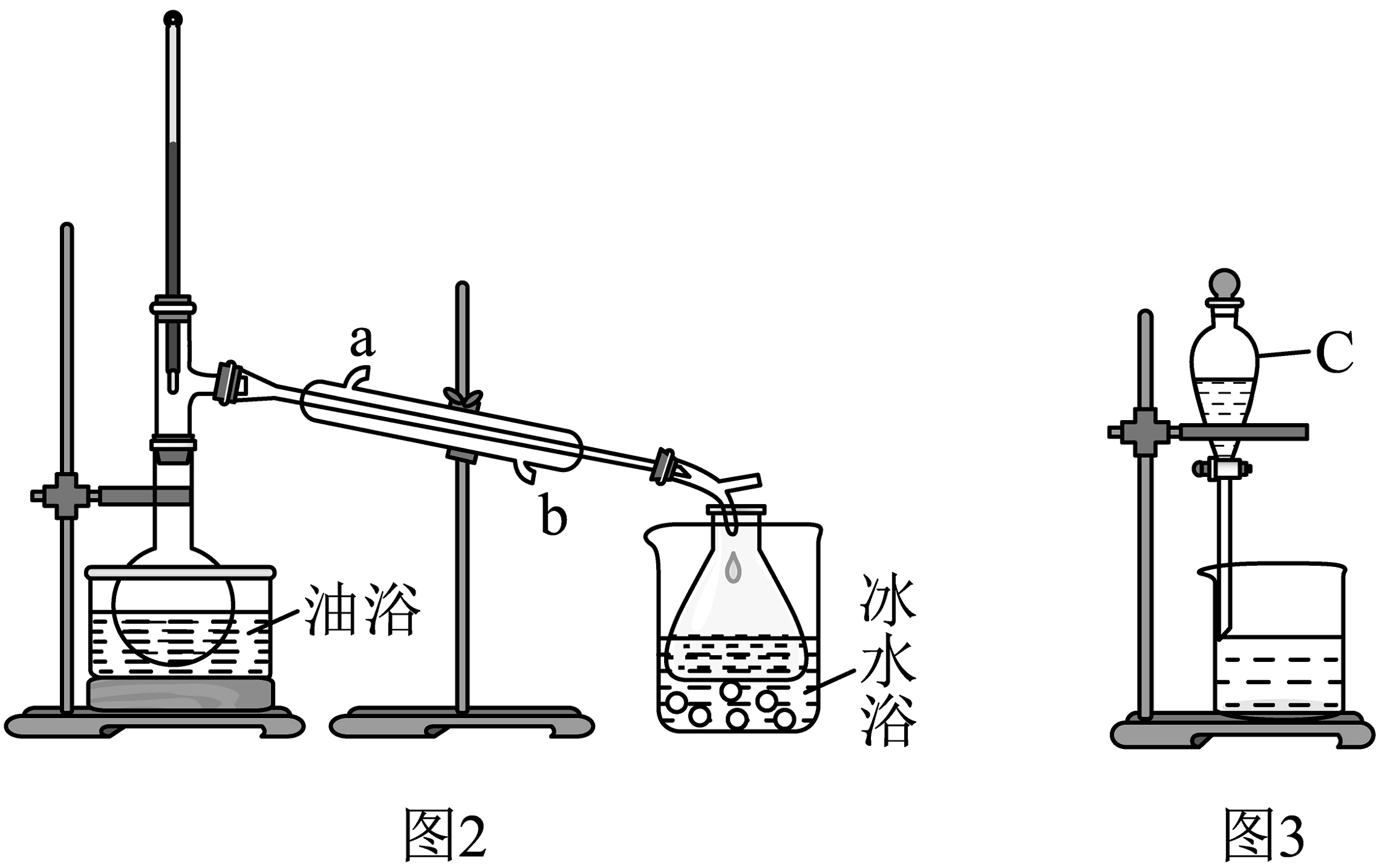
(2)①图2中冷凝水从(填a或b)进入;油浴加热的目的是除去。
②图3玻璃仪器C的名称为。洗涤液使用的顺序如下:用水洗涤2次,再用溶液洗涤2次,再用水洗涤2次。其中用溶液目的是。
(3)最终制得苯甲酸异戊酯纯品 , 本实验苯甲酸异戊酯的产率为(保留2位有效数字)。
-
11、甲烷化是“负碳排放”的重要研究方向,某研究团队报道了镍基催化剂上与反应生成甲烷的两种机理如图所示,其中吸附在催化剂表面的物种用*表示。

下列说法错误的是
A、镍基催化剂增加了活化分子的百分数 B、两种机理均涉及极性链的断裂和生成 C、机理中的选择性更高 D、机理涉及反应 -
12、为解决铜与稀硝酸反应过程中装置内氧气对实验现象的干扰,以及实验后装置内氮氧化物无法全部排出进行绿色化处理等问题,某实验小组对装置进行了改造。改造后的装置如下图所示(注:下图中的试管底部有小孔)。下列说法错误的是
 A、实验开始时先拉注射器A活塞,其目的是除去反应前试管内的空气 B、注射器B可用于调节或平衡广口瓶内气体的压强 C、该实验装置可通过控制止水夹和注射器来控制反应的开始与停止 D、反应停止后,打开止水夹、缓慢拉动注射器A即可将试管内的氮氧化物全部排入注射器A中
A、实验开始时先拉注射器A活塞,其目的是除去反应前试管内的空气 B、注射器B可用于调节或平衡广口瓶内气体的压强 C、该实验装置可通过控制止水夹和注射器来控制反应的开始与停止 D、反应停止后,打开止水夹、缓慢拉动注射器A即可将试管内的氮氧化物全部排入注射器A中 -
13、下列有关实验室氯气的制备、收集、性质检验及尾气处理的装置中,错误的是


A.制备
B.收集


C.验证没有漂白性
D.吸收尾气
A、A B、B C、C D、D -
14、实践出真知。下列劳动项目与所述的化学知识没有关联的是
劳动项目
化学知识
A
用乳酸合成聚乳酸可降解塑料
合成聚乳酸是缩聚反应
B
帮厨活动:炖鱼时加入料酒和醋
乙醇和醋酸反应生成有香味的酯
C
医疗消毒:用苯酚水溶液进行环境消毒
苯酚有强氧化性
D
学农活动:范肥时铵态氮肥和草木灰不能同时使用
与了在一定条件反应
A、A B、B C、C D、D -
15、北京冬奥会成功举办、“华龙一号”核电站、神舟十五号载人飞船发射成功及“C919”飞机等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是A、冬奥会“飞扬”火炬所用的燃料为极性分子 B、“C919”飞机机身使用的碳纤维材料属于新型无机非金属材料 C、载人飞船采用了太阳能刚性电池阵,将化学能转化为电能供飞船使用 D、“华龙一号”核电站以铀为核裂变原料,U与U互为同素异形体
-
16、化学处处呈现美。下列说法正确的是A、手性分子互为镜像,在三维空间里能叠合 B、“铁水打花”又叫打铁花,利用了铁元素的焰色试验 C、冬天飞舞的雪花,水分子之间通过键结合形成晶体 D、向硫酸四氨合铜溶液中加入乙醇会析出深蓝色晶体,因为乙醇的极性比水小
-
17、广东有众多非物质文化遗产,如粤绣、剪纸、制香和葵扇技艺等。下列物质的主要成分不是有机高分子材料的是
选项
A.佛山剪纸中的“纸”
B.粤绣中的“线”
文化遗产


选项
C.莞香中的“香油”
D.江门葵扇中的“扇叶”
文化遗产

 A、A B、B C、C D、D
A、A B、B C、C D、D -
18、元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。下图为钠元素的价类二维图。下列有关叙述错误的是
 A、若是 , 其中氢元素的化合价为价 B、b能与水剧烈反应产生氢气 C、包含和 , 二者均为碱性氧化物 D、若是 , 其晶体溶于水时伴随着吸热现象
A、若是 , 其中氢元素的化合价为价 B、b能与水剧烈反应产生氢气 C、包含和 , 二者均为碱性氧化物 D、若是 , 其晶体溶于水时伴随着吸热现象 -
19、X、Y、Z、M四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y与M同主族,Y与Z核电荷数相差2,Z的原子最外层电子数是内层电子数的3倍。下列说法不正确的是A、键角: B、分子的极性: C、共价晶体熔点: D、热稳定性:
-
20、物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项
性质差异
结构因素
A
沸点:乙醇高于乙醛
分子间氢键
B
熔点:H2O大于HF
分子间形成的氢键强度
C
键角:小于
电负性差异
D
分解温度:高于
键能大小
A、A B、B C、C D、D