相关试卷
-
1、室温下,用含少量的溶液制备的过程如题图所示:

已知: , ;
, ,
下列说法正确的是
A、饱和溶液中: B、为提高的产率,使用溶液“沉锰”效果更好 C、溶液中, D、反应的平衡常数为 -
2、在溶液中加入溶液,能得到紫色的溶液,继续加入稀硫酸,立即有蓝色的生成,该蓝色物质能被乙醚萃取,下列说法不正确的是A、结构为:
 B、在酸性溶液继续反应可能会生成
C、和均能氧化
D、与晶体类型不同,后者难以被乙醚萃取
B、在酸性溶液继续反应可能会生成
C、和均能氧化
D、与晶体类型不同,后者难以被乙醚萃取
-
3、某研究团队通过膜电解法制得纯碱,甘氨酸(H2NCH2COOH)和高浓度烧碱,其装置如图所示。其中膜a、b为离子交换膜,双极膜c在直流电的作用下,中间界面层水发生解离产生H+和OH-。下列说法正确的是
 A、膜a为阴离子交换膜 B、制得7.5g甘氨酸,盐室1增重2.2g C、碱室2反应式:2H2O-4e-=O2↑+4H+ D、一段时间后,碱室1浓度变小,碱室2浓度变大
A、膜a为阴离子交换膜 B、制得7.5g甘氨酸,盐室1增重2.2g C、碱室2反应式:2H2O-4e-=O2↑+4H+ D、一段时间后,碱室1浓度变小,碱室2浓度变大 -
4、W、R、Q、X、Y、Z是原子序数依次递增的前两周期主族元素,基态R原子无未成对电子,基态Q原子有2个未成对电子。W、R、X、Z四种元素可以组成离子化合物: , 其阴、阳离子均为正四面体结构。下列说法正确的是A、阴阳离子中均含有配位键 B、分子空间结构为平面形 C、一定是非极性分子 D、氢化物热稳定性:
-
5、有机物G的合成路线如下,下列说法正确的是
 A、Z→G发生了取代反应 B、上述物质中含有手性碳原子的物质有2种 C、1molY与NaOH溶液反应,最多能消耗2molNaOH D、物质Z中所有原子可能共平面
A、Z→G发生了取代反应 B、上述物质中含有手性碳原子的物质有2种 C、1molY与NaOH溶液反应,最多能消耗2molNaOH D、物质Z中所有原子可能共平面 -
6、下列有关说法正确的是A、用溴的四氯化碳溶液,可以鉴别丙醛与丙酮 B、丁苯橡胶、聚酯纤维、聚乙烯都是通过加聚反应获得的高聚物 C、DNA分子中两条链上的碱基通过氢键作用互补配对 D、淀粉与稀硫酸共热,冷却后加入过量NaOH溶液,再加入碘水可判断淀粉是否完全水解
-
7、下列说法正确的是
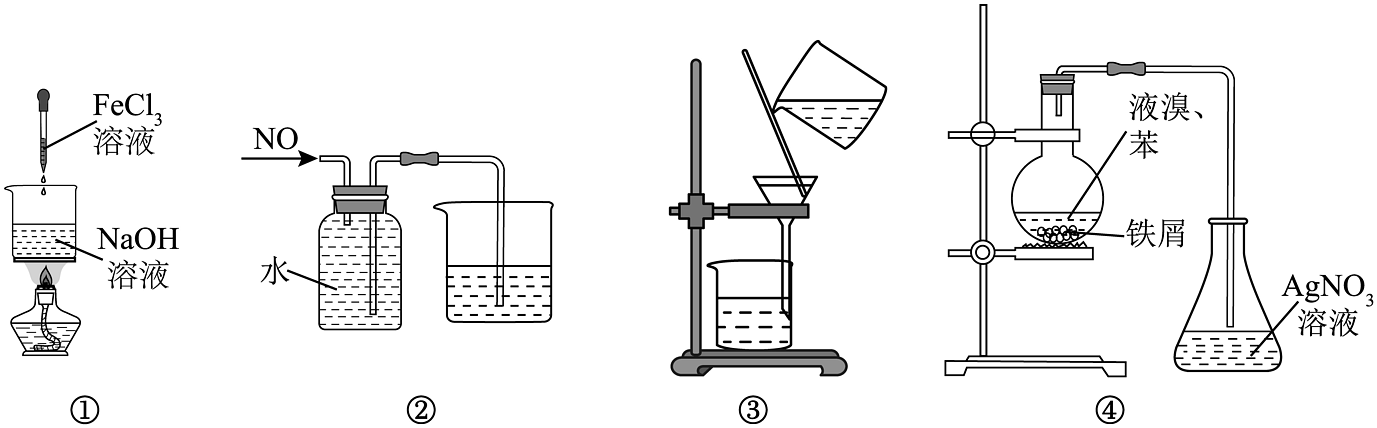 A、图①装置可用于制备氢氧化铁胶体 B、图②装置可用于收集 C、图③装置可用于常温下分离苯酚和水的混合物 D、图④装置可证明苯与液溴发生了取代反应
A、图①装置可用于制备氢氧化铁胶体 B、图②装置可用于收集 C、图③装置可用于常温下分离苯酚和水的混合物 D、图④装置可证明苯与液溴发生了取代反应 -
8、材料的组成、结构与性能关系密切,下列说法不合理的是
选项
材料
改进
作用
A
铝制品
使用氧化剂进行表面处理
增强抗腐蚀性
B
聚氯乙烯树脂
加入增塑剂
增加硬度
C
植物油
氢化处理
不易变质
D
水泥
加入石膏
调节硬化速度
A、A B、B C、C D、D -
9、下列反应的方程式正确的是A、溶液中通入过量: B、向中投入固体: C、浓硝酸见光分解: D、的燃烧热为 , 则
-
10、硫脲(CS(NH2)2)是一种有机合成中常用的试剂,对于反应 , 下列说法正确的是A、X的化学式为HCONH2 B、氧化产物与还原产物物质的量之比为2:1 C、氧化性I2>S D、每产生32gS单质,转移NA个电子
-
11、下列有关说法正确的是A、金属锂、钠、钾应保存在煤油中 B、蒸馏操作时需用到仪器:
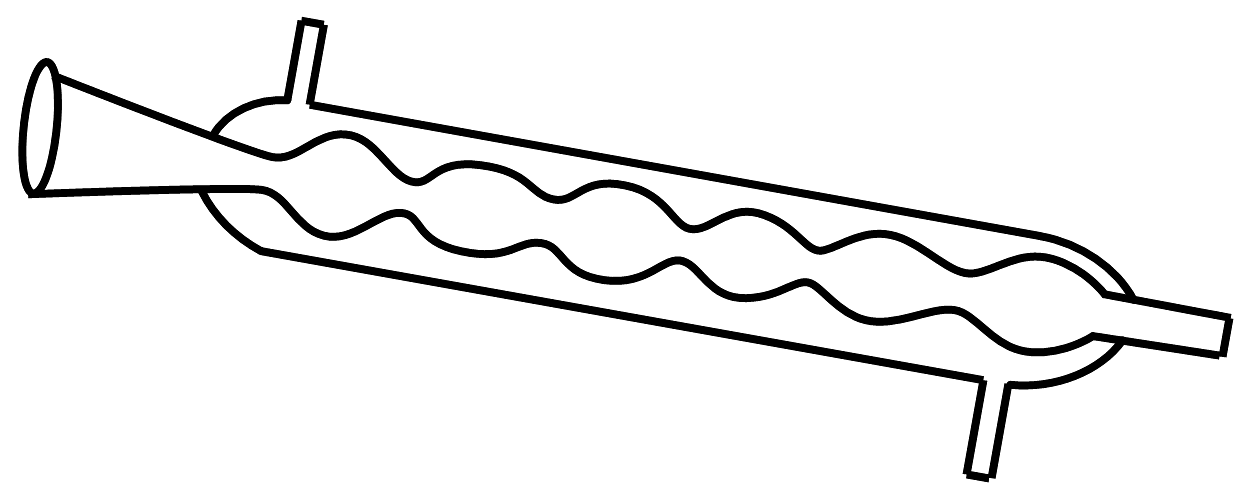 C、萃取时分液漏斗振荡几次之后打开上口玻璃塞放气
D、点燃可燃性气体前,应先检验气体的纯度
C、萃取时分液漏斗振荡几次之后打开上口玻璃塞放气
D、点燃可燃性气体前,应先检验气体的纯度
-
12、下列化学用语正确的是A、核外有a个电子,b个中子,M的原子符号为 B、基态原子核外电子排布式为: C、2-甲基丁烷的键线式:
 D、次氯酸的电子式
D、次氯酸的电子式
-
13、下列说法不正确的是A、电解饱和食盐水可制取金属钠 B、石灰石在高温下可用于消除燃煤烟气中的SO2 C、BaCO3不溶于水,但溶于盐酸,故不可用作医疗上检查肠胃的钡餐 D、纯碱可用于去除物品表面的油污
-
14、硫酸铜铵晶体属于A、酸 B、碱 C、盐 D、混合物
-
15、聚乳酸PLA是目前应用最广泛的可降解塑料,其合成路线和一种回收利用的方法如图所示(加料顺序、反应条件略):

回答下列问题:
(1)、化合物ⅱ的分子式为 , 其所含官能团的名称为。(2)、化合物ⅲ的化学名称为;化合物x为化合物ⅲ的同分异构体,存在一个手性碳原子且能发生银镜反应,则化合物x的结构简式为(任写一种)。(3)、关于上述合成路线中的相关物质及转化,下列说法正确的有_____(填选项字母)A、可以直接由化合物ⅰ通过缩聚反应得到PLA B、化合物ii中所有碳原子共平面 C、化合物ⅲ易溶于水,可以与水形成氢键 D、化合物ⅲ到化合物iv的转化中,有π键的断裂与形成(4)、根据化合物ⅳ的结构特征,分析预测其可能的化学性质,完成下表序号
反应试剂、条件
反应形成的新结构
反应类型
①

②
水解(取代)反应
(5)、①在一定条件下,以原子利用率100%的反应制备 。告该反应的反应物之一为直线形极性分子,则另一反应物为(填结构简式,下同);若该反应的反应物之一为V形分子,则另一反应物为。
。告该反应的反应物之一为直线形极性分子,则另一反应物为(填结构简式,下同);若该反应的反应物之一为V形分子,则另一反应物为。②结合所学知识,以氯乙烷为唯一的有机原料合成
 , 基于你设计的合成路线,最后一步反应的化学方程式为(注明反应条件,下同);第一步反应的化学方程式为。
, 基于你设计的合成路线,最后一步反应的化学方程式为(注明反应条件,下同);第一步反应的化学方程式为。 -
16、乙烯是重要的化工原料,研究其制备方法具有重大意义。回答下列问题:(1)、利用无水乙醇催化脱水制备乙烯时发生反应Ⅰ、Ⅱ。
I、C2H5OH(g)C2H4(g)+H2O(g) K1
Ⅱ、2C2H5OH(g)C2H5OC2H5(g)+H2O(g) K2
已知427℃和227℃下,反应Ⅰ的平衡常数K1分别为7.7和3.2,反应Ⅱ的平衡常数K2分别为0.14和0.80,则反应C2H5OC2H5(g)2C2H4(g)+H2O(g)的ΔH0(填“>”“<”或“=”)。
(2)、乙炔电催化制乙烯的工艺中,乙炔的转化率超过99%,产物中乙烯的选择性高达83%,其反应历程如图所示,其中“*”表示吸附。
①该反应历程中,反应速率最慢的基元反应方程式为。
②下列说法正确的是(填选项字母)
A、1→2中有极性键的断裂和形成
B、2→3吸收的能量大于3→4释放的能量
C、3→4中H2O的作用是与O*生成OH*
(3)、乙烷制乙烯具有极高的经济效益。某温度、100kPa下,向反应器中充入1molC2H6发生反应:C2H6(g)C2H4(g)+H2(g) ΔH,C2H6的平衡转化率为60%;保持温度和压强不变,再向反应器中充入xmol水蒸气,5min后达到平衡,此时C2H6的平衡转化率为75%。则x的值为(与出计算过程)。(4)、二氧化碳在催化剂的作用下可与氢气反应制取乙烯,过程中发生如下反应:I、2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH1=+9kJ·mol-1
Ⅱ、2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH2=﹣79kJ·mol-1
若将CO2和H2按物质的量之比1:3混合,在bkPa的恒压反应器中连续反应,测得平衡时CO2的转化率与C2H4、C2H5OH的选择性随温度变化的曲线如图所示:

图中y= , 说明判断依据:。
-
17、对废水进行处理可有效利用金属资源。某废水处理渣的主要元素组成为铁、钴、铜、钨,其一种回收利用工艺的部分流程如图所示:

已知:ⅰ、氨性溶液由NH3·H2O、(NH4)2SO4、NH4NO3配制而成;
ⅱ、氨浸时,氨与Cu2+、Co2+、Co3+等离子可形成稳定配合物;
ⅲ、Kb(NH3·H2O)=10-4.7
ⅳ、萃取剂LiX973的萃取原理为Cu2+(aq)+2HRCuR2+2H+(aq),P507的萃取原理与其相似。
回答下列问题:
(1)、基态Co2+的价层电子排布式为。(2)、处理渣中的Cu(OH)2在“氨浸”步骤中发生反应的离子方程式为。(3)、常温下,pH=12的氨性溶液中,1(填“>”“<”或“=”)。(4)、在一定条件下,氨浸时间超过5h时,钴、铜浸出率不再升高,反而有所下降,原因可能是。(5)、“反萃取”步骤中加入的试剂是(填化学式);大颗粒硫酸钴晶体是制备锂离子电池的原材料,“操作Ⅱ”的结晶过程中更利于制得大颗粒晶体的操作为(任答一点)。(6)、我国科学工作者利用晶胞结构如图1所示的氮化钴掺杂Cu获得有高效催化性能新物质,形成了如图2所示的结构单元。
①由图2所示单元结构形成的晶胞中,Cu原子周围距离最近且相等的Co原子的数目为。
②)若NA为阿伏加德罗常数的值,则由图2所示单元结构形成的晶胞的密度为g▪cm-3(用含a、NA的代数式表示)。
-
18、
碳酸钠用途广泛,能在不同情境中进行转化。回答下列问题:
Ⅰ.
(1)Na2CO3溶液常用于含氮尾气的吸收,若含氮尾气中n(NO2):n(NO)=1:1且吸收过程中无新的气体放出,则完全吸收时反应的化学方程式为________。
Ⅱ.
(2)“侯式制碱法”中,向饱和食盐水中通入气体的顺序为_____(填选项字母)。
A. 先通NH3后通CO2 B. 先通CO2后通NH3 C. 先通NH3后通SO2 D. 先通SO2后通NH3 Ⅲ.我国盛产的重晶石的主要成分为BaSO4 , 而BaSO4难溶于水或酸中,常用饱和Na2CO3溶液将其转化,进而制备可溶性钡盐。其转化过程如下:
BaSO4(s)+(aq)BaCO3(s)+(aq)反应ⅰ
(3)已知Ksp(BaSO4)=1.0×10-10 , Ksp(BaCO3)=2.58×10-9 , 若使1LNa2CO3溶液与0.1molBaSO4充分反应(忽略溶液体积变化),则BaSO4完全转化为BaCO3所需Na2CO3溶液的最低浓度为________。
(4)兴趣小组在实验室探究Na2CO3溶液浓度对反应i反应速率的影响。用Na2CO3固体配制溶液,以滴定法测定其浓度。已知溴甲基酚绿-甲基红混合指示剂变色的pH范围如表所示:
PH
<5.2
≥5.2
颜色
暗红色
绿色
①该过程中用到的仪器有________(填选项字母)
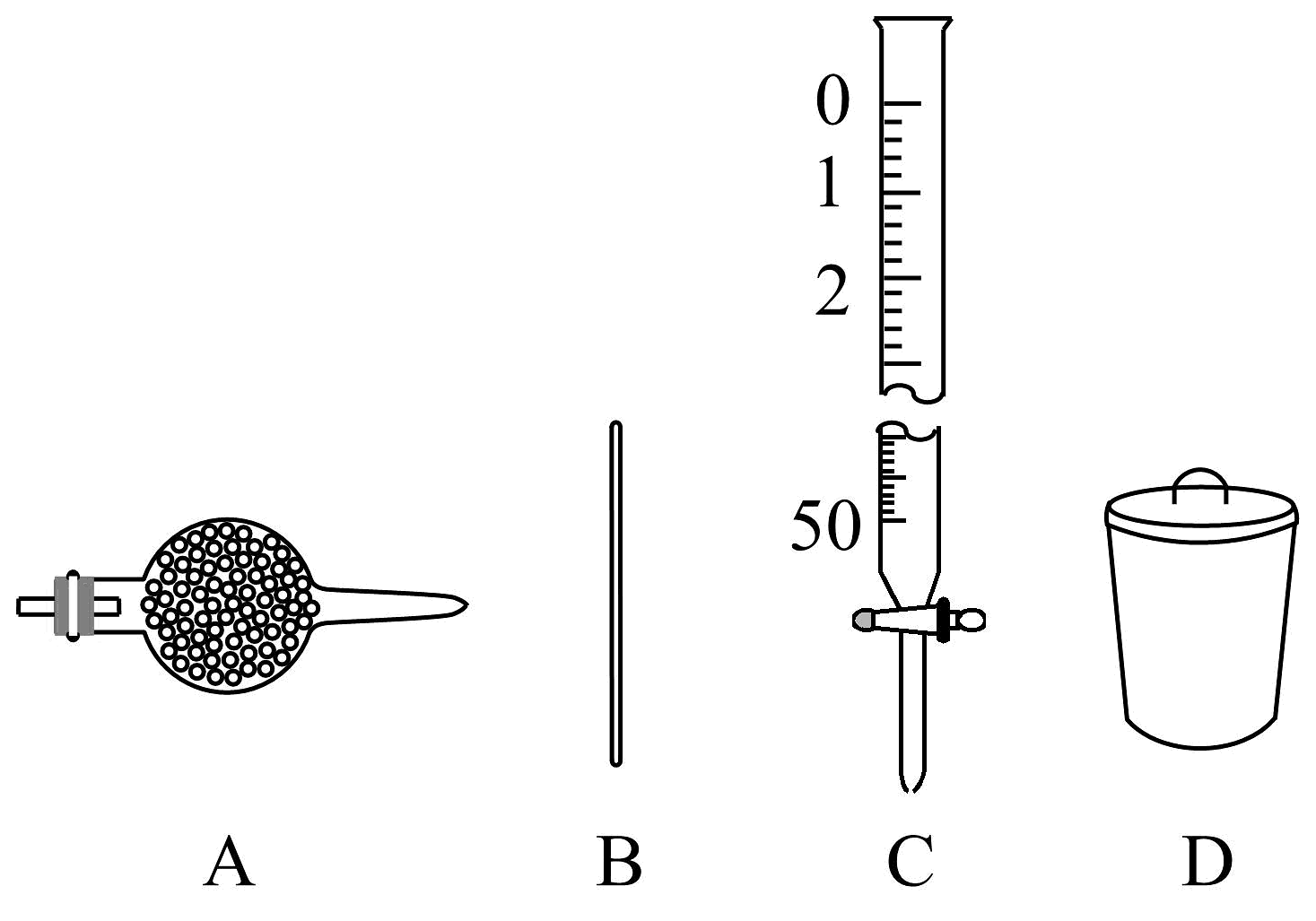
②滴定结果处理:取Na2CO3溶液V0mL,滴定消耗了V1mLc1mol·L-1盐酸,滴定终点的现象为________;若到达滴定终点时完全转化为CO2 , 则所配制的Na2CO3溶液中c(Na2CO3)=________mol·L-1
③实验探究:取配制的Na2CO3溶液按如表所示的体积配制系列溶液,控制溶液的总体积相同。分别加入m1gBaSO3固体,反应t1min后,过滤,取V0mL滤液,用c1mol·L-1盐酸参照②进行滴定,记录的部分数据如表所示(忽略水解的影响):
序号
V(配制的Na2CO3溶液)/mL
V(H2O)/mL
V(滤液)/mL
V消耗(盐酸)/mL
a
100
0
V0
b
60
40
V0
则一定范围内,Na2CO3溶液浓度越大,化学反应速率________(填“越快”或“越慢”),测得平均反应速率之比va:vb=________。
-
19、室温时,用NaOH中和H2A溶液并保持体系中c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1 , 中和过程中,溶液中H2A、HA-、A2-的物质的量分数δ随pH变化的关系如图所示。下列说法不正确的是
 A、室温时,H2A的Ka2=10-7 B、将pH由1.8调至3的过程中,溶液中的值始终减小 C、室温下,Na2A的溶液中水电离出的c(OH-)>10-7mol·L-1 D、c(Na+)=0.10mol·L-1时,溶液中c(HA-)>c(H2A)>c(A2-)
A、室温时,H2A的Ka2=10-7 B、将pH由1.8调至3的过程中,溶液中的值始终减小 C、室温下,Na2A的溶液中水电离出的c(OH-)>10-7mol·L-1 D、c(Na+)=0.10mol·L-1时,溶液中c(HA-)>c(H2A)>c(A2-) -
20、空间站中CO2的处理涉及反应CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=﹣164.9kJ·mol-1 , 下列说法正确的是A、混合气体的平均摩尔质量不再改变,说明反应达到化学平衡状态 B、若某刚性密闭容器中,初始投入c(CO2)=1mol·L-1、c(H2)=4mol·L-1 , 平衡时CO2的转化率为50%,则平衡常数K=16 C、恒温时增大该体系的压强,平衡正向移动,化学平衡常数增大 D、使用催化剂能降低反应的活化能,提高CO2的平衡转化率