相关试卷
-
1、为证明卤族元素的非金属性强弱,某小组用如图所示装置进行实验(夹持仪器已略去,装置气密性已检查),(提示:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。)

实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为橙红色时,关闭活塞a。
Ⅳ.∙∙∙∙∙∙
(1)、倾写出氯气的电子式:。(2)、验证氯气的氧化性强于碘的实验现象是。(3)、过程Ⅲ实验的目的是。(4)、氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐 , 得电子能力逐渐。 -
2、某废料铁泥主要成分为、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取 , 设计实验流程如下:
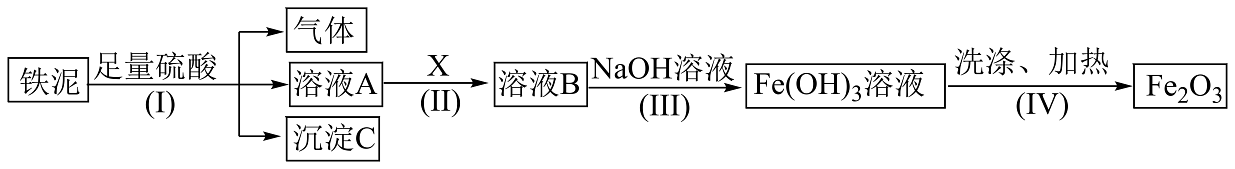 (1)、分离溶液A和沉淀C的操作名称是。(2)、检验溶液A中含有可选用的试剂是___________(填字母)。A、酸性溶液 B、溶液 C、铁粉 D、KSCN溶液(3)、步骤(Ⅲ)中生成的固体的颜色是。(4)、步骤(Ⅱ)中加入的试剂X的作用是 , 若试剂X为 , 请写出该步骤反应的离子方程式。(5)、若最终获得 , 则铁泥中铁元素的质量分数为(用含n和w的代数式表示)。
(1)、分离溶液A和沉淀C的操作名称是。(2)、检验溶液A中含有可选用的试剂是___________(填字母)。A、酸性溶液 B、溶液 C、铁粉 D、KSCN溶液(3)、步骤(Ⅲ)中生成的固体的颜色是。(4)、步骤(Ⅱ)中加入的试剂X的作用是 , 若试剂X为 , 请写出该步骤反应的离子方程式。(5)、若最终获得 , 则铁泥中铁元素的质量分数为(用含n和w的代数式表示)。 -
3、完成下列问题。(1)、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:

①该反应的化学方程式:。
②反应开始至3min,X的反应速率为。
③在一容积可变的密闭容器中发生该反应,压强不变,充入氦气使容器容积增大,反应速率将。(填“增大”“减小”或“不变”)
(2)、下表中的数据表示破坏1 mol化学键需消耗的能量,即键能(单位为kJ·mol-1)化学键
H—H
H—Cl
键能
436
431
热化学方程式:H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1 , 则Cl—Cl的键能为 kJ·mol-1。
(3)、已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-a kJ·mol-1H2(g)+O2(g)=H2O(l) ΔH2=-b kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH3=-c kJ·mol-1
写出C(s,石墨)与H2(g)反应生成1 mol CH4(g)的热化学方程式(用含a、b、c的式子表示)。
(4)、由N2O和NO反应生成N2和NO2的能量变化如图所示。则反应过程中,每生成2 mol N2 , 理论上放出的热量为。
-
4、侯德榜为我国化工事业的发展做出了卓越贡献,是我国近代化学工业的奠基人之一、“侯氏制碱法”将制碱技术发展到一个新的水平,赢得了国际化工届的高度评价。(1)、纯碱,又名苏打,化学式为Na2CO3 , 其水溶液显(选填“酸性”或“碱性”)。(2)、请写出纯碱与足量稀盐酸反应的离子方程式。(3)、实验室用纯碱固体(摩尔质量:106g/mol)配制100mL0.5mol/L的纯碱溶液:
①需称量纯碱固体的质量为g。
②配制溶液时已提供下列仪器:
A.量筒 B.托盘天平 C.玻璃棒 D.胶头滴管 E.药匙 F.烧杯
还缺少的玻璃仪器是。
③在此配制过程中,下列情况会使配制结果偏低的是 (填序号)。
A.纯碱固体吸水受潮 B.移液时未洗涤烧杯和玻璃棒
C.定容时俯视刻度线观察液面 D.摇匀后,发现液面低于刻度线,再加水至刻度线
④从配制好的溶液中取出10mL溶液,加水稀释至100mL,稀释后溶液中Na+物质的量浓度为mol/L。
-
5、下列有关物质结构的说法正确的是A、78 g Na2O2晶体中阴、阳离子个数均为2NA B、H2O2的结构式为H—O—O—H C、4.48 L NH3中含有0.6NA个N—H D、PCl5和NH3分子中所有原子的最外层都达到8电子稳定结构
-
6、有机物A的产量是衡量一个国家石油化工发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是
 A、A的电子式为
A、A的电子式为 B、75%的B溶液(体积分数)可作医用消毒剂
C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别
D、由B、D制备E时浓H2SO4只作吸水剂
B、75%的B溶液(体积分数)可作医用消毒剂
C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别
D、由B、D制备E时浓H2SO4只作吸水剂
-
7、对于某些离子的检验及结论正确的是A、加入稀盐酸后再加入硝酸银,产生白色沉淀,原溶液中一定有Cl- B、加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液中一定有 C、某溶液中加入碳酸钠溶液有白色沉淀生成,再加盐酸,白色沉淀消失,不一定有Ca2+ D、加稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,原物质中一定有CaCO3
-
8、某反应的能量变化如图所示,对于该图的理解,一定正确的是
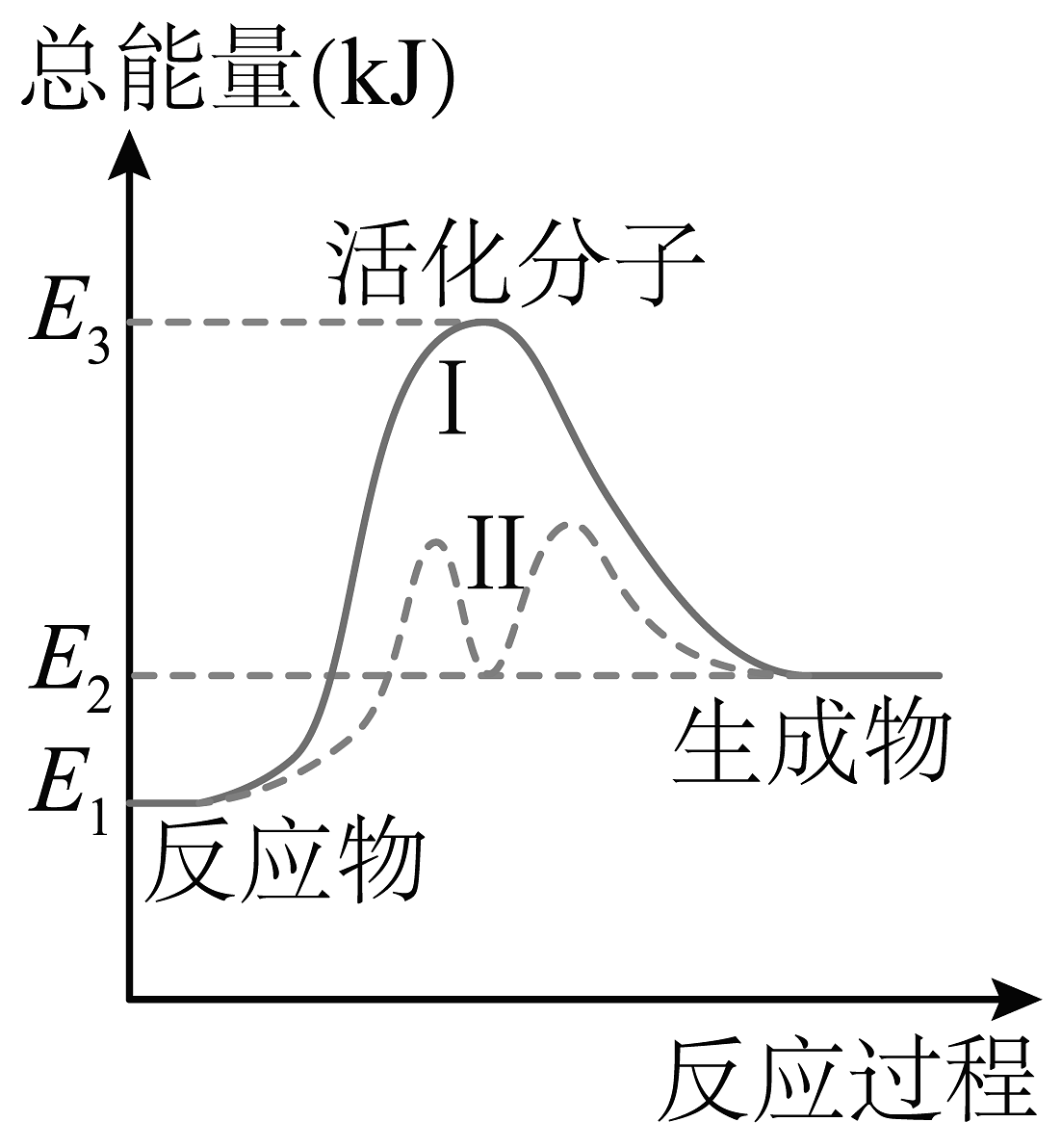 A、该反应的反应热 B、为过程I的活化能 C、从曲线II可知该反应为放热反应 D、过程I比过程II的反应速率快
A、该反应的反应热 B、为过程I的活化能 C、从曲线II可知该反应为放热反应 D、过程I比过程II的反应速率快 -
9、下列关于反应热的叙述正确的是A、当ΔH<0时,表示反应为吸热反应 B、由C(s)+O2(g)=CO(g)的反应热为-110.5 kJ·mol-1 , 可知碳的燃烧热为110.5 kJ·mol-1 C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关 D、在一个确定的化学反应中,反应物的总焓与生成物的总焓一定不同
-
10、下列说法正确的是A、用铁片与稀硫酸反应制取氢气时,改用浓硫酸可以加快产生氢气的速率 B、对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 C、常温下钠与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 D、对于可逆反应H2(g)+I2(g)2HI(g),H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
-
11、加氢转化为燃料是实现减排的一个重要策略,我国科学家在调控加氢反应的选择性方面取得新进展,其过程的示意图如下。下列说法不正确的是
 A、分子中化学键为非极性共价键 B、该反应中有C—H键生成 C、反应中既有化学键的断裂,也有化学键的生成 D、忽略反应条件,总反应为
A、分子中化学键为非极性共价键 B、该反应中有C—H键生成 C、反应中既有化学键的断裂,也有化学键的生成 D、忽略反应条件,总反应为 -
12、硫酸亚铁煅烧反应为 , 下列有关说法正确的是A、该分解反应过程中氧元素的化合价降低 B、中铁元素被还原 C、是氧化产物 D、该反应中既做氧化剂,又做还原剂
-
13、下列离子方程式不正确的是A、氯化铁溶液与铁反应: B、用醋酸和淀粉KI溶液检验加碘盐中的: C、往FeBr2溶液中通入少量的氯气:2Fe2+ + Cl2 =2Fe3+ + 2Cl- D、Cl2通入冷的NaOH溶液:Cl2+2OH-=Cl-+ClO-+H2O
-
14、下列各组离子能大量共存的是A、使酚酞变红的溶液中:Na+、、 Fe3+ B、pH<7的溶液中:Ca2+、Cl-、CH3COO- C、澄清透明的溶液中:K+、MnO、 D、含有Ca2+的溶液中:Cl-、 H+、
-
15、下列表示反应中相关微粒的化学用语正确的是A、CO2的比例模型:
 B、中子数为18的氯原子:
C、N2的结构式:N=N
D、的电离:
B、中子数为18的氯原子:
C、N2的结构式:N=N
D、的电离:
-
16、等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是
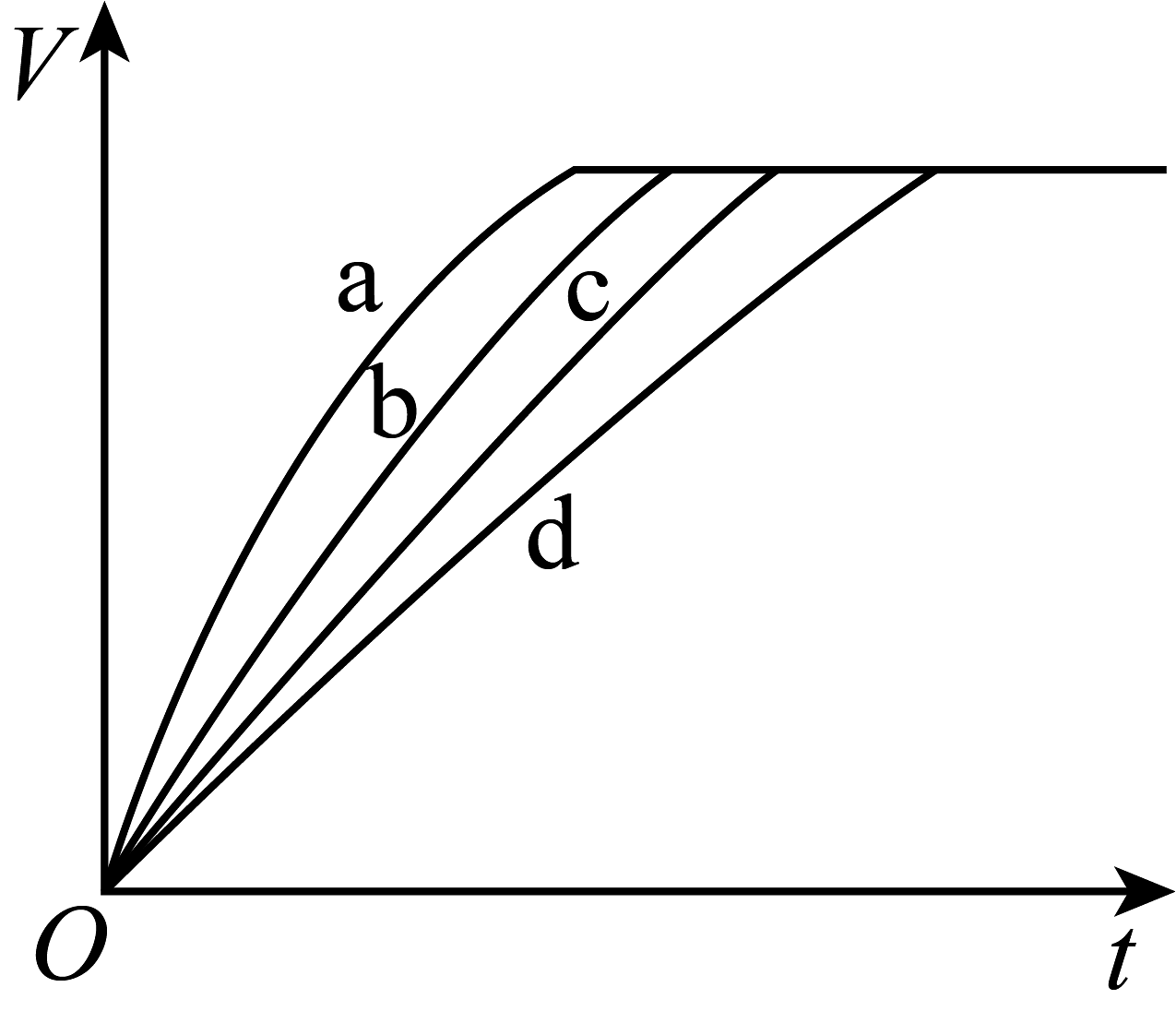
组别
对应曲线
c(HCl)/mol·L-1
反应温度/℃
铁的状态
1
a
30
粉末状
2
b
30
粉末状
3
c
2.5
块状
4
d
2.5
30
块状
A、第4组实验的反应速率最慢 B、第1组实验中盐酸的浓度大于2.5mol·L-1 C、第2组实验中盐酸的浓度等于2.5mol·L-1 D、第3组实验的反应温度低于30℃ -
17、下列叙述正确的是A、H2O2、SO2、氯水、过氧化钠、臭氧、活性炭都有漂白性,其原理相同 B、甲烷和乙烯气体都能使酸性高锰酸钾溶液褪色 C、向含有BaCl2和NaOH的混合溶液中通入少量的CO2气体,有白色沉淀生成 D、用CuO不可以鉴别乙酸和乙醇
-
18、下列对有关物质的分类不正确的是
选项
物质
分类
不同类物质
A
干冰、白酒、加碘盐、食醋
混合物
干冰
B
CaO、H2O、P2O5、K2CO3
氧化物
K2CO3
C
HgO、NaOH、KCl、P4(白磷)
化合物
P4(白磷)
D
铝、铁、锌、氧气
还原剂
锌
A、A B、B C、C D、D -
19、化学与生产、生活密切相关,下列说法不正确的是A、闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 B、我国清代《本草纲目拾遗》中记叙“强水”条目下写道:“性最烈,能蚀五金∙∙∙∙∙∙其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指HF C、《清波杂志》卷十二:“信州铅山胆水自山下注,势若瀑布∙∙∙∙∙∙古传一人至水滨,遗匙钥,翌日得之,已成铜矣。”这里的胆水是指CuSO4溶液 D、葡萄酒中通常添加少量SO2 , 既可以杀菌,又可防止营养成分被氧化
-
20、以石蜡油为原料可制得多种有机物,部分转化关系如图所示:
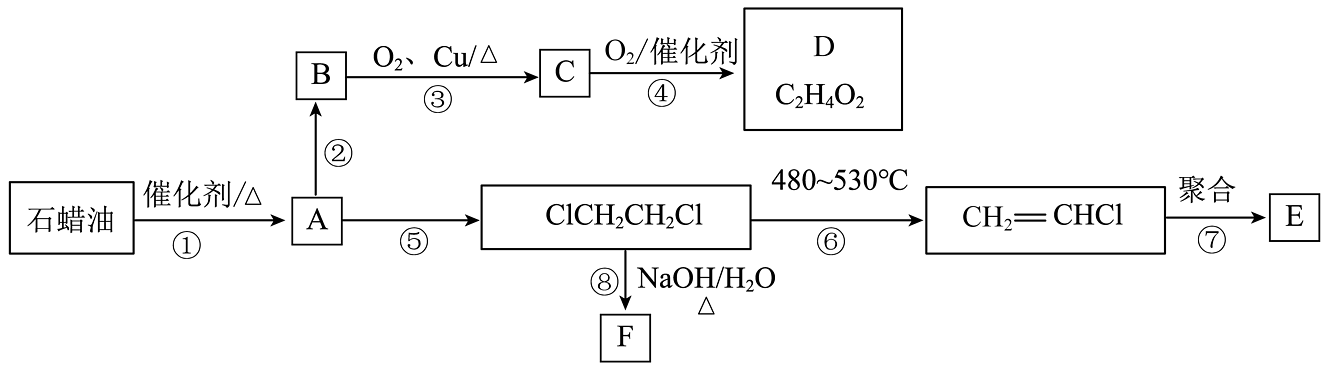
已知:(X=Cl、Br、I)
回答下列问题:
(1)、有机物C的结构简式为 , D中官能团名称为。(2)、反应②的化学方程式为 , 反应③的反应类型为。(3)、反应⑥的另外一种产物为 , 反应⑦的化学方程式为。(4)、D与F在一定条件下反应生成有香味的物质G(),试写出满足下列条件的G的同分异构体有种。①只含一种官能团 ②与溶液反应生成
(5)、以淀粉为原料经两步反应也可制得B,下列说法正确的是(填字母)。a.淀粉与纤维素不是同分异构体,但均能在人体内水解为葡萄糖
b.碘水可以检验淀粉是否发生水解
c.淀粉和E均为高分子化合物
d.淀粉水解的最终产物可用新制氢氧化铜悬浊液检验