相关试卷
-
1、某反应的离子方程式为 , 下列关于该反应的说法不正确的是A、该反应可能是化合反应,也可能是氧化还原反应 B、该反应一定是复分解反应,且属于非氧化还原反应 C、该反应可能是 D、该反应可能是
-
2、常温下,可以发生下列三个反应:①2W-+X2=2X-+W2;②2Y-+W2=2W-+Y2;③2X-+Z2=2Z-+X2 , 由此得出的正确结论是A、X-、Y-、Z-、W-中Z-还原性最强 B、X2、Y2、Z2、W2中Z2氧化性最弱 C、反应2Z-+Y2=2Y-+Z2不能发生 D、还原性:X->Y-
-
3、如图是电解质导电实验装置,接通电源后下列说法不正确的是(图中s指固态)。
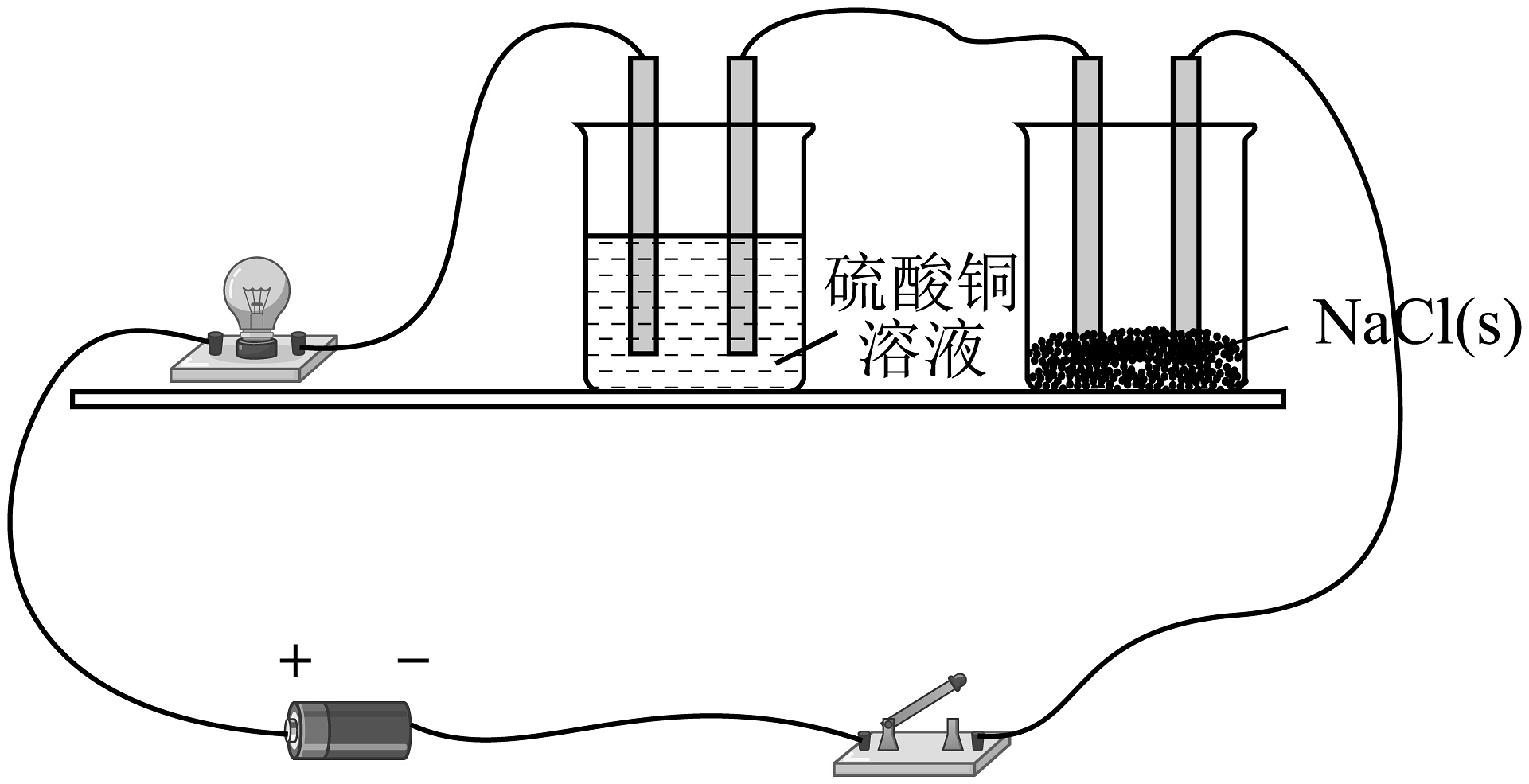 A、向NaCl粉末中加入适量水,灯泡会亮起来 B、、NaCl均为电解质 C、NaCl的电离方程式: D、向NaCl粉末中加入适量水,灯泡变亮,向溶液中加入少量NaOH固体,灯泡明显变暗
A、向NaCl粉末中加入适量水,灯泡会亮起来 B、、NaCl均为电解质 C、NaCl的电离方程式: D、向NaCl粉末中加入适量水,灯泡变亮,向溶液中加入少量NaOH固体,灯泡明显变暗 -
4、用下列装置或操作进行相应实验,能达到实验目的的是
操作


目的
A.称取一定质量的固体
B.验证和水反应是否为放热反应
操作


目的
C.除去中的气体
D.比较的稳定性
A、A B、B C、C D、D -
5、向一定体积的Ba(OH)2溶液中逐滴加入H2SO4 , 测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是
 A、AB段溶液的导电能力不断减弱,说明BaSO4不是电解质 B、B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、a时刻Ba(OH)2溶液和稀H2SO4溶液恰好完全中和 D、BC段溶液的导电能力不断增强,主要是过量H2SO4电离出的离子导电
A、AB段溶液的导电能力不断减弱,说明BaSO4不是电解质 B、B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、a时刻Ba(OH)2溶液和稀H2SO4溶液恰好完全中和 D、BC段溶液的导电能力不断增强,主要是过量H2SO4电离出的离子导电 -
6、和CO是环境污染性气体,可在表面转化为无害气体,其反应为 , 有关化学反应的物质变化过程如图1,能量变化过程如图2。下列说法正确的是
 A、由图1可知:和均为催化剂 B、由图2可知:反应①的反应速率比反应②快 C、由图2可知: , 且 kJ⋅mol-1 D、使用催化剂能降低活化能,从而改变反应的历程和焓变
A、由图1可知:和均为催化剂 B、由图2可知:反应①的反应速率比反应②快 C、由图2可知: , 且 kJ⋅mol-1 D、使用催化剂能降低活化能,从而改变反应的历程和焓变 -
7、羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定温度下的容积不变的密闭容器中发生反应:CO(g)+H2S(g)COS(g)+H2(g)。下列叙述中,能说明反应达到化学平衡状态的是A、v (H2S)=v (COS) B、气体的密度不再变化 C、CO的浓度不再变化 D、容器内气体的总压强不再变化
-
8、劳动创造美好生活。下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
帮厨活动:用高压锅炖肉
压强越大,水的沸点越高
B
环保行动:将废旧电池分类回收
废旧电池回收利用既节约成本又降低污染
C
家务劳动:用洁厕灵清洗卫生间水垢
盐酸具有较强的挥发性
D
医药管理:用冰箱保存疫苗
温度越低,反应速率越慢
A、A B、B C、C D、D -
9、现代生活需要人们有一定的科学素养,下列有关化学的科学常识说法正确的是A、碳酸钠俗名小苏打,可用作糕点膨松剂 B、为防止馅饼等富脂食品氧化变质,常在包装袋中放入生石灰 C、榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化 D、钢铁腐蚀、胶体的制备都与氧化还原反应有关
-
10、在无色透明的酸性溶液中,能大量共存的是A、、、、 B、、、、 C、、、、 D、、、、
-
11、胶体是一种重要的分散系,下列有关叙述正确的是A、明矾可用作净水剂与胶体的性质有关 B、丁达尔效应是胶体粒子对光线折射形成的,是一种物理现象 C、静电除尘,利用了胶体带电的性质 D、可用滤纸除去淀粉溶液中混有的氯化钠
-
12、化学与社会、生活和生产息息相关。以下叙述错误的是A、“用浓酒和糟入甑(蒸锅),蒸气令上∙∙∙∙∙∙”。其中涉及的操作是蒸馏 B、“春蚕到死丝方尽,蜡炬成灰泪始干”中涉及氧化还原反应 C、“以曾青涂铁,铁赤色如铜”,“曾青”是可溶性铁盐 D、“青蒿一握,以水二升渍,绞取之”,其中对青蒿素的提取属于物理变化
-
13、聚酰亚胺是重要的特种工程塑料,广泛应用于航空、纳米、激光等领域,被称为“解决问题的能手”。聚合物是合成聚酰亚胺的中间体。一种合成聚合物的路线图如下:

已知:
i.
 。
。ii.
 。
。回答下列问题:
(1)、C中官能团的名称是 , 的反应类型是。(2)、E苯环上的一氯代物只有1种,则的化学方程式是。(3)、下列有关说法正确的是(填标号)。a.A中所有原子可能共平面
b.B生成C所需试剂是浓硝酸,反应条件是浓硫酸和加热
c.能够用酸性溶液鉴别E、H
d.C中所有碳原子的杂化方式均为杂化
(4)、H的结构简式为。(5)、同时符合下列条件的B的同分异构体有种。①含有苯环;②能与溶液反应生成。
(6)、参照上述合成路线,设计由 、和制备
、和制备 的合成路线:(用流程图表示,无机试剂任选)。
的合成路线:(用流程图表示,无机试剂任选)。 -
14、三氧化二镍在颜料、蓄电池、阻燃剂等领域应用广泛。一种以镍铁合金废料(主要含有Ni、Fe、Cu、Ca、Mg、Zn等金局)为原料制备三氧化二镍的工艺流程如下:

已知:。常温下, , 。一些难溶电解质的如表所示:
难溶电解质
NiS
CuS
ZnS
18.8
35.2
21.7
回答下列问题:
(1)、“酸溶”过程中可以加快反应速率和提高浸出率的方法有(写两条即可)。(2)、“除杂1”步骤中,加入将溶液的pH调至1.6~1.8,得到黄钠铁矾 , 该反应的离子方程式为。(3)、“除杂2”步骤中,常温下,始终保持溶液中的浓度为。为将预除杂质完全除去,应保持溶液的pH不小于 , 若此时的浓度为 , 则(填“有”或“没有”)损失(当某离子浓度时,可认为该离子完全除去)。(4)、“沉镍”步骤中,得到的滤液中所含的阳离子主要有(填离子符号)。(5)、在空气中“煅烧”发生反应的化学方程式为。(6)、Ni、Fe、O三种元素形成的某化合物可以用作催化剂,其晶胞结构如图所示。该化合物晶体的密度为(设为阿伏加德罗常数的值,列出计算表达式)。
-
15、以印刷线路板的碱性蚀刻废液{主要成分为}或焙烧过的铜精炼炉渣(主要成分为、及少量)为原料均能制备晶体。
实验步骤:
Ⅰ.取一定量蚀刻废液和稍过量的溶液加入如图所示实验装置的三颈烧瓶中,在搅拌下加热反应并通入空气,当产生大量的黑色沉淀时停止反应。
Ⅱ.趁热过滤、洗涤,得到固体。
Ⅲ.所得固体经酸溶、结晶、过滤等操作,得到晶体。

已知:时,完全沉淀;时,开始沉淀,时,完全沉淀。
(1)、写出用蚀刻废液制备发生反应的化学方程式:。检验固体是否洗净的实验操作是。(2)、装置图中装置的作用是。实验中采用热水浴加热,与用酒精灯直接加热相比,其优点是。(3)、以焙烧过的铜精炼炉渣为原料制备晶体时,可取一定量焙烧过的铜精炼炉渣,加入稀硫酸溶解(实验所得溶液中的浓度约为),过滤后往滤液中再加入溶液调节为至 , 然后过滤,经操作后,晾干,得到晶体。(4)、通过下列方法测定产品纯度:准确称取样品,加适量水溶解,转移至碘量瓶中,加过量溶液并用稀酸化,以淀粉溶液为指示剂,用标准溶液滴定至终点,消耗溶液。测定过程中发生下列反应:;。样品的纯度为。 -
16、汽车尾气净化反应为 , 。向密闭容器中充入、 , 测得和的物质的量浓度与时间的关系如图所示。下列说法正确的是
 A、当体系中和浓度比不变时达到平衡状态 B、段反应速率 C、上述正反应在任何温度下都能自发进行 D、该温度下,上述反应的逆反应平衡常数
A、当体系中和浓度比不变时达到平衡状态 B、段反应速率 C、上述正反应在任何温度下都能自发进行 D、该温度下,上述反应的逆反应平衡常数 -
17、X、Y、Z、W是原子序数依次增大的四种短周期主族元素,与另外三种元素不在同一周期,原子的最外层电子数比内层电子数多3,Z与同族,由这四种元素与元素组成的化合物[化学式:]是分析化学常用的滴定剂。下列说法正确的是A、化合物M中的化合价为 B、简单离子半径: C、与形成的简单化合物的沸点: D、、的空间结构均为正四面体形
-
18、头孢羟氨苄(结构如图所示)广泛应用于敏感细菌所致的多种疾病的治疗。下列关于头孢羟氨苄的说法错误的是
 A、含有3个手性碳原子 B、需要隔绝空气密封保存 C、可与溴水发生取代反应、加成反应 D、头孢羟氨苄最多消耗
A、含有3个手性碳原子 B、需要隔绝空气密封保存 C、可与溴水发生取代反应、加成反应 D、头孢羟氨苄最多消耗 -
19、下列关于物质的结构与性质或应用的描述中错误的是A、葡萄糖可用于玻璃等材料表面化学覆银,因为葡萄糖具有还原性 B、AgCl溶于氨水,是由于AgCl与反应生成了可溶性配合物 C、比的热稳定性强,因为氨分子间存在氢键 D、利用除去HCl气体中混有的 , 可从和都是非极性分子的角度解释
-
20、根据下列事实进行类比或推理,所得出的结论正确的是
选项
事实
结论
A
热稳定性:
热稳定性:
B
NaCl晶胞中的配位数为6
CsCl晶胞中的配位数也为6
C
电负性:
氧化性:单斜硫
D
沸点:
沸点:
A、A B、B C、C D、D