相关试卷
-
1、下列实验现象,描述正确的是
 A、Ⅰ烧杯中立即产生红褐色沉淀 B、按照图Ⅱ连接好线路,发现灯泡不亮,所以硝酸钾不是电解质 C、Ⅲ是向 Ba(OH)2溶液中滴加稀硫酸,测得溶液导电能力的变化,BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电 D、Ⅳ是氧化还原反应与四种基本反应类型的关系图
A、Ⅰ烧杯中立即产生红褐色沉淀 B、按照图Ⅱ连接好线路,发现灯泡不亮,所以硝酸钾不是电解质 C、Ⅲ是向 Ba(OH)2溶液中滴加稀硫酸,测得溶液导电能力的变化,BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电 D、Ⅳ是氧化还原反应与四种基本反应类型的关系图 -
2、“探险队员”——NaHSO4溶液,不小心走进了有许多“吃人野兽”的小山(即能与硫酸氢钠发生化学反应的物质),如图所示,陷阱有多处,有人找到了一条逃生路线,即为入口→③→⑤→⑦→⑨→出口,则该线路涉及的物质为
 A、HNO3、H2O、CuSO4、Na2O2 B、Na2SO4、KNO3、HCl、FeCl3 C、MgSO4、KCl、BaCl2、CaO D、CuO、NaOH、BaCl2、Na
A、HNO3、H2O、CuSO4、Na2O2 B、Na2SO4、KNO3、HCl、FeCl3 C、MgSO4、KCl、BaCl2、CaO D、CuO、NaOH、BaCl2、Na -
3、在某无色透明的酸性溶液中,能大量共存的离子组是A、Na+、K+、、 B、Cu2+、、Cl-、K+ C、Mg2+、Ag+、、Cl- D、NO3-、Cl-、Na+、Mg2+
-
4、汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂高温条件下发生反应,生成两种无毒气体。下列说法错误的是A、上述反应的化学方程式为 B、氧化产物与还原产物的分子数之比为2∶1 C、催化转化过程,还原剂是NO,被氧化的是CO D、每生成2个CO2分子,转移4个电子
-
5、下列化学用语不正确的是A、硝酸的电离方程式:HNO3=H++ B、CaO与盐酸反应的离子方程式:CaO+2H+=Ca2++H2O C、以双氧水为原料制取O2的化学方程式:2H2O22H2O+O2↑ D、双线桥法标出氯酸钾受热分解电子转移:

-
6、下列关于钠及其化合物的叙述,正确的是A、Na2O与Na2O2都能和H2O、CO2反应,它们都是化合反应 B、向酚酞溶液中加入Na2O2粉末,溶液最终变红 C、向酚酞溶液中加入Na2O粉末,溶液最终变红 D、金属Na在空气中燃烧,发出黄色火焰,产物是Na2O
-
7、胶体最本质的特征是A、胶体粒子是不断运动的 B、可以通过滤纸 C、一定条件下会聚沉 D、分散质颗粒的直径在1nm~100nm之间
-
8、下列物质属于电解质且能导电的是A、CO2 B、熔融的NaOH C、Cu D、NaOH溶液
-
9、反应H2O+CH2+CO中,氧化剂是A、CO B、H2 C、H2O D、C
-
10、仪器名称为“坩埚"的是A、
 B、
B、 C、
C、 D、
D、
-
11、在做钠的实验时,能示意“实验中会用到锋利物品应引起注意使用方法的”的图标是A、
 B、
B、 C、
C、 D、
D、
-
12、回答下列问题。(1)、已知下列反应的热化学方程式:
① mol·L
② mol·L
③
ⅰ.反应①中,正反应活化能逆反应活化能(填“大于”“小于”或“等于”)。
ⅱ.反应③的平衡常数表达式。
(2)、硫酸在国民经济中占有极其重要的地位,下图是工业接触法制硫酸的简单流程图,回答下列有关问题。
①生产时先将黄铁矿粉碎再投入沸腾炉,目的是。
②一定温度下,在容积固定的密闭容器中发生反应:。下列选项能充分说明此反应已达到平衡状态的是。
A.密闭容器中、的物质的量之比为1∶1
B.密闭容器中压强不随时间变化而变化
C.
D.密闭容器中混合气体的平均相对分子质量不随时间变化而变化
③在实际生产过程中,控制进入接触室的气体中的体积分数是体积分数的1.5倍,其目的是:。
④实验测得反应中平衡转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是。(注:1MPa约等于10个大气压)
压强/MPa
温度/℃
0.1
0.5
1
10
400
99.2%
99.6%
99.7%
99.9%
500
93.5%
96.9%
97.8%
99.3%
600
73.7%
85.8%
89.5%
96.4%
-
13、
回答下列问题。
Ⅰ.根据表中数据,完成下列填空。
物质
HCOOH
HCN
电离常数(常温下)
(1)常温下,0.1mol/L的HCN溶液中,约为。
(2)常温下,在相同浓度的HCOOH和HCN溶液中,溶液导电能力更强的是溶液(填化学式)。根据电离平衡常数判断,以下反应不能进行的是。
A.
B.
C.
D.
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g) ΔH=-198kJ·mol-1。
(3)如图所示能正确反映平衡常数K随温度变化关系的曲线为(填曲线标记字母),其判断理由是。

(4)在一定温度下,向2.0L固定容积的密闭容器中充入2mol和1molCO,经过一段时间后,反应达到平衡。反应过程中测得的部分数据见下表:
时间/min
0
20
40
80
100
/mol
2.0
1.4
0.85
0.4
—
/mol
1.0
—
0.425
0.2
0.2
/mol
0
0.15
—
—
0.4
/mol
0
0.15
0.2875
0.4
0.4
①0~20min的平均反应速率mol·L·min。
②达到平衡时,的转化率为。
③能表明该反应达到平衡状态的是(填字母)。
A.容器中二甲醚的浓度不变 B.混合气体的平均相对分子质量不变
C.与的比值不变 D.混合气体的密度不变
-
14、某兴趣小组同学为了定量测定化学反应速率及探究影响化学平衡的因素,设计以下实验:
 (1)、利用实验Ⅰ测定锌与稀硫酸反应的速率,写出装有硫酸溶液的仪器的名称 , 需要记录的实验数据有:。(2)、利用实验Ⅱ探究浓度对化学平衡的影响。已知:(橙色)(黄色) , 推测B试管中的实验现象为: , 用平衡移动原理解释其原因:。(3)、某研究性学习小组利用溶液和酸性溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)、利用实验Ⅰ测定锌与稀硫酸反应的速率,写出装有硫酸溶液的仪器的名称 , 需要记录的实验数据有:。(2)、利用实验Ⅱ探究浓度对化学平衡的影响。已知:(橙色)(黄色) , 推测B试管中的实验现象为: , 用平衡移动原理解释其原因:。(3)、某研究性学习小组利用溶液和酸性溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号
实验温度/K
参加反应的物质
溶液颜色褪至无色时所需时间/s
溶液(含硫酸)
溶液
V/mL
c/mol·L
V/mL
c/mol·L
V/mL
A
293
2
0.02
4
0.1
0
6
B
2
0.02
3
0.1
8
C
313
2
0.02
0.1
1
t
① , 。
②通过实验A、B,可探究出浓度的改变对反应速率的影响,通过实验(实验序号)可探究出温度变化对化学反应速率的影响。
③C组实验中溶液褪色时间t(填“<”、“=”或“>”)8s。
-
15、研究大气中含硫化合物(主要是和)的转化具有重要意义。(1)、工业上采用高温热分解的方法制取 , 在膜反应器中分离 , 发生的反应为 。
已知:① ;② 。
则(用含、的式子表示)。
(2)、土壤中的微生物可将大气中的经两步反应氧化成 , 两步反应的能量变化示意图如下:
则 。1mol全部被氧化为的热化学方程式为。
(3)、通过化学键的键能可计算化学反应的反应热。已知几种共价键的键能数据如下:共价键
键能/kJ·mol
413
436
463
745
则和反应生成和气态的热化学方程式为。
(4)、利用简单碰撞理论和活化能概念可解释反应过程中的能量变化。①下列关于简单碰撞理论的说法正确的是(填字母)。
A.发生有效碰撞的分子不一定是活化分子
B.某些反应的点燃或加热条件是为了使普通分子获得能量转变为活化分子
C.基元反应的实质是活化分子有合适取向的碰撞
D.反应活化能越大,则反应过程中单位体积内的有效碰撞次数越多
②水煤气变换反应为。若无催化剂时该反应体系的相对能量随反应过程变化如图所示,则该反应的kJ/mol(用含、的代数式表示)。

-
16、在密闭容器中进行反应: , 有关下列图像的说法错误的是
 A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的 , 图c可表示升高温度使平衡向逆反应方向移动 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的
A、依据图a可判断正反应为吸热反应 B、在图b中,虚线可表示使用了催化剂 C、若正反应的 , 图c可表示升高温度使平衡向逆反应方向移动 D、由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的 -
17、已知: , 该反应分①、②两步进行,其能量曲线如图所示,下列有关说法正确的是
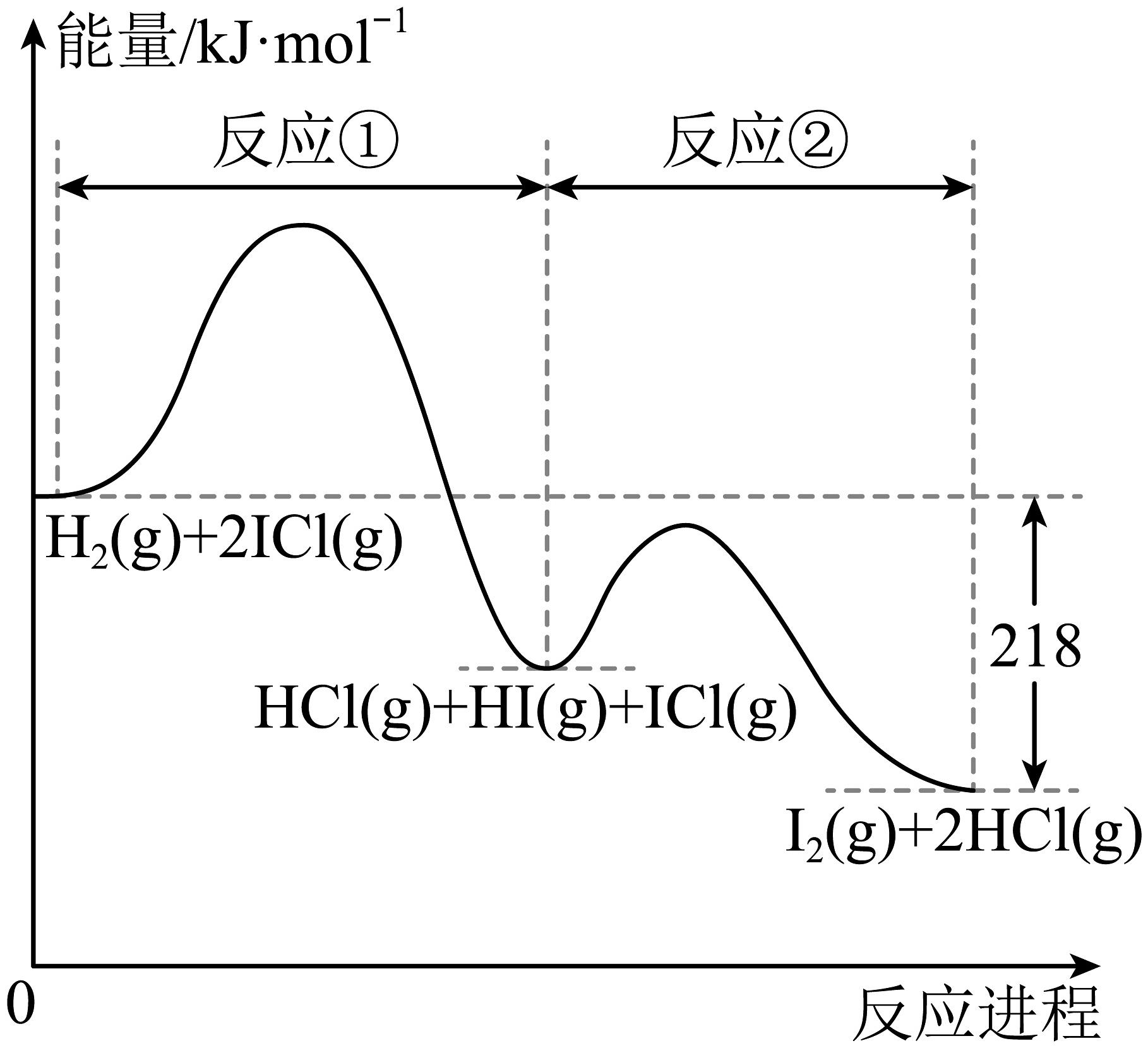 A、反应①为吸热反应,反应②为放热反应,总反应为放热反应 B、HI是该反应催化剂,起到加快反应速率的作用 C、整个反应过程共有2个基元反应,决定速率的为第①步反应 D、ICl(g)+HI(g)= I2 (g)+HCl (g) ΔH = -218kJ/mol
A、反应①为吸热反应,反应②为放热反应,总反应为放热反应 B、HI是该反应催化剂,起到加快反应速率的作用 C、整个反应过程共有2个基元反应,决定速率的为第①步反应 D、ICl(g)+HI(g)= I2 (g)+HCl (g) ΔH = -218kJ/mol -
18、已知反应。在一定条件下,向某密闭容器中加入一定量的丙烷以及足量 , 一段时间后上述反应达到平衡状态。下列叙述正确的是A、当反应达到平衡状态时, B、该反应仅在低温下自发进行 C、保持恒温恒压,再充入适量的惰性气体,的平衡转化率增大 D、保持恒温恒容,再充入适量的 , 平衡正向移动,的平衡转化率增大
-
19、时,的电离常数 , 的电离常数。下列说法正确的是A、的酸性弱于 B、的酸性弱于 C、多元弱酸第一步电离产生的对第二步电离有促进作用 D、多元弱酸的酸性主要由第二步电离决定
-
20、以下现象能用勒夏特列原理解释的是A、由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 B、往新制氯水中加入适量碳酸钙固体可以增强漂白能力 C、合成氨一般选择400~500℃进行 D、工业合成氯化氢时使用过量氢气