相关试卷
-
1、用聚合物包覆微球可制得镁基微马达(如图)。在盐酸中,微马达包覆层开口处反应排出气体使其定向运动。下列说法正确的是
 A、盐酸中存在自由移动的和 , 所以盐酸是电解质 B、反应的离子方程式为: C、反应时,做还原剂,发生氧化反应 D、在该微马达中可用替代
A、盐酸中存在自由移动的和 , 所以盐酸是电解质 B、反应的离子方程式为: C、反应时,做还原剂,发生氧化反应 D、在该微马达中可用替代 -
2、下列离子方程式书写正确的是A、银和稀盐酸反应: B、实验室制备氢氧化铁胶体: C、Ba(OH)2溶液与CuSO4溶液反应: D、氧化铁与稀盐酸反应:
-
3、下列对图示实验的分析中错误的是
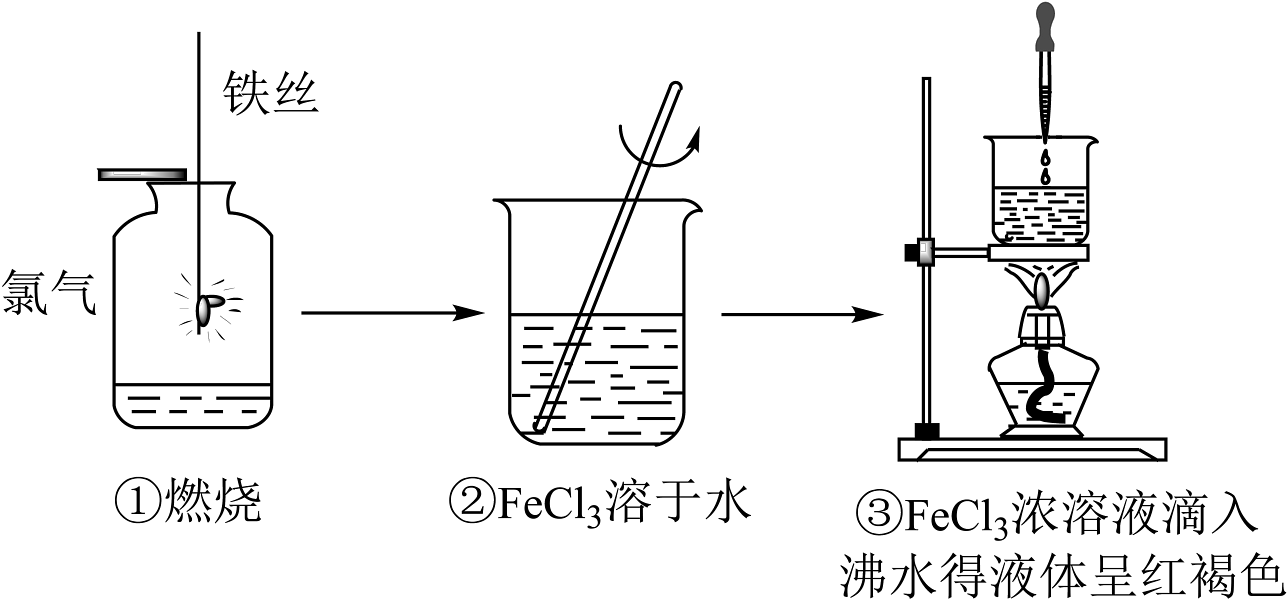 A、①中发生了氧化还原反应 B、②、③所得分散系的分散质组成不同 C、可用过滤的方法除去③中的杂质离子 D、③中得到的分散系可产生丁达尔效应
A、①中发生了氧化还原反应 B、②、③所得分散系的分散质组成不同 C、可用过滤的方法除去③中的杂质离子 D、③中得到的分散系可产生丁达尔效应 -
4、常温下,下列离子在指定的溶液中能大量共存的是A、酸性溶液中: B、无色透明溶液中: C、含有大量的溶液中: D、常温下的溶液中:
-
5、下列转化必须加入氧化剂才能实现的是A、 B、 C、 D、
-
6、将钠投入滴有紫色石蕊的水中,下列说法正确的是A、反应过程中产生“嘶嘶”的响声是因为产生了 B、反应后溶液变为红色 C、切下绿豆大小的用于实验后,剩余的钠应放回原试剂瓶 D、反应时,发生还原反应
-
7、已知可用于联合制碱。相关微粒的化学用语或性质表述正确的是A、俗名:纯碱 B、的结构示意图:
 C、该反应属于非氧化还原反应
D、的电离方程式:
C、该反应属于非氧化还原反应
D、的电离方程式:
-
8、氢化钠()在野外用作生氢剂,有关的化学反应原理为:。下列有关该反应的说法正确的是A、中H的化合价为 B、和是同素异形体 C、是还原剂,得到电子 D、转移1个电子时生成1个
-
9、下列说法正确的是A、熔融能导电,所以是电解质 B、不溶于水,所以是非电解质 C、石墨能导电,所以石墨是电解质 D、的水溶液能导电,所以是电解质
-
10、在一定条件下,实现以下物质间的转化。下列说法错误的是A、的反应发生了化合反应 B、是常见的干燥剂 C、反应④可用于实验室制备 D、上述转化过程将元素换为元素同样能实现转化
-
11、按照酸碱盐的分类,下列各组物质属于同一类别的是A、碳酸氢钠和硫酸钾 B、氢氧化钾和硝酸钾 C、硫酸和硫酸铜 D、氧化钙和碳酸钙
-
12、高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钠的方法。(1)、干法制备:制备Na2FeO4 , 反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。(已知Na2O2中氧元素化合价为-1价)。 高铁酸钠中铁的化合价是 , 当生成1个O2时,转移的电子数为个。(2)、湿法制备Na2FeO4的离子反应如下(未配平):_____Fe(OH)3+____ClO-+____OH-=____+____Cl-+____H2O 。氧化剂和还原剂的个数之比是。
-
13、如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
 (1)、A装置中盛放稀盐酸的仪器名称是。(2)、B装置可除去A装置中可能挥发出的。(3)、C装置为O2的发生装置,反应的化学方程式为、。(4)、D装置可除去C装置中未反应的少量气体,反应的离子方程式为。
(1)、A装置中盛放稀盐酸的仪器名称是。(2)、B装置可除去A装置中可能挥发出的。(3)、C装置为O2的发生装置,反应的化学方程式为、。(4)、D装置可除去C装置中未反应的少量气体,反应的离子方程式为。 -
14、根据下列物质间的转化关系,回答下列问题:
 (1)、上述反应中属于氧化还原反应的是(填序号)。(2)、分别写出④⑤反应的离子方程式:
(1)、上述反应中属于氧化还原反应的是(填序号)。(2)、分别写出④⑤反应的离子方程式:④。
⑤。
(3)、碳酸钙是牙膏中常用的摩擦剂,甲乙丙三位同学用石灰石来制备,分别设计以下方案。甲:⑥→⑦→⑧; 乙:④→⑤; 丙:⑥→⑦→⑨→⑤
下列说法不正确的是________。
A、乙方案的优点是反应步骤少,节约能源 B、CaO俗称生石灰,属于碱性氧化物,是一种常用固体干燥剂的主要成分 C、⑤中反应也可以向CaCl2溶液中通入CO2制备CaCO3 D、Ca(OH)2俗称熟石灰,⑧中反应也可以向澄清石灰水中通入足量CO2制备CaCO3 -
15、某同学利用Fe、CuO、H2SO4制备CuSO4 , 制备路线及相关物质之间的转化关系如图所示,回答下列问题:
 (1)、B的名称为。(2)、写出C→A反应的离子方程式:。(3)、写出A的电离方程方程式:。(4)、写出C→ Cu的化学方程式并用双线桥法标出电子转移的方向和数目:。
(1)、B的名称为。(2)、写出C→A反应的离子方程式:。(3)、写出A的电离方程方程式:。(4)、写出C→ Cu的化学方程式并用双线桥法标出电子转移的方向和数目:。 -
16、请回答:
现有下列六种物质:①O2;②Na;③O3;④Fe(OH)3胶体;⑤FeCl3溶液;⑥Ba(OH)2
(1)、属于电解质的是(填相应序号)。(2)、①和③互称为。(3)、鉴别④和⑤的方法是。(4)、②与水反应的化学反应方程式为。 -
17、以不同类别物质间的转化为线索认识钠及其化合物。

下列分析不正确的是
A、反应③表明CO2具有酸性氧化物的性质 B、反应④说明Na2O2属于碱性氧化物 C、反应④、⑤中,只有Na2O2中氧元素的化合价发生变化 D、上述转化中发生的反应有化合反应、置换反应 -
18、下列学习栏目与示例对应关系不匹配的是
选项
学习栏目
示例
A
方法导引
分类:根据物质的组成进行分类,可以预测物质的性质及可能发生的变化
B
化学与职业
化学科研工作者:研究具有特定功能的新分子的合成,应承担重要的职责
C
科学史话
氧化还原反应概念的发展:人们对知识的认识要经历一个过程,由浅入深是不断发展的
D
探究钠与水的反应
通过变量控制,预测钠与水反应的生成物
A、A B、B C、C D、D -
19、单质到盐的转化关系可表示为:

下述转化关系不正确的是
A、MgMgOMgCl2MgSO4 B、NaNa2ONaOHCH3COONa C、CCO2H2CO3Na2CO3 D、SSO2H2SO3CaSO3 -
20、下列基本实验操作中,不合理的是A、中学实验室中可以将未用完的钠放回原试剂瓶 B、用红色激光笔照射胶体时,在与光束垂直的方向进行观察 C、稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水 D、坩埚可用酒精灯直接加热