相关试卷
-
1、下列说法不能用勒夏特列原理解释的是A、氯水中有平衡:Cl2+H2OHCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 B、对CO(g)+NO2(g)CO2(g)+NO(g),平衡体系增大压强可使颜色变深 C、配制Fe2(SO4)3溶液时,需要加入少量稀硫酸 D、高压比常压条件更有利于合成氨的反应
-
2、向A、B两试管中加入等量H2O2溶液,然后再向B中滴入几滴FeCl3溶液,其反应历程如图:

I.H2O2+2Fe3+=2Fe2++2H++O2↑
II.H2O2+2Fe2++2H+=2Fe3++2H2O
下列说法不正确的是
A、曲线②是滴加了FeCl3溶液的反应过程,Fe3+改变了H2O2分解反应的历程 B、Fe3+是催化剂;Fe2+是中间产物 C、E1、E2分别是反应I、II的活化能,反应I的速率大于反应II的速率 D、催化剂能降低反应的活化能,提高反应物分子中活化分子百分数 -
3、中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如图:

下列说法正确的是
A、过程Ⅰ、过程Ⅲ均为放热过程 B、图示过程中的H2O均参与了反应过程 C、使用催化剂降低了水煤气变换反应的ΔH D、过程Ⅲ只生成了H2O、O2 -
4、某化学小组欲探究不同条件对化学反应速率的影响,分组进行了如下实验。已知:(30℃及以下,双氧水具有较好的稳定性;忽略溶液体积变化)下列说法不正确的是
编号
0.1 mol·L-1酸性KMnO4溶液体积/mL
1 mol·L-1 H2O2溶液体积/mL
水的体积/mL
反应温度/℃
紫色褪去所用的时间/s
Ⅰ
20
20
0
20
t1
Ⅱ
20
V1
10
20
t2
Ⅲ
20
V2
0
30
t3
Ⅳ
20
10
10
30
t4
A、V1=10,V2=20 B、各组实验充分反应后,产生的氧气的体积均为0.112 L(标准状况下) C、实验Ⅰ和Ⅲ、Ⅱ和Ⅳ均可探究温度对反应速率的影响 D、t1<t4 , 说明浓度越大,反应速率越快 -
5、下列物质属于弱电解质的是A、蔗糖 B、CH3COOH C、BaSO4 D、Cu
-
6、已知下列热化学方程式:
①
②
③
则反应的(单位:kJ·mol-1)为
A、 B、 C、 D、 -
7、下列有关反应热的描述中正确的是A、S(g)+O2(g)=SO2(g) ΔH1 , S(s)+O2(g)=SO2(g) ΔH2 , 则ΔH1<ΔH2 B、H2的燃烧热为285.8kJ•mol-1 , 则H2燃烧的热化学方程式可表示为2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ•mol-1 C、H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ•mol-1 , 则NaOH稀溶液与CH3COOH稀溶液反应生成1molH2O(l)时放出的热量为57.3kJ D、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ•mol-1 , 则反应物的总能量小于生成物的总能量
-
8、以熔融盐为电解液,以含和等的铝合金废料为阳极进行电解,实现的再生。该过程中A、阴极发生的反应为 B、阴极上被氧化 C、在电解槽底部产生含的阳极泥 D、阳极和阴极的质量变化相等
-
9、
电解食盐水可以制备烧碱、次氯酸钠消毒液等。
【用途一】制备烧碱
(1)离子交换膜法电解饱和食盐水原理示意图如图1。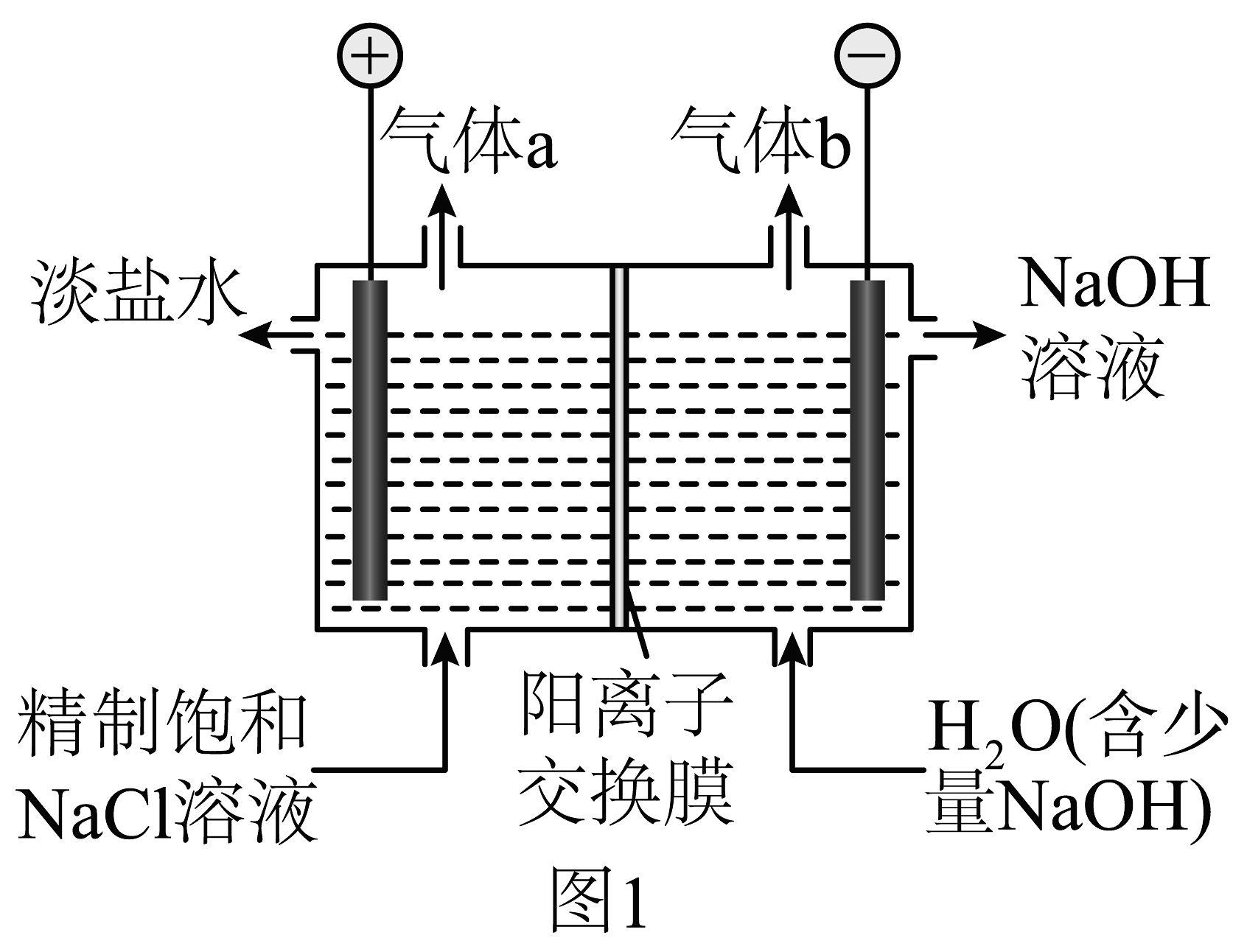
①气体a的电子式为:。
②结合电极反应式解释阴极区得到溶液的原因。
【用途二】制备次氯酸钠溶液
采用无隔膜电解槽,电解3%~5%的溶液,可制备溶液。控制较低温度,适宜电压电解制备溶液原理示意图如图2。
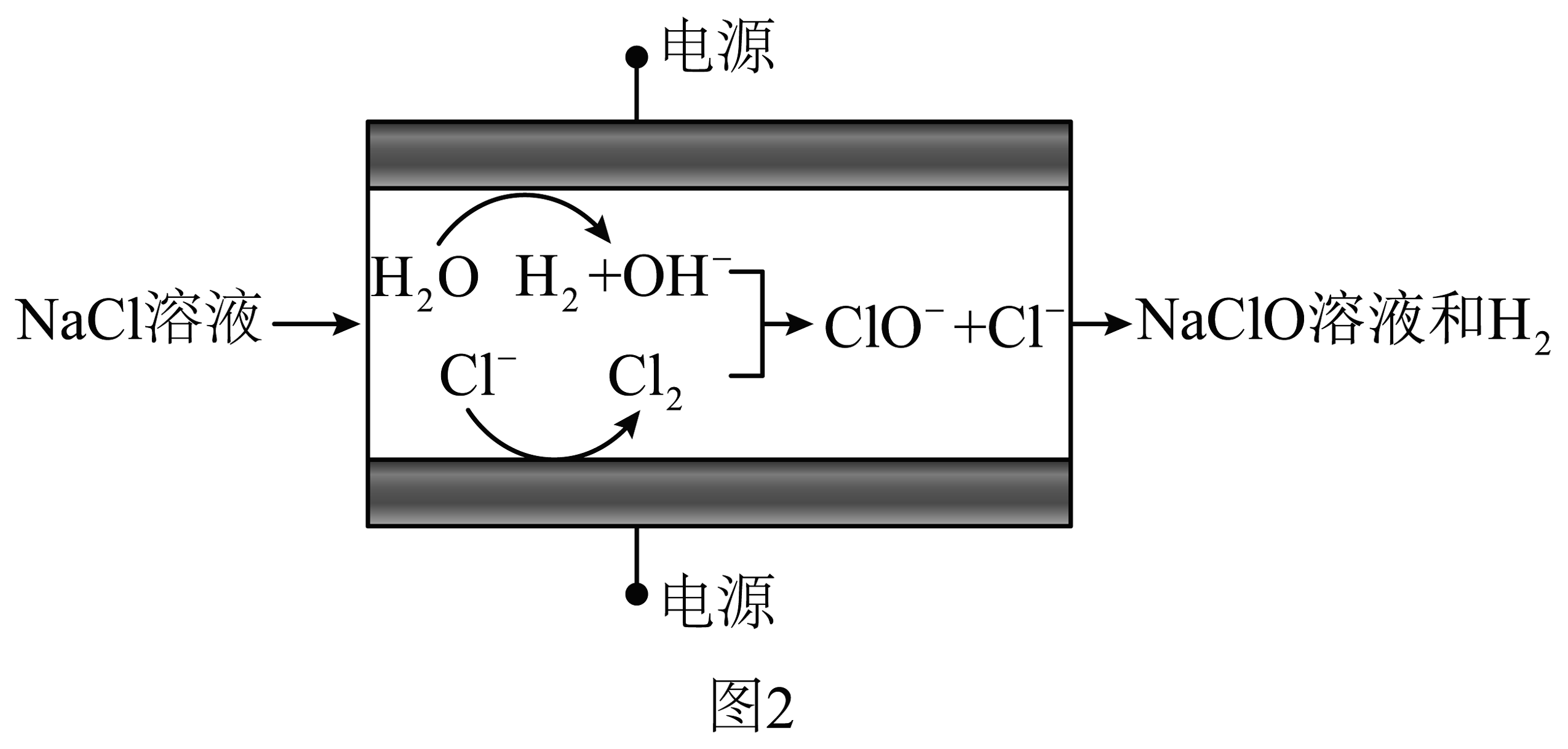
已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
(2)电解食盐水制备溶液总反应的化学方程式为。(3)研究发现,电解制备溶液时,中性溶液为宜,若初始过高()或过低()都会降低的浓度。分析可能原因:①过高,阳极会发生放电,导致电解效率降低,电极反应为。
②过低,产生影响的可能原因:
假设过低时,导致溶解度 , 生成的减少。
假设过低时,浓度增大氧化 , 生成和。
I.查阅文献,假设b成立。相应反应的离子方程式为。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液,。可供选择的试剂和仪器:a.稀硫酸 b.稀盐酸 c.石蕊溶液 d.计
-
10、
铅酸蓄电池(如图)的电压稳定、使用方便、安全可靠、价格低廉而使用广泛。
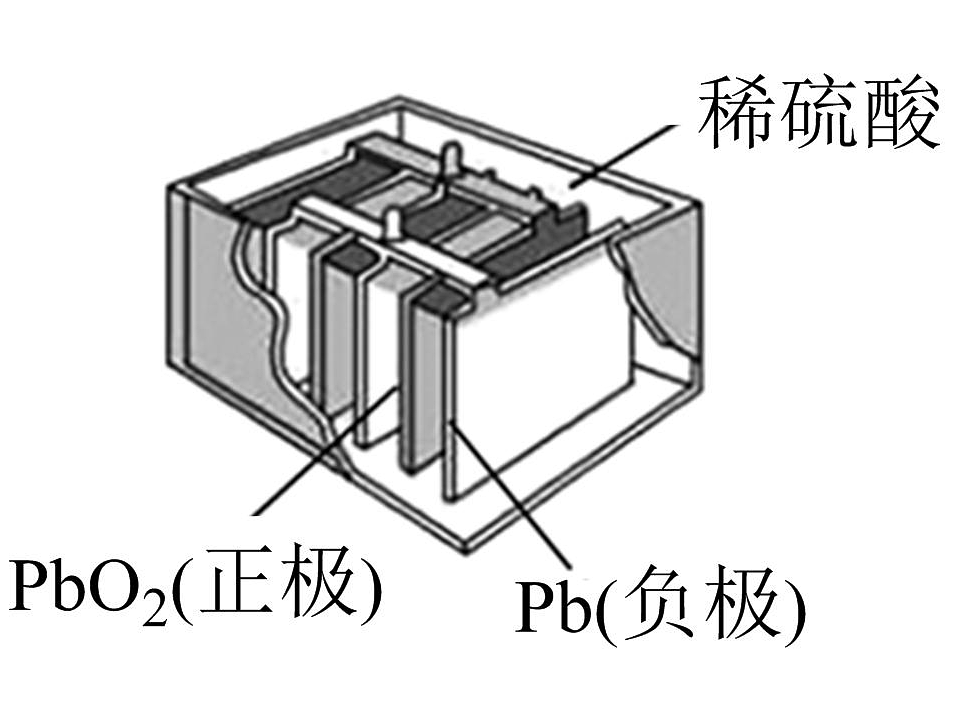
I.
(1)写出电池使用过程中的两个电极反应方程式:负极; 正极。
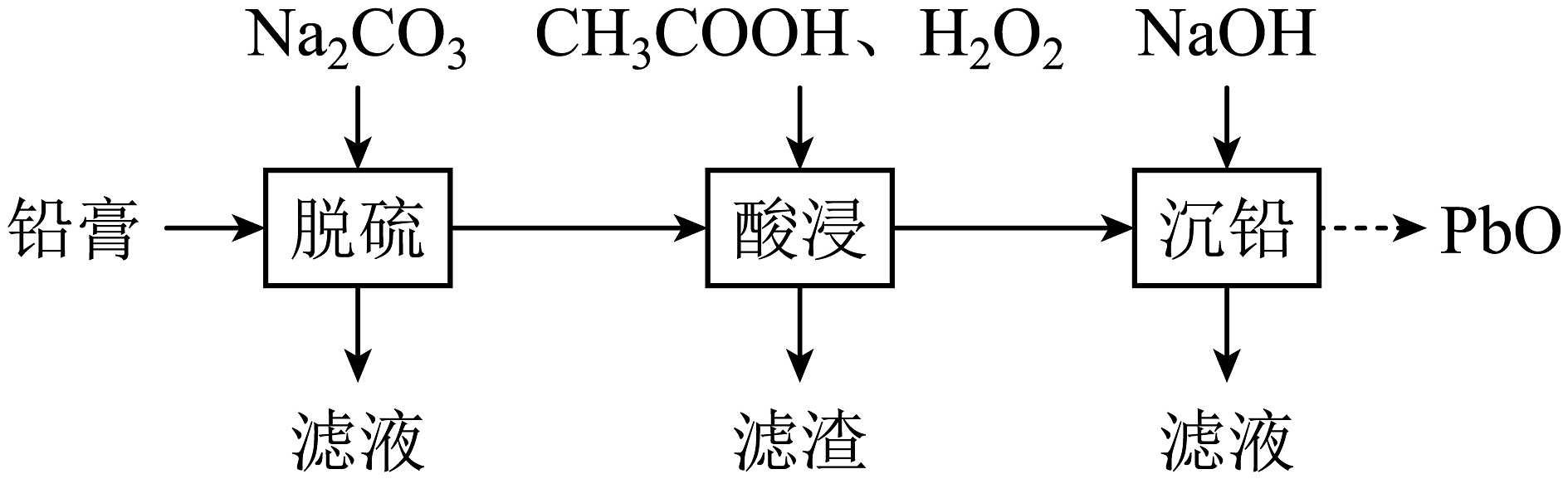
II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、、PbO和Pb,还有少量、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH
2.3
6.8
3.5
7.2
完全沉淀的pH
3.2
8.3
4.6
9.1
回答下列问题:
(2)在“脱硫”中转化反应的离子方程式为;饱和溶液中。(3)在“脱硫”中,加入不能使铅膏中完全转化,原因是。(4)在“酸浸”中,除加入醋酸(),还要加入。①能被氧化的离子是;
②促进了金属Pb在醋酸中转化为 , 其化学方程式为。
③也能使转化为 , 的作用是。
(5)“酸浸”后溶液的pH应控制在(填范围),滤渣的主要成分是(填化学式)。 -
11、
探究化学反应的快慢和限度具有十分重要的意义。
Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:
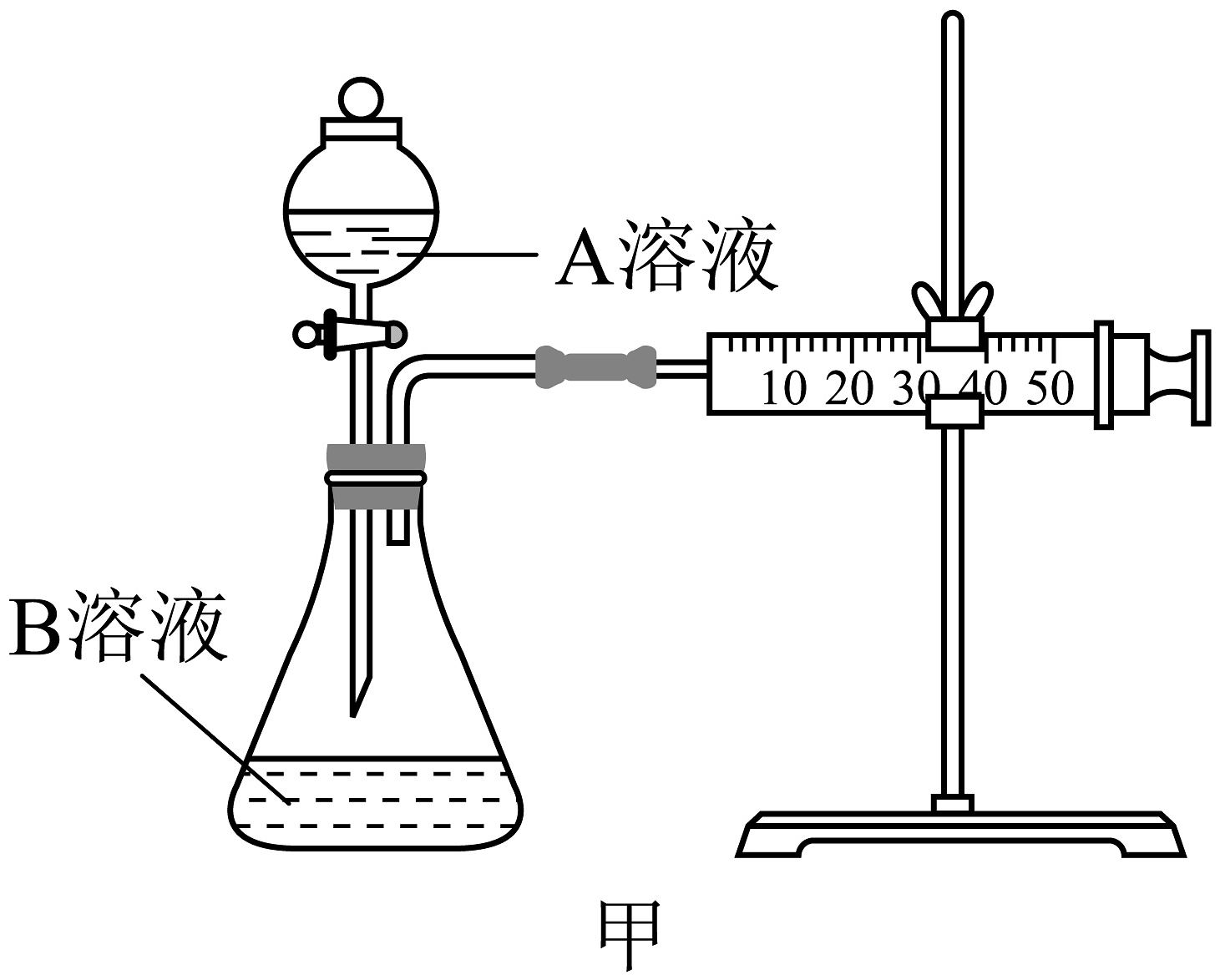
实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
(1)完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。(2)若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①该反应是放热反应:②。
Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:
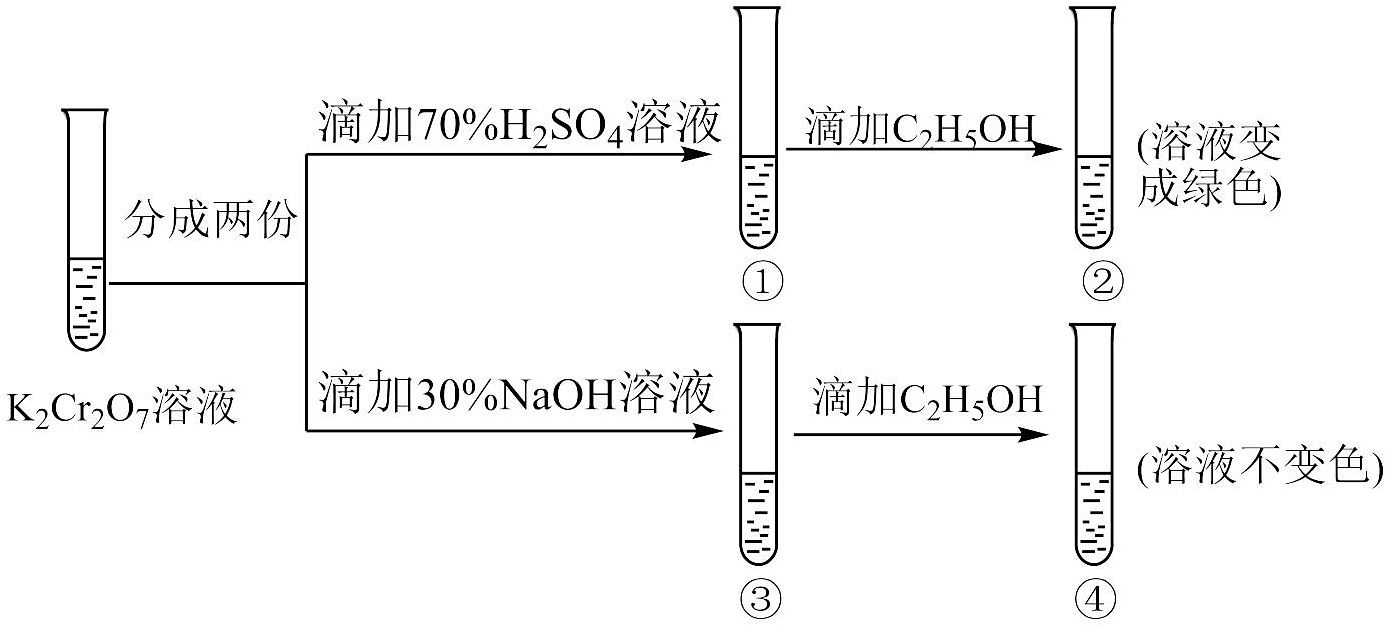 (4)向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
(4)向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。 -
12、硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中,制取的反应为 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
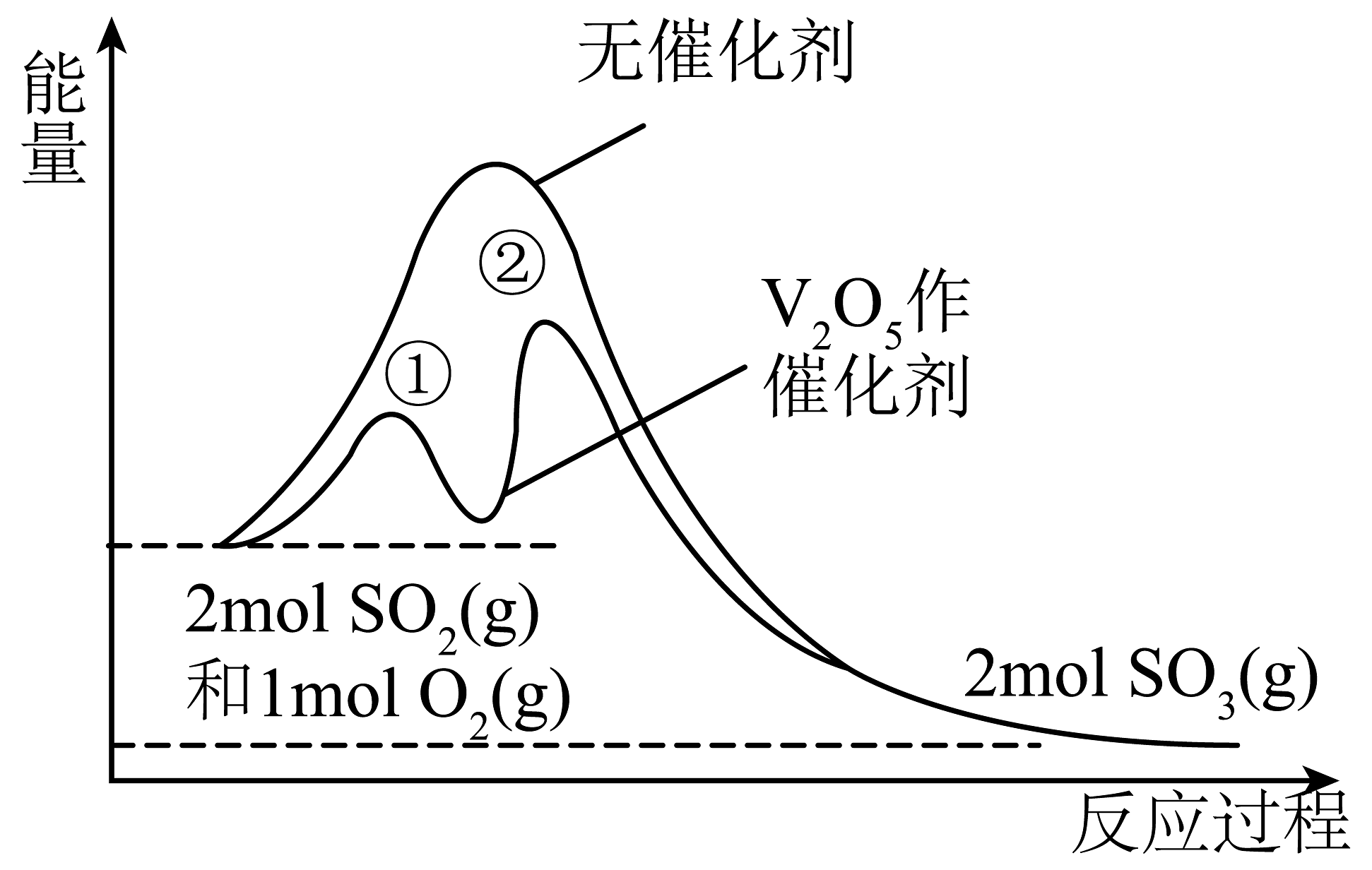 A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、
A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、 -
13、游泳池水普遍存在尿素超标现象,一种电化学除游泳池中尿素的实验装置如下图所示,其中钌钛用作析氯电极,不参与电解。除尿素的反应为: , 下列说法正确的是
 A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近增大 D、电解过程中每逸出 , 电路中至少通过电子
A、电解过程中不锈钢电极会缓慢发生腐蚀 B、电解过程中钌钛电极上发生反应为 C、电解过程中不锈钢电极附近增大 D、电解过程中每逸出 , 电路中至少通过电子 -
14、20世纪初,德国化学家哈伯首次用锇作催化剂在、550℃的条件下以和为原料合成了: 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。一种电化学气敏传感器可以检测生产中氨气的含量,其工作原理如图所示。下列说法正确的是
 A、溶液中向电极a移动 B、电极a的电极反应式为 C、在传感器工作一定时间后中电极b周围溶液pH减小 D、当电极b消耗标准状况下 16.8L 时,理论上电极a检测到17g
A、溶液中向电极a移动 B、电极a的电极反应式为 C、在传感器工作一定时间后中电极b周围溶液pH减小 D、当电极b消耗标准状况下 16.8L 时,理论上电极a检测到17g -
15、工业合成氨是人类科学技术的一项重大突破。其合成原理为: , 下列说法不正确的是A、增大压强,活化分子百分含量不变,单位体积内活化分子增多,反应速率加快 B、该反应在低温下能自发进行 C、为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化 D、能用勒夏特列原理解释通常采用500℃有利于氨的合成
-
16、在硫酸工业中,在催化剂条件下使氧化为: 。下表列出了在不同温度和压强下,反应达到平衡时的转化率。下列说法正确的是
温度
平衡时的转化率
450
97.5
98.9
99.2
99.6
99.7
550
85.6
92.9
94.9
97.7
98.3
A、该反应在任何条件下均能自发进行 B、实际生产中,最适宜的条件是温度450℃、压强 C、使用催化剂可加快反应速率,提高的平衡产率 D、为提高的转化率,应适当充入过量的空气 -
17、在一定条件下,反应 达到平衡后,改变条件,正、逆反应速率随时间的变化如图,下列说法正确的是
 A、图①改变的条件是升高温度,达到新平衡后的转化率减小 B、图②改变的条件可能是增大的浓度,达到新平衡后的转化率增大 C、图③改变的条件可能是减小的浓度,达到新平衡后的转化率减小 D、图④改变的条件是增大压强,达到新平衡后的转化率不变
A、图①改变的条件是升高温度,达到新平衡后的转化率减小 B、图②改变的条件可能是增大的浓度,达到新平衡后的转化率增大 C、图③改变的条件可能是减小的浓度,达到新平衡后的转化率减小 D、图④改变的条件是增大压强,达到新平衡后的转化率不变 -
18、反应X+Y=M+N的能量变化关系如图所示。下列关于该反应的说法中,正确的是
 A、X的能量一定低于M的,Y的能量一定低于N的 B、X、Y的总能量一定低于M、N的总能量 C、因为该反应为吸热反应,故一定要加热才可发生 D、断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量
A、X的能量一定低于M的,Y的能量一定低于N的 B、X、Y的总能量一定低于M、N的总能量 C、因为该反应为吸热反应,故一定要加热才可发生 D、断裂X、Y的化学键所吸收的能量小于形成M、N的化学键所放出的能量 -
19、酮基布洛芬是用于治疗各种关节肿痛及牙痛、术后痛等的非处方药。其合成路线如下:
 (1)、A的名称是。(2)、化合物F是酮基布洛芬的同分异构体,符合下列条件的化合物F的结构简式为(写一种)。
(1)、A的名称是。(2)、化合物F是酮基布洛芬的同分异构体,符合下列条件的化合物F的结构简式为(写一种)。①既能发生银镜反应,也能发生水解反应。
②苯环上的侧链数目最多为2。
(3)、根据化合物的结构特征,分析预测其部分化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
①
②
b
金属钠
③
置换反应
(4)、下列说法中,正确的有_______。A、化合物和均属于芳香族化合物 B、反应②过程中,有键断裂和单键形成 C、化合物中存在以“头碰头”方式形成的键 D、化合物所有原子可能在一个平面上(5)、以对二甲苯( )和苯为含碳原料,利用反应③和④的原理,合成化合物(如下图所示)。
)和苯为含碳原料,利用反应③和④的原理,合成化合物(如下图所示)。
基于合成路线,回答下列问题:
①从对二甲苯出发,第一步的反应条件为酸性溶液,有机产物的结构简式为。
②碳骨架增长步骤的化学方程式为。
③最后一步生成的反应类型为。
-
20、赤泥是氧化铝生产排放的固体废弃物。由赤泥(主要成分为、、、、、等)制备一种高效净水剂聚合硫酸铝铁()的工艺流程如下:

已知①室温时部分阳离子以氢氧化物形式沉淀时溶液的如下表所示。
②沉淀完全时离子浓度。
沉淀物
开始沉淀
5.4
4.0
2.7
5.8
沉淀完全
6.7
5.2
3.7
8.8
(1)、基态铝原子的核外电子排布式为 , 的空间构型是。(2)、“焙烧”时,需将赤泥粉碎的目的是。(3)、酸浸渣的主要成分是(填化学式)。(4)、“氧化”时发生反应的离子方程式为。室温下,向氧化后的溶液中滴加溶液至时,溶液中的。(5)、为了测试所制得的聚合硫酸铝铁的性能,取某水样在不同条件下加入【】并测定其去浊率,结果如下图所示。(已知去浊率越高,净水效果越好)由图可知在设定的偏酸性和偏碱性条件下,水样的去浊率均不高。试分析时,去浊率较低的可能原因为。 (6)、一种碳溶解在铁单质中形成合金的晶胞如下图所示,则该物质的化学式为 , 若晶体密度为 , 则晶胞中最近的两个碳原子的距离为(阿伏加德罗常数的值用表示,写出计算式即可)。
(6)、一种碳溶解在铁单质中形成合金的晶胞如下图所示,则该物质的化学式为 , 若晶体密度为 , 则晶胞中最近的两个碳原子的距离为(阿伏加德罗常数的值用表示,写出计算式即可)。