相关试卷
-
1、设为阿伏加德罗常数的值,下列说法正确的是A、25℃时,的醋酸溶液中,所含的数目等于 B、常温下,1L的溶液中,发生电离的水分子数为 C、向1L0.1mol/L溶液中通氨气至中性,数目为 D、0.1mol和0.1mol于密闭容器中充分反应后,容器内分子总数小于
-
2、化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
 A、甲中移向铜电极 B、乙中正极反应式为: C、丙中锌筒作负极,发生氧化反应,锌筒会变薄 D、丁使用一段时间后电解质溶液的酸性减弱
A、甲中移向铜电极 B、乙中正极反应式为: C、丙中锌筒作负极,发生氧化反应,锌筒会变薄 D、丁使用一段时间后电解质溶液的酸性减弱 -
3、短周期元素X、Y、Z、W在元素周期表中的位置如图所示,若W原子最外层电子数是其内层电子总数的0.6倍。下列说法中,正确的是
 A、Y只有两种氧化物 B、简单氢化物的沸点:Z>Y C、原子半径由大到小的排列顺序:Z>Y>X D、元素X是自然界中形成化合物种类最多的元素
A、Y只有两种氧化物 B、简单氢化物的沸点:Z>Y C、原子半径由大到小的排列顺序:Z>Y>X D、元素X是自然界中形成化合物种类最多的元素 -
4、实验室利用固体和固体反应制氨气,反应的化学方程式为 , 下列关于该反应的说法错误的是A、中存在离子键和极性键 B、此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成 C、标准状况下,11.2L含有1.5mol D、的热稳定性比NH3强,是由于H2O的分子间作用力较大
-
5、下列针对有机物除杂方法(括号内为杂质)正确的是A、乙醇(水)加新制的生石灰,过滤 B、乙烷(乙烯)通过溴的四氯化碳溶液,洗气 C、乙醇(丙烯)酸性溶液洗气 D、乙酸乙酯(乙酸)加饱和溶液,振荡静置后分液
-
6、硫酸铵在加热条件下分解,生成NH3、SO2、N2和H2O,反应中生成的氧化产物和还原产物的物质的量之比为( )A、1:3 B、2:3 C、1:1 D、4:3
-
7、下列说法正确的是A、与互为同位素 B、碳纳米管和富勒烯互为同素异形体 C、与一定互为同系物 D、纤维素与淀粉互为同分异构体
-
8、下列化学用语或表达式正确的是A、羟基的电子式:
 B、乙酸乙酯的结构简式:
C、石膏的化学式:
D、的原子结构示意图:
B、乙酸乙酯的结构简式:
C、石膏的化学式:
D、的原子结构示意图: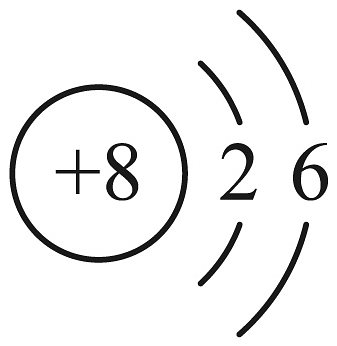
-
9、下列属于弱电解质的是A、蔗糖 B、冰醋酸 C、氨水 D、氯化钠
-
10、下列溶液因水解呈酸性的是A、 B、 C、 D、
-
11、1,3-丁二烯(X)与发生两种加成反应:1,2-加成和1,4-加成,均为放热反应,其中,1,2-加成产物用Y表示,1,4-加成产物用Z表示。40℃时,在密闭容器中充入一定量的和 , 测得各气体浓度与反应时间的关系、能量变化如图所示。下列说法正确的是
 A、1,2-加成产物比1,4-加成产物稳定 B、达平衡时,升高温度,产物中1,4-加成产物含量降低 C、1,2-加成产物转化为1,4-加成产物的反应为吸热反应 D、40℃时,生成1,2-加成产物的活化能大于生成1,4-加成产物的活化能
A、1,2-加成产物比1,4-加成产物稳定 B、达平衡时,升高温度,产物中1,4-加成产物含量降低 C、1,2-加成产物转化为1,4-加成产物的反应为吸热反应 D、40℃时,生成1,2-加成产物的活化能大于生成1,4-加成产物的活化能 -
12、燃料电池的能量利用率高,肼燃料电池原理如图所示。下列有关说法不正确的是
 A、电极为正极 B、将由电极区向电极区移动 C、用该电池电解饱和食盐水,当消耗时,可产生标准状况下的 D、电极的电极反应式为
A、电极为正极 B、将由电极区向电极区移动 C、用该电池电解饱和食盐水,当消耗时,可产生标准状况下的 D、电极的电极反应式为 -
13、金属的腐蚀与防护和生活密切相关。下列有关说法正确的是
 A、铜器在弱酸性环境中表面生成铜绿发生的是析氢腐蚀 B、如上图装置,一段时间后向三颈烧瓶中加入溶液,溶液未变红,说明铁被保护 C、如上图装置,开始一段时间内压强传感器测得压强几乎未发生变化,说明镀锌铁皮未发生腐蚀 D、采油平台的钢铁构筑物与外接电源的负极相连叫外加电流保护法
A、铜器在弱酸性环境中表面生成铜绿发生的是析氢腐蚀 B、如上图装置,一段时间后向三颈烧瓶中加入溶液,溶液未变红,说明铁被保护 C、如上图装置,开始一段时间内压强传感器测得压强几乎未发生变化,说明镀锌铁皮未发生腐蚀 D、采油平台的钢铁构筑物与外接电源的负极相连叫外加电流保护法 -
14、为探究新制氯水的性质,某学生做了如下实验。
实验
装置
试剂a
现象
①

紫色的石蕊试液
溶液先变红后褪色
②
NaHCO3溶液
产生气泡
③
HNO3酸化的AgNO3溶液
产生白色沉淀
④
KI溶液、淀粉溶液
溶液变蓝
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是
A、实验①说明新制氯水中含有H+、HClO B、实验②发生的反应为:HCO+HClO=ClO-+CO2↑+H2O C、实验③说明新制氯水中有Cl-:Cl-+Ag+=AgCl↓ D、实验④说明水合氯分子具有强氧化性:Cl2+2I-=2Cl-+I2 -
15、利用木质纤维素、CO2合成聚碳酸对二甲苯酚的路线如下,回答下列问题:
 (1)、化合物Ⅰ的分子式为 , 写出其中一种官能团的名称。(2)、对化合物Ⅱ,分析预测其可能的化学性质,完成下表。
(1)、化合物Ⅰ的分子式为 , 写出其中一种官能团的名称。(2)、对化合物Ⅱ,分析预测其可能的化学性质,完成下表。序号
反应试剂
反应产物
反应类型
①

②
H2
(3)、化合物Ⅲ到化合物Ⅳ的反应是原子利用率100%的反应,且1molⅢ与1mol化合物a反应得到1mol Ⅳ。则化合物a的名称为。(4)、已知化合物V的核磁共振氢谱有2组峰。且峰面积之比为2:3,写出化合物V的结构简式:。(5)、关于Ⅶ生成Ⅷ的反应的说法中,不正确的有_______。A、反应过程中,有H-O键断裂 B、反应过程中,有C=O双键和C-O单键形成 C、该反应为缩聚反应 D、CO2属于极性分子,分子中存在π键(6)、参考Ⅶ生成Ⅷ的反应,以丙烯为唯一有机原料,合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:①第二步反应的化学方程式为(注明反应条件)。
②最后一步反应的化学方程式为(注明反应条件)。
-
16、“氢能源”的开发利用意义重大,乙醇与水催化重整制“氢”发生如下反应。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)、反应Ⅰ的ΔH1=。(2)、①一定条件下,在某恒容密闭容器中,只发生反应Ⅱ.下列能够说明该反应已达到化学平衡状态的是(填标号)A. B.混合气体的密度不再变化
C.容器内总压强不再变化 D.混合气体中H2的浓度不变
②反应Ⅱ的速率 , 其中分别为正、逆反应速率常数。升温时(填“增大”“减小”或“不变”)。
(3)、压强为100kPa下,1molC2H5OH(g)和3mol H2O(g)发生上述反应,平衡时CO2和CO的选择性、乙醇的转化率(曲线b)随温度的变化曲线如图。
[已知:]。
①表示CO选择性的曲线是(填标号)。
②573K时,生成CO2的物质的量为。
③573K时,反应Ⅱ的标准平衡常数 , 其中pθ为100kPa,p(CO2)、p(H2)、p(CO)和p(H2O)为各组分的平衡分压,则反应Ⅲ的Kθ=(列出计算式即可)。
(4)、压强为100kPa,H2的平衡产率与温度、起始时的关系如图所示,每条曲线表示H2相同的平衡产率。H2的平衡产率:Q点N点(填“>”、“=”或“<”)。
-
17、第五、六周期元素硒、碲是重要的稀散氧族元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量Cu、Pb等元素)分离硒回收碲的工艺流程如下:

已知:①“水浸液”的主要成分为Na2TeO3、Na2SeO3及少量可溶性的铜、铅化合物等。“酸浸液”中硒主要以亚硒酸的形式存在。
②TeO2为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,Ka1=2.7×10-3、Ka2=2.5×10-8。
回答下列问题:
(1)、基态Te原子价层电子排布式为。的Se原子杂化类型为 , SeO3空间构型为。(2)、“除杂渣”的主要成分为、PbS。(3)、“中和”时控制pH为4~5,生成TeO2沉淀,若硫酸过量,将导致Te的回收率下降的原因是。(4)、若控制“酸浸液”的pH为2,此时溶液中=。(5)、“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式。(6)、氮化镓也是一种优良的半导体材料,GaN晶体的一种立方晶胞如图所示。该晶体中与Ga原子距离最近且相等的N原子个数为。该晶体密度为 , GaN的式量为 , 则晶胞边长为nm(列出计算式,NA为阿伏加德罗常数的值)。
-
18、
Fe3O4作为很有发展前景的磁性材料,在微波吸收材料、催化剂载体、细胞分离、磁记录材料、磁流体、医药等领域有广泛的应用。
Ⅰ、甲实验小组利用如下装置制备Fe3O4。

(1)在加入试剂之前,需对A、B装置进行气密性检查:如图组装好装置,用止水夹夹紧B、C间橡胶管, , 塞紧分液漏斗上口玻璃塞,打开玻璃旋塞,过一会儿,水不再下滴,说明装置A、B的气密性良好。
(2)写出B装置仪器的名称 , D中反应的化学方程式。
(3)将实验制备的产物溶于稀硫酸,欲验证所得溶液中含有可加入试剂。
Ⅱ、乙实验小组制备Fe3O4流程如下图所示:

(4)副产品P是(填写化学式),由溶液N获得该副产品的操作是:。
加热浓缩→冷却结晶→_______→_______→晶体加热至完全失去结晶水。
(5)小组实验前利用酸性高锰酸钾测定绿矾的纯度:称取3.0g工业绿矾,配制成250.00mL溶液。量取25.00mL溶液于锥形瓶中,用0.01000酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00mL。写出滴定时发生反应的离子方程式为;绿矾的纯度为。(保留3位有效数字)
-
19、CO和N2O在Fe+作用下转化为N2和CO2 , 反应的能量变化及反应历程如图所示,两步基元反应:① K1 , ② K2。下列说法不正确的是
 A、该反应ΔH<0 B、两步反应中,决定总反应速率的是反应① C、升高温度,可提高N2O的平衡转化率 D、增大了活化分子百分数,加快了化学反应速率,但不改变反应的ΔH
A、该反应ΔH<0 B、两步反应中,决定总反应速率的是反应① C、升高温度,可提高N2O的平衡转化率 D、增大了活化分子百分数,加快了化学反应速率,但不改变反应的ΔH -
20、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
酸性:CBr3COOH>CCl3COOH
电负性:Br<Cl
B
碳酸氢钠用作面团膨松剂
碳酸氢钠可以与碱反应
C
工业生产中用ZnS除去废水中的Cu2+
溶度积:Ksp(ZnS)>Ksp(CuS)
D
将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝会变红色
乙醇具有氧化性
A、A B、B C、C D、D