相关试卷
-
1、下列说法中正确的是A、“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 B、已知酸性: , 则等浓度等体积的和溶液中离子总数,前者大于后者 C、用玻璃棒蘸取新制氯水滴在试纸上,测定氯水的 D、的稀硫酸与的溶液混合,溶液呈中性,则
-
2、化学与生产、生活密切相关,下列说法正确的是A、液化石油气可由石油分馏获得,汽油可由石油分馏或石油裂解获得 B、棉、蚕丝及天然橡胶完全燃烧都只生成和 C、和都能用于治疗胃酸过多 D、与和均能反应产生 , 所以可作为潜艇供氧剂
-
3、
“低碳经济”已成为全世界科学家研究的重要课题,为减小和消除对环境的影响,实际生活生产中有很多种处理方案。
方案一:将与反应合成甲醇,制备甲醇燃料电池。制备甲醇的过程可能涉及的反应如下:
反应Ⅰ: kJ/mol
反应Ⅱ: kJ/mol
反应Ⅲ:
(1)根据以上反应,求________,反应Ⅰ自发进行的原因是________。(2)下列描述正确的是_______。A. 在绝热恒容密闭容器中只进行反应Ⅱ,若压强不变,能说明反应Ⅱ达到平衡状态 B. 反应Ⅱ化学方程式前后物质的化学计量数之和相等,所以反应Ⅱ的等于零 C. 恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大 D. 上述反应达到平衡后,升温,反应Ⅰ逆反应速率一直增大直至达到新的平衡 (3)一定条件下,在2L的密闭容器中仅发生反应Ⅰ,起始物 , 和的浓度随时间变化如图1所示,平衡时的体积分数为________;若保持其它反应条件不变,起始时仅将容器体积变为3L,请在图1上画出的浓度随时间变化的趋势图________。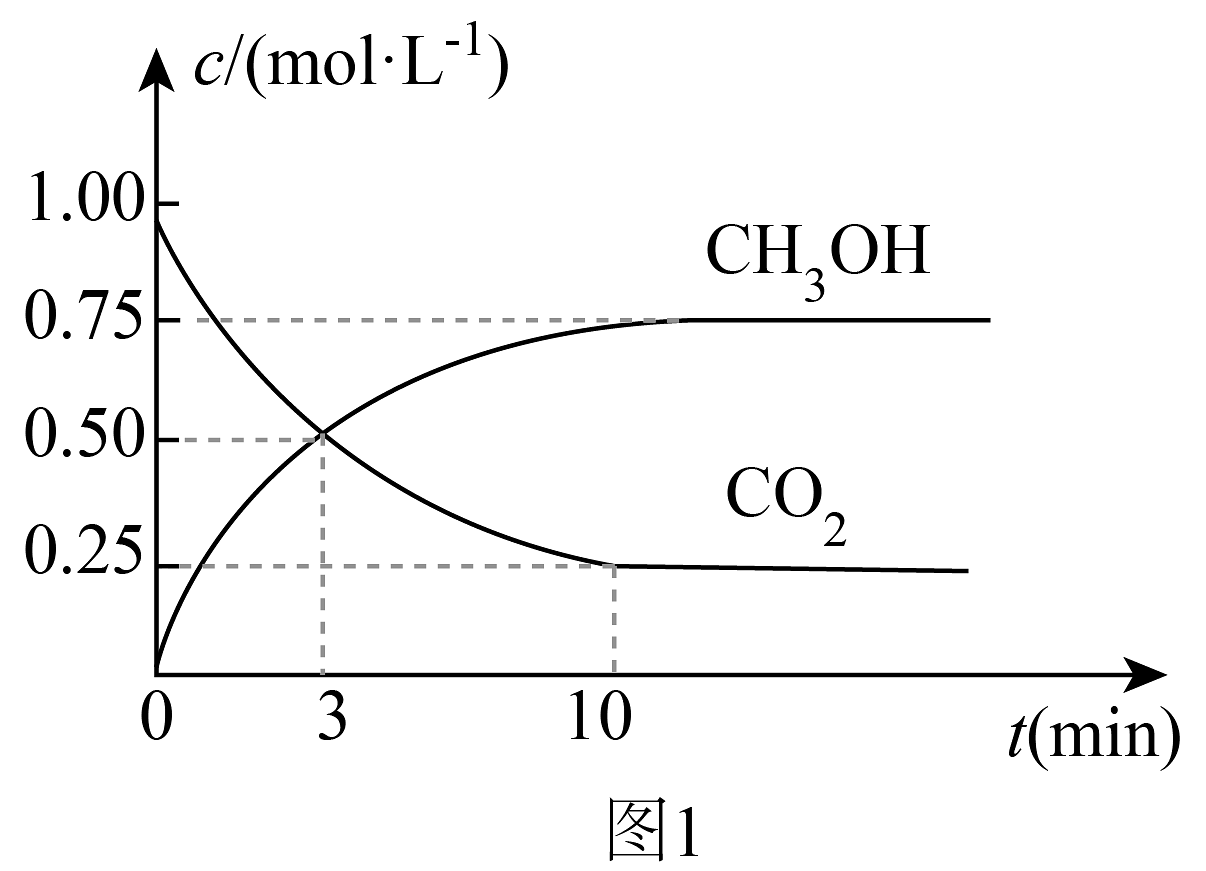
方案二:二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。和在铁系催化剂作用下发生化学反应:
Ⅰ.
Ⅱ.
在密闭容器中通入1mol和3mol , 在铁系催化剂作用下进行反应,的平衡转化率随温度和压强的变化如图2所示。
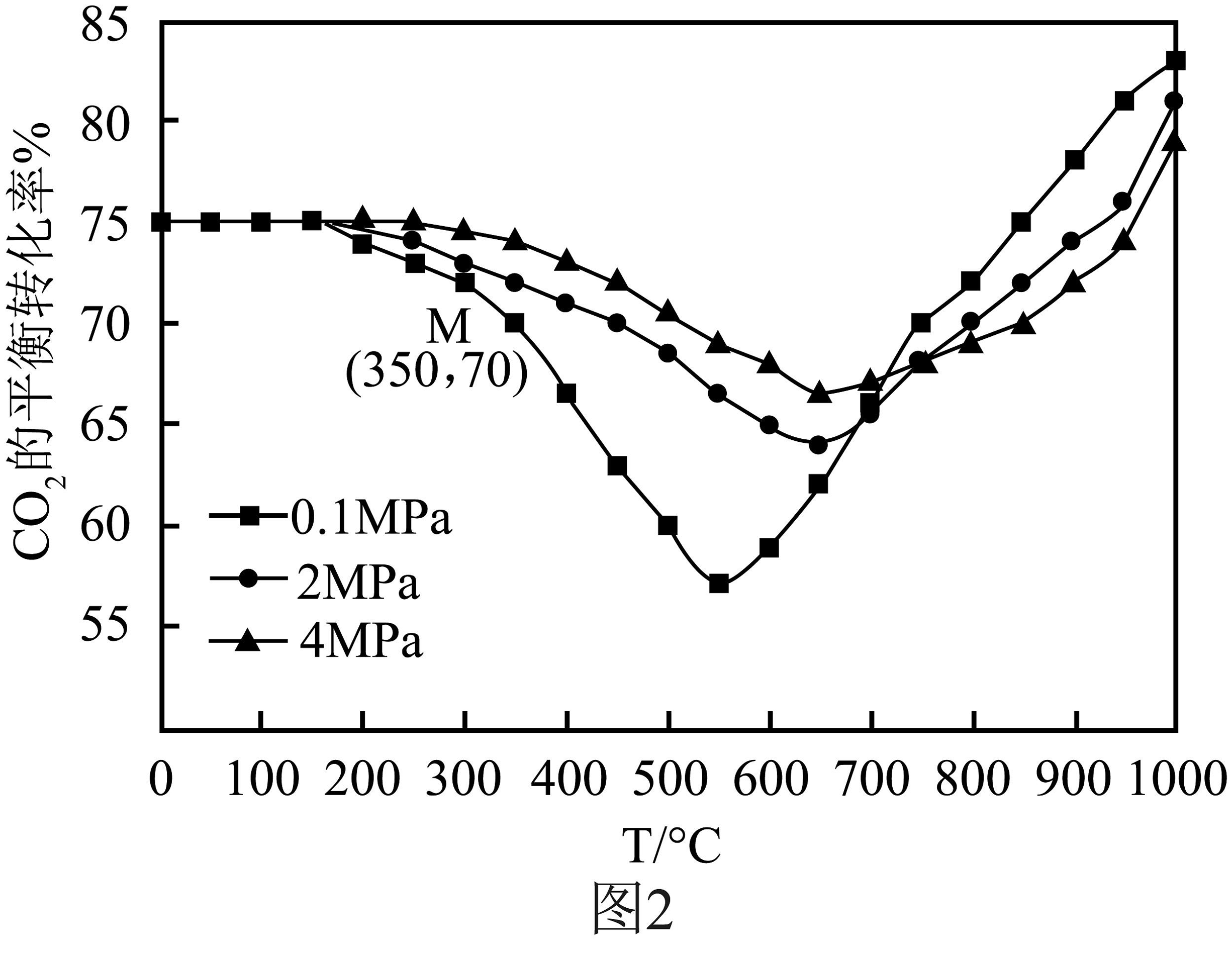 (4)图2中点、此时乙烯的选择性为(选择性:转化的中生成和CO的百分比)。计算该温度时:反应Ⅱ的平衡常数________。(5)在图2中,温度大于:800℃时,随着压强的增大,的平衡转化率减小,请解释原因________。
(4)图2中点、此时乙烯的选择性为(选择性:转化的中生成和CO的百分比)。计算该温度时:反应Ⅱ的平衡常数________。(5)在图2中,温度大于:800℃时,随着压强的增大,的平衡转化率减小,请解释原因________。 -
4、硫代硫酸钠()为无色透明晶体,易溶于水,难溶于乙醇,在中性或碱性环境中稳定,酸性环境中不稳定,受热易分解,有较强的还原性。工业上常用硫化碱法制备,反应原理为。某实验探究小组模拟该工业原理在实验室制备 , 实验装置如图所示。
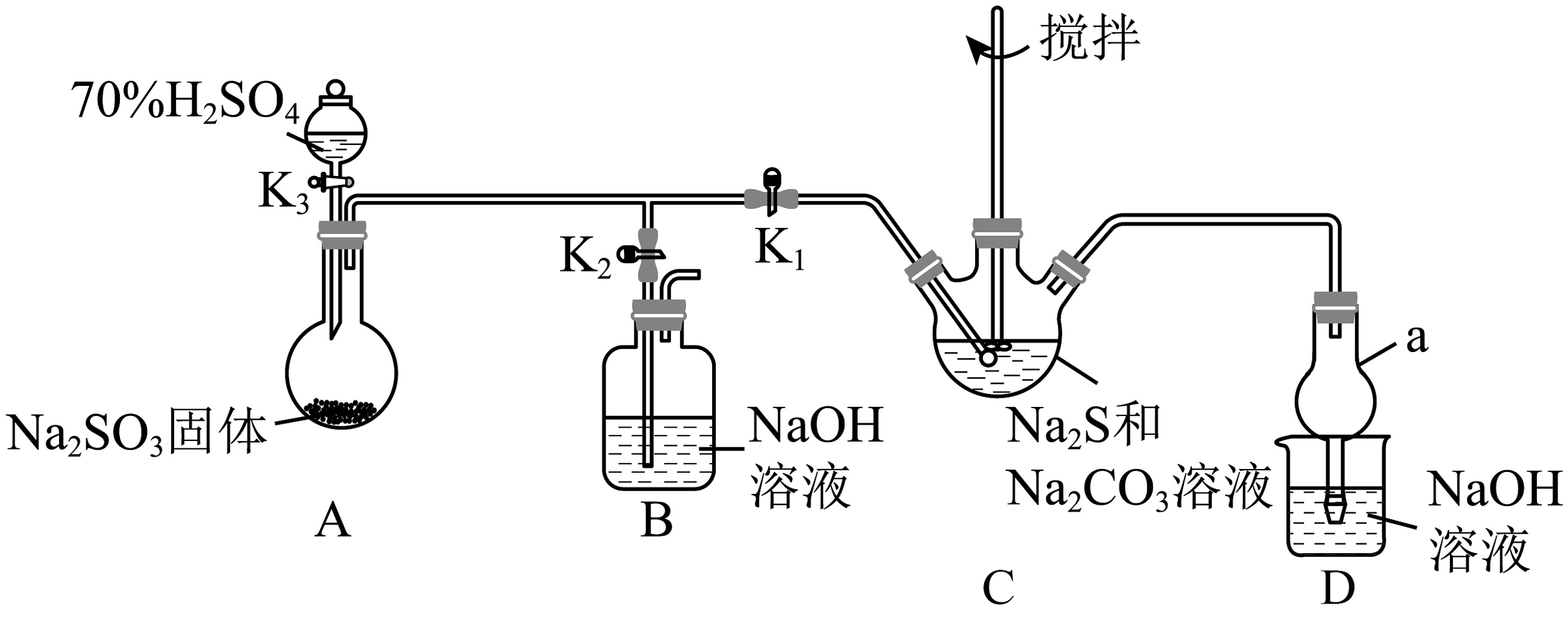
回答下列问题:
(1)、仪器a的名称为 , 装置B中NaOH溶液的作用是。(2)、反应开始后,C中先有浑浊产生,后又变澄清,此浑浊的物质是(用化学式表示)。(3)、实验开始时,先关闭开关 , 打开开关 , 再打开活塞 , 制备过程中必须监测装置C中溶液的pH,当溶液的pH降至7时,反应完成,立即停止反应,如果导致溶液的pH小于7时,的产率会下降,其原因是(用离子方程式解释)。(4)、可用于测定工厂废水中游离态氯()的含量,实验如下:①取水样50.00mL于锥形瓶中,加入10.00mLKI溶液(足量),滴入2~3滴淀粉溶液。
②将0.0010mol·L-1标准溶液(显碱性)装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为。
试回答下列问题:
①滴定前装有标准液的滴定管排气泡时,应选择下图中的(填标号,下同)。

②达到滴定终点的现象是。
③实验消耗了标准溶液4.00mL,所测水样中游离态氯()的含量为mg·L-1.
④实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是(填标号)。
A.锥形瓶水洗后直接装待测水样
B.装标准溶液的滴定管水洗后没有润洗
C.滴定到达终点时,俯视读出滴定管读数
D.装标准溶液的滴定管滴定前尖嘴部分有气泡,滴定后气泡消失
-
5、试根据沉淀溶解平衡知识回答问题:(1)、常温下,CaS的 , 饱和溶液中存在平衡:。将mol/L氯化钙溶液mol/L硫化钠溶液等体积混合,(填“能”或“不能”)产生沉淀。滴加少量盐酸,(填“增大”或“减小”)。(2)、若向CaS悬浊液中加入溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式。(3)、常温下,的 , 在mol/L的溶液中,当刚开始沉淀时,溶液的pH为;若要使其沉淀完全(mol/L),pH的范围是。
-
6、次磷酸()、亚磷酸()、磷酸()是化学工业生成中常用的无机酸,回答下列问题:(1)、已知次磷酸()为一元弱酸,属于(填“正盐”“酸式盐”“不能确定”),经实验检测发现溶液显碱性,其原因是(写离子方程式),写出溶液中所有离子浓度的大小关系。(2)、常温下,亚磷酸()、磷酸()逐级电离平衡常数如下表所示:
, ,
,
①相同条件下,取的等体积、两溶液,分别加水稀释100倍,所得溶液的pH大小关系为(填“>、<”或“=”)。
②常温下,浓度均为0.01mol·L-1的溶液和溶液中水的电离程度(填“前者大”“后者大”或“相同”);
③向0.01mol·L-1的溶液中加入过量的离子方程式为。
-
7、下列实验内容和实验目的都正确的是
编号
实验内容
实验目的
A
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
B
室温下,用pH试纸分别测定浓度为18 mol/L和0.1 mol/LH2SO4溶液的pH
比较不同浓度H2SO4的酸性强弱
C
判断KCl的化学键类型
将KCl固体溶于水,进行导电性实验,KCl溶液可导电
D
向10 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀
证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
A、A B、B C、C D、D -
8、已知溶洞的形成与下列反应有关:
①
②
已知的 , ,
下列说法错误的是
A、反应①的平衡常数为 B、溶液的pH保持不变不能判断反应①达到平衡状态 C、当溶有碳酸氢钙的水从溶洞顶滴到洞底时可以形成钟乳石 D、将0.02mol/L溶液稀释到0.01mol/L,几乎不变 -
9、为了模拟汽车尾气的净化,向密闭容器中投入一定量的CO和 , 在催化剂(Ⅰ型、Ⅱ型)和不同温度下发生反应: , 反应进行相同时间t(s),测得CO转化率与温度的关系曲线如图所示,下列说法正确的是
 A、该反应在a、b两点对应的平衡常数大小关系: B、b点转化率明显下降最主要原因是温度升高催化剂失活 C、在实验中CO平衡转化率达到阴影部分数值只能采用延长反应时间的方案 D、50℃,t s时容器中浓度为0.01mol/L,该温度下压反应平衡常数为
A、该反应在a、b两点对应的平衡常数大小关系: B、b点转化率明显下降最主要原因是温度升高催化剂失活 C、在实验中CO平衡转化率达到阴影部分数值只能采用延长反应时间的方案 D、50℃,t s时容器中浓度为0.01mol/L,该温度下压反应平衡常数为 -
10、硫酸钡在水中的沉淀溶解平衡: , 在不同温度时,曲线如图所示。下列说法错误的是
 A、 B、温度下 C、温度升高,可使溶液从a点变成c点 D、a点和b点的相等
A、 B、温度下 C、温度升高,可使溶液从a点变成c点 D、a点和b点的相等 -
11、氢气和氧气反应生成水的能量关系如图所示,下列说法正确的是
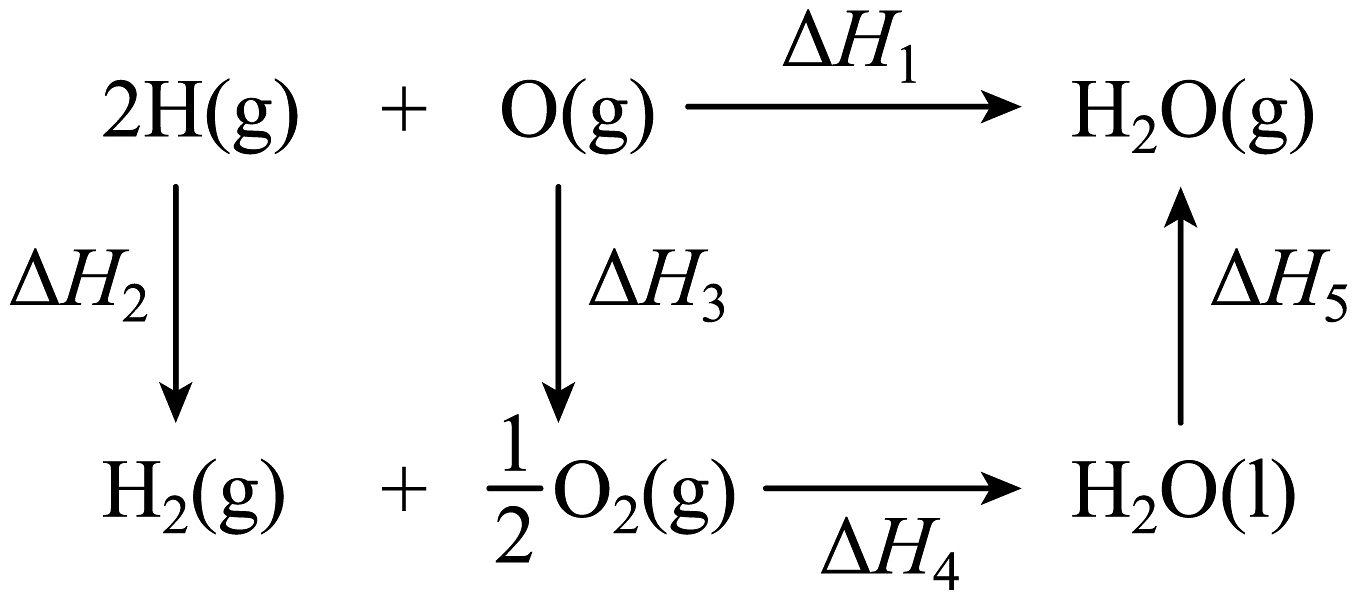 A、 B、 C、 D、一定条件下,气态原子生成、、放出的能量分别是 , 则
A、 B、 C、 D、一定条件下,气态原子生成、、放出的能量分别是 , 则 -
12、在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列说法正确的是
 A、a、b、c三点对应的溶液中,pH由小到大的顺序是a<b<c B、a、b、c三点对应的溶液中,电离程度最大的是b点 C、稀释过程中,始终保持增大趋势 D、向b点对应的溶液中加入少量碳酸钾固体,可使电离程度增大
A、a、b、c三点对应的溶液中,pH由小到大的顺序是a<b<c B、a、b、c三点对应的溶液中,电离程度最大的是b点 C、稀释过程中,始终保持增大趋势 D、向b点对应的溶液中加入少量碳酸钾固体,可使电离程度增大 -
13、下列说法错误的是A、0.2mol·L-1与0.1mol·L-1盐酸等体积混合: B、0.1mol·L-1的盐酸和0.1mol·L-1的溶液等体积混合: C、等体积等pH的盐酸和溶液分别与相同浓度的NaOH溶液中和至时,盐酸消耗的NaOH更多 D、等浓度的①溶液、②溶液、③溶液中:①>②>③
-
14、在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应: , 平衡时与温度T的关系如图所示,则下列说法正确的是
 A、增大压强,NO转化率增大 B、若该反应在B、D点的平衡常数分别为、 , 则 C、若状态B、C、D的速率分别为、、 , 则 D、在时,若反应体系处于状态D,则此时v(正)(逆)
A、增大压强,NO转化率增大 B、若该反应在B、D点的平衡常数分别为、 , 则 C、若状态B、C、D的速率分别为、、 , 则 D、在时,若反应体系处于状态D,则此时v(正)(逆) -
15、反应过程中能量变化如图所示(图中表示正反应的活化能,表示逆反应的活化能),下列有关叙述错误的是
 A、该反应为放热反应,kJ/mol B、有催化剂的两步反应中,第一步为该反应的决速步 C、使用催化剂可以降低反应的活化能,从而加快化学反应速率 D、若kJ/mol则和反应放出的热量一定小于akJ
A、该反应为放热反应,kJ/mol B、有催化剂的两步反应中,第一步为该反应的决速步 C、使用催化剂可以降低反应的活化能,从而加快化学反应速率 D、若kJ/mol则和反应放出的热量一定小于akJ -
16、下列实验装置或实验操作不能达到相应实验目的的是
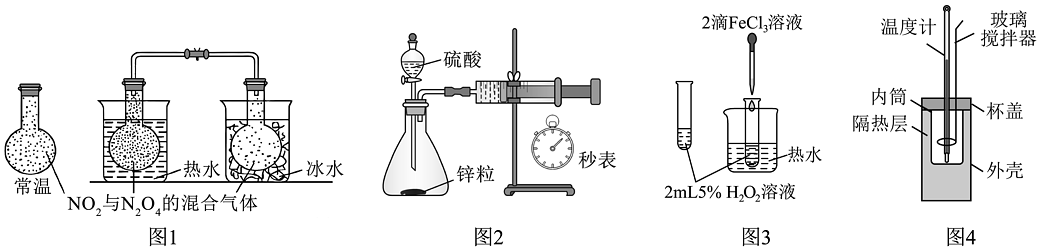 A、图1:探究温度对化学平衡的影响 B、图2:测定一定时间内生成的反应速率 C、图3:验证对分解的催化作用 D、图4:使用简易量热计进行中和反应热的测定
A、图1:探究温度对化学平衡的影响 B、图2:测定一定时间内生成的反应速率 C、图3:验证对分解的催化作用 D、图4:使用简易量热计进行中和反应热的测定 -
17、常温下,下列离子在指定的溶液中可能大量共存的一组是A、水电离出的mol·L-1溶液:、、、 B、与铝反应产生的溶液:、、、 C、使甲基橙呈红色的溶液:、、、 D、某无色透明澄清的溶液:、、、
-
18、下列事实可用化学平衡移动原理解释的是A、在容器中充入一定量的与 , 达到平衡后压缩容器容积以增大压强,混合物颜色加深 B、制取乙酸乙酯过程中,实验人员通过加入过量的乙醇来提高乙酸的转化率 C、将肝脏研磨液加入过氧化氢溶液,发现有气泡产生,加热后气泡产生速率减慢 D、工业上选择在500℃而不是常温下进行合成氨的反应
-
19、下列有关化学反应速率与平衡说法错误的是A、改变温度一定能改变化学反应速率,同时也一定能破坏化学平衡 B、对有气体参加的可逆反应,通过压缩容器增大压强,反应速率增大,平衡不一定移动 C、对于吸热反应,增大平衡常数K的措施有升高温度、增大压强 D、向平衡体系中加入KCl固体,平衡不移动
-
20、下列说法中正确的是( )A、熵减的吸热反应可能是自发反应 B、需要加热的化学反应,生成物的总能量一定高于反应物的总能量 C、使用催化剂既不会改变反应的限度又不会改变反应的焓变 D、已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2 , 则△H1>△H2