相关试卷
-
1、下列实验装置使用正确的是
 A、图①装置用于制取并收集 B、图②装置用于测量NaClO溶液的pH C、图③装置用于研究原电池的工作原理 D、图④装置用于标准NaOH溶液测定盐酸溶液的浓度
A、图①装置用于制取并收集 B、图②装置用于测量NaClO溶液的pH C、图③装置用于研究原电池的工作原理 D、图④装置用于标准NaOH溶液测定盐酸溶液的浓度 -
2、下列表示正确的是A、的VSEPR模型:
 B、丙烷分子的空间填充模型:
B、丙烷分子的空间填充模型: C、HClO的电子式:
C、HClO的电子式: D、基态Br原子的轨道表示式:
D、基态Br原子的轨道表示式:
-
3、铁是应用最广泛的金属,下列关于铁及其化合物说法正确的是A、还原铁粉可用作食品干燥剂 B、红热的铁与水蒸气反应生成四氧化三铁和氢气 C、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 D、浓硝酸与铁在常温下不能反应,所以可用铁质容器贮运浓硝酸
-
4、下列物质不属于碱性氧化物的是A、 B、 C、 D、FeO
-
5、一定量氢气在氯气中燃烧,所得混合物用100 mL3. 00 mol/L的NaOH溶液恰好完全吸收,检测到反应后溶液中有NaCl、NaClO和NaClO3。测得溶液中含有NaCl的物质的量0.250 mol,NaClO的物质的量为0.0300 mol。(1)、所得溶液中NaClO3的物质的量为。(2)、所得混合物中氯气与NaOH溶液反应的总离子方程式 。(3)、所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =。
-
6、某同学设计如下实验方案,以分离KCl和两种固体混合物,试回答一列问题:
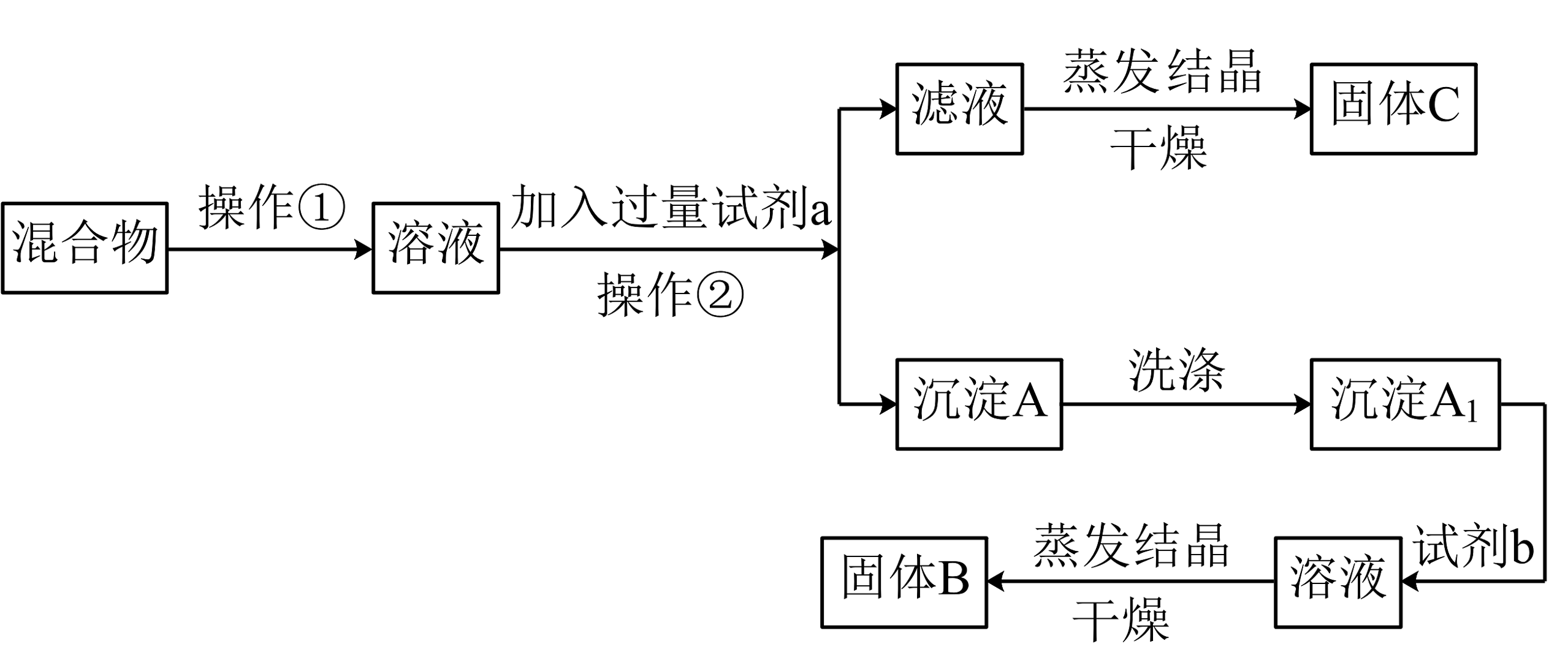
供选试剂:溶液、溶液、溶液、盐酸
(1)、试剂a是 , 操作②的名称是。(2)、该方案能否达到实验目的:(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)。(3)、加入试剂b所发生反应的离子方程式为。 -
7、以海水为原料,能够以低廉的成本获得氯气。除此之外,在实验室也可以多种方法制备氯气。某校化学实验兴趣小组的同学设计了如图所示的实验装置(必要的加持仪器已省略),利用如下装置制备氯气并验证氯气的某些性质。

请回答下列问题:
(1)、装置A中制取的离子方程式为。(2)、装置B中溶液出现浑浊,能否说明与溶液发生反应?请说明理由:。(3)、装置C可制取氯酸钾,化学方程式为:(浓) , 请用双线桥表示电子转移过程:。(4)、装置D中导管接错,若导致溶液进入装置E,则E中出现的现象为。此过程涉及反应的化学方程式是。(5)、氯气有剧毒,一旦泄露会对人民群众的生命安全造成重大威胁。工业生产中常用氨气检查输送氯气的管道是否有泄漏。若有泄漏,可以观察到有大量的白烟生成(为固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:。 -
8、海洋是一个巨大的化学资源宝库,海水中NaCl含量在30g/L左右,是制碱工业理想的原料,我国化工专家侯德榜先生的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。某化学兴趣小组的同学在实验室中模拟“侯氏制碱法”,最终得到和的混合物。为测定其中的质量分数,进行了下列相关实验。其实验流程如下:
 (1)、该实验需要用到1.00mol/L的稀盐酸100mL,但实验室只有12.0mol/L的浓盐酸,则配制该稀盐酸需要浓盐酸mL(计算结果保留一位小数)。(2)、在该溶液的配制过程中,用到的玻璃仪器:量筒、烧杯、玻璃棒、、。(3)、配制稀盐酸时,下列操作会造成结果偏高的是________。A、配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出 B、容量瓶洗涤干净后,瓶内壁有少量水滴 C、未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶的刻度线(4)、配制时,其正确的操作顺序是。
(1)、该实验需要用到1.00mol/L的稀盐酸100mL,但实验室只有12.0mol/L的浓盐酸,则配制该稀盐酸需要浓盐酸mL(计算结果保留一位小数)。(2)、在该溶液的配制过程中,用到的玻璃仪器:量筒、烧杯、玻璃棒、、。(3)、配制稀盐酸时,下列操作会造成结果偏高的是________。A、配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出 B、容量瓶洗涤干净后,瓶内壁有少量水滴 C、未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶的刻度线(4)、配制时,其正确的操作顺序是。A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(5)、若实验中测得样品质量为5.92g,固体质量为5.85g,则碳酸钠的质量分数为(计算结果保留3位有效数字)。 -
9、海洋约占地球表面积的71%,浩瀚的大海美丽而富饶,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如①NaCl、②等。目前通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和③食盐水用以生产。④烧碱、⑤纯碱、⑥Na、⑦、⑧盐酸等。苦卤也是重要的化工原料,例如,将苦卤也是重要的化工原料,例如,将苦卤通入沉淀池,经⑨石灰乳沉淀、过滤、酸溶、浓缩、脱水、电解等工序可制得金属镁。或将苦卤用氯气氧化、热空气吹出、⑩吸收等一系列操作可以获得溴单质。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。(1)、上述标有序号的物质中属于电解质的是(填序号,下同);属于非电解质的是;能导电的物质是。(2)、写出⑤溶于水的电离方程式:适量的④溶于装有50mL蒸馏水的烧杯中后,通入少量⑩,写出该过程对应的反应离子方程式:。(3)、离子交换法是海水淡化的主要方法之一。离子交换法获取淡水模拟图如图:

①海水中存在少量 , 检验存在的方法是。
②经过阳离子交换树脂后水中阳离子数目(填“增加”“不变”或“减少”)。
-
10、下列实验操作及现象、实验结论均正确的是
实验操作及现象
结论
A
干燥氯气通入装有鲜花的集气瓶,鲜花褪色
氯气有漂白性
B
向某溶液中加入盐酸,有气泡产生,将该气体通入澄清石灰水,石灰水变浑浊
该溶液中一定含
C
用洁净铁丝蘸取某溶液进行焰色试验,观察到火焰呈黄色
该溶液中一定含有钠元素,可能含有钾元素
D
红热的铁粉与水蒸气反应后的固体中,加入足量稀盐酸溶解,再滴入KSCN溶液,不变红
该固体中不含三价铁
A、A B、B C、C D、D -
11、1943年我国化学工程专家侯德榜发明了侯氏制碱法,又称联合制碱法,为我国化工事业的发展做出了卓越贡献。其部分工艺流程如下,下列说法不正确的是

反应①的化学方程式为
A、流程①中应先通 , 再通 B、反应②产生的可循环使用 C、若纯碱中混有 , 可用澄清石灰水除去 D、母液的主要成分是 , 可用于化肥工业 -
12、南开大学、浙江大学和多伦多大学等团队强强联手研制了一种纳米级氧化亚铜()其催化性能显著。实验过程中发现,纳米级氧化亚铜()进入溶液后,会在的用下,被溶液中溶解的进一步氧化,从而导致失活,该反应离子方程式为: , 下列说法正确的是A、纳米氧化亚铜是一种胶体 B、若有被还原,则必有被氧化 C、为避免氧化亚铜被氧化,可以预先将溶液煮沸 D、为检验配制溶液的水中是否有 , 可以取样,加入溶液,观察是否有白色沉淀生成
-
13、用还原法可以将硝酸厂烟气中的大量氮氧化物()转化为无害物质。常温下,将NO与的混合气体通入与的混合溶液中,其物质的转化过程如图所示。下列说法不正确的是
 A、反应Ⅰ的离子方程式为 B、反应Ⅱ的离子方程式为 C、反应Ⅰ、Ⅱ中含Ce的物质均作氧化剂 D、反应过程中,混合溶液中和的总数不变
A、反应Ⅰ的离子方程式为 B、反应Ⅱ的离子方程式为 C、反应Ⅰ、Ⅱ中含Ce的物质均作氧化剂 D、反应过程中,混合溶液中和的总数不变 -
14、将与的混合物投入足量的水中溶解,反应后水溶液增重24.8g,则原混合物中与的物质的量之比是A、1:3 B、3:1 C、1:2 D、2:1
-
15、过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行如图所示实验。实验①取反应后溶液加入二氧化锰,立即产生大量气体;实验②③中红色均不褪色。下列分析错误的是
 A、实验①中产生的气体为O2 B、实验①中MnO2为反应物 C、实验②③可证明使酚酞褪色的不是氢氧化钠和氧气 D、上述实验可说明过氧化钠与水反应可能生成了H2O2
A、实验①中产生的气体为O2 B、实验①中MnO2为反应物 C、实验②③可证明使酚酞褪色的不是氢氧化钠和氧气 D、上述实验可说明过氧化钠与水反应可能生成了H2O2 -
16、类比是化学研究的常用方法。下列类比正确的是A、Na和水反应生成NaOH和 , 则Fe和水蒸气反应也生成和 B、溶解度小于 , 则溶解度也小于 C、Cu与能化合生成 , 则Fe与能化合生成 D、液氯可以储存在钢瓶中,则氯水也可以储存在钢瓶中
-
17、用下列装置进行实验,能达到实验目的的是
 A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NaCl饱和溶液制备NaCl晶体 C、用图3所示装置验证Na2CO3比NaHCO3稳定 D、用图4所示装置能较长时间看到Fe(OH)2白色沉淀
A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NaCl饱和溶液制备NaCl晶体 C、用图3所示装置验证Na2CO3比NaHCO3稳定 D、用图4所示装置能较长时间看到Fe(OH)2白色沉淀 -
18、已知反应:①;②(浓);③。下列说法正确的是A、上述三个反应都是置换反应 B、反应①中氧化剂与还原剂的物质的量之比为 C、反应③中若反应,则还原剂得电子的物质的量为5mol D、氧化性由弱到强的顺序为:
-
19、下列对图示的解释不正确的是
向溶液中加入稀硫酸,溶液导电能力变化

纯净的氢气在氯气中燃烧

A.a时刻溶液与稀硫酸恰好完全中和
B.瓶口白雾可能是HCl气体与空气中的水蒸气结合形成
用激光笔照射分散系,看到一条光亮的通路

NaCl溶于水

C.利用丁达尔效应证明烧杯中的分散系是胶体
D.
A、A B、B C、C D、D -
20、下列各组数据中,前者刚好是后者两倍的是( )A、2 mol水的摩尔质量与1 mol水的摩尔质量 B、氯离子的物质的量浓度:50 mL 1 mol/L CaCl2溶液与100 mL 1 mol/L KCl溶液 C、22.4L H2所含氢原子数与11.2L H2所含氢原子数 D、20%NaOH溶液中NaOH的物质的量浓度与10%NaOH溶液中NaOH的物质的量浓度