相关试卷
-
1、燃煤烟气脱硫的方法有多种,方法之一是常温下用氨水将转化为 , 再氧化成。已知的电离常数 , , 的电离常数。下列说法正确的是A、常温下溶液的 B、溶液中: C、若溶液中时,溶液的 D、向溶液中通入空气发生反应的离子方程式:
-
2、常温下,根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
用试纸测得等浓度的溶液的约为9,溶液的约为8
酸性强弱:
B
相同条件下,分别测量和醋酸溶液的导电性,前者的导电性强
醋酸浓度越大,电离程度越大
C
将充满的密闭玻璃球浸泡在热水中,气体红棕色加深
D
向溶有的溶液中通入气体 , 出现白色沉淀
气体一定具有强氧化性
A、A B、B C、C D、D -
3、常温下,向溶液中缓慢加入固体(溶液体积不变),溶液中、、的物质的量分数随的变化如图所示。下列说法不正确的是
 A、 B、点到点发生的主要离子反应: C、点溶液中离子的物质的量浓度大小关系为 D、b点溶液中
A、 B、点到点发生的主要离子反应: C、点溶液中离子的物质的量浓度大小关系为 D、b点溶液中 -
4、探究反应的速率影响因素,设计了以下实验,下列说法正确的是
锥形瓶号
1
2
3
4
反应温度/℃
20
20
40
40
溶液/mL
10
10
10
10
溶液/mL
10
5
10
4
0
x
0
6
浑浊出现时间/s
10
16
5
8
A、该反应也可以通过单位时间内浓度的变化来表示化学反应速率的快慢 B、2号瓶中x为5 C、3号瓶第反应结束,用来表示前内平均反应速率为 D、由1号瓶和4号瓶实验结果可得温度越高反应速率越快 -
5、环戊二烯易生成双环戊二烯,该反应为2
 (g)
(g) (g)。不同温度下(其它条件相同),在容积均为2L的两个密闭容器中,环戊二烯浓度与反应时间的关系如图所示。下列说法正确的是
(g)。不同温度下(其它条件相同),在容积均为2L的两个密闭容器中,环戊二烯浓度与反应时间的关系如图所示。下列说法正确的是 A、T1<T2 B、a点的反应速率小于c点的反应速率 C、从开始到a点环戊二烯的平均反应速率 为0.6mol·L−1·h−1 D、T1温度时,若容器体积为1L,则反应进行1h时,双环戊二烯的体积分数>
A、T1<T2 B、a点的反应速率小于c点的反应速率 C、从开始到a点环戊二烯的平均反应速率 为0.6mol·L−1·h−1 D、T1温度时,若容器体积为1L,则反应进行1h时,双环戊二烯的体积分数> -
6、常温下,下列有关电解质溶液的叙述正确的是A、将的盐酸稀释至后,溶液 B、的醋酸和氯化铵溶液中,水的电离程度相同 C、将的盐酸和的醋酸等体积混合,溶液 D、的氢氧化钠溶液与的醋酸溶液等体积混合,混合液呈酸性
-
7、常温下,下列各组离子一定能在指定溶液中大量共存的是A、的溶液:、、、 B、使酚酞变红的溶液:、、、 C、水电离的的溶液:、、、 D、无色透明溶液中:、、、
-
8、我国科学家最近开发新催化剂(P/Cu SAS@ CN)高效电还原制备 , 化学原理是 , 下列说法错误的是A、P/Cu SAS@ CN能降低该反应的活化能 B、当的消耗速率与的生成速率之比等于2:7时,反应已达平衡 C、当水蒸汽浓度为浓度的2倍时,反应已达平衡状态 D、该反应在低温下能自发进行
-
9、下列说法正确的是A、软脂酸燃烧热的热化学方程式为: B、和两个反应的相同 C、 , 则和的总能量高于的能量 D、已知 , 则稀硫酸与稀溶液反应生成水,放出的热量
-
10、化学与生活、生产密切相关,下列说法中不正确的是A、将煤转化为水煤气,是将煤转化为洁净燃料的过程 B、CO中毒应将中毒者移至空气流通处,必要时放入高压氧仓 C、利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” D、明矾净水的原理是水解生成的氢氧化铝胶体能凝聚水中的悬浮物并杀菌消毒
-
11、
物质的转化在生活、生产领域应用广泛。已知25℃时
物质
回答下列问题:
Ⅰ.碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中形成悬浊液,测得其。
(1)静置后上层清液中,(填“>”“<”或“=”)。
(2)向悬浊液体系中通入气体,溶液中(填“增大”“减小”或“保持不变”)。
Ⅱ.锅炉水垢严重影响锅炉使用寿命。为了除去水垢中的 , 可先用溶液处理,使转化为疏松、易溶于酸的 , 然后用酸除去。已知
(3)用过量溶液浸泡数日(忽略浸泡后溶液的浓度变化),水垢中的能否全部转化为?结合计算说明(已知当溶液中剩余的离子浓度小于时,认为转化反应进行完全)。
(4)某同学以溶液为例,探究不同浓度与其水解程度之间的关系,利用计算机辅助作图如图,通过图示可知。

Ⅲ.白云石的主要成分为 , 利用白云石制备碳酸钙和氧化镁的部分流程如下:

(5)结合表格中的数据解释“浸钙”过程中主要浸出“钙”的原因是。
(6)该流程中可循环利用的物质有(填写物质的化学式)。
-
12、溶液是常见的强碱弱酸盐,可由醋酸和溶液反应得到。(1)、水溶液呈性 (填“酸”或“碱”)。(2)、用标准液滴定未知浓度的溶液,回答下列问题:
①标准液应盛装在下图中的(填甲或乙)滴定管中。滴定过程中选择的指示剂是(填甲基橙或酚酞)。判断滴定达到终点的现象为。

②滴定过程中,当滴加溶液时恰好完全反应,此时溶液中各离子浓度由大到小的顺序是。
③下列操作会导致实验结果偏低的是(填字母)。
a.达到滴定终点时,仰视读数
b.碱式滴定管在装液前未用标准溶液润洗
c.滴定过程中,锥形瓶中有液体溅出
d.装标准液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现有气泡
(3)、电离平衡常数是衡量弱电解质电离程度大小的物理量。已知:化学式
电离常数(25℃)
、
①若把、、、都看作是酸,其中酸性最弱的是。向溶液中通入少量的 , 发生反应的化学方程式。
②25℃,等浓度的a.溶液、b.溶液和c.溶液,三种溶液的由小到大的顺序为。(用符号表示)
-
13、
Ⅰ.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如表,请回答下列问题。
实验
编号
反应
温度
加入0.1mol/L
Na2S2O3溶液的体积
加入0.1mol/L
硫酸溶液的体积
加入水
的体积
出现浑浊
的时间
℃
mL
mL
mL
s
①
20
2
2
0
t1
②
40
2
V1
0
t2
③
20
1
2
V2
t3
(1)实验①②研究的是对化学反应速率的影响,V1=。
(2)实验①③研究的是对化学反应速率的影响,V2=。
(3) t1、t2、t3由大到小的顺序是。
Ⅱ.某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示:

(4)由图中所给数据进行分析,该反应的化学方程式为。
(5)若上述反应中X、Y、Z分别为H2、N2、NH3 , 某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2 , 一段时间后反应达平衡状态,实验数据如表所示:
t/s
0
50
150
250
350
n(NH3)/mol
0
0.24
0.36
0.40
0.40
50—150s内的平均反应速率v(N2)= 。
(6)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A (g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中ΔH=。反应达到(5)中的平衡状态时,对应的能量变化的数值为kJ。
(7)为加快反应速率,可以采取的措施是。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
-
14、
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
Ⅰ.以和为原料合成尿素的反应为: , 该反应为放热反应。
(1)上述反应中,有利于提高平衡转化率的措施是_______(填序号)。
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压 (2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:

第一步:
第二步:
①合成尿素总反应的热化学方程式为________。
②第一步反应速率较快的理由是________。
Ⅱ.以和催化重整制备合成气: , 在密闭容器中通入物质的量均为的和在一定条件下发生反应: , 的平衡转化率随温度、压强的变化关系如图所示。
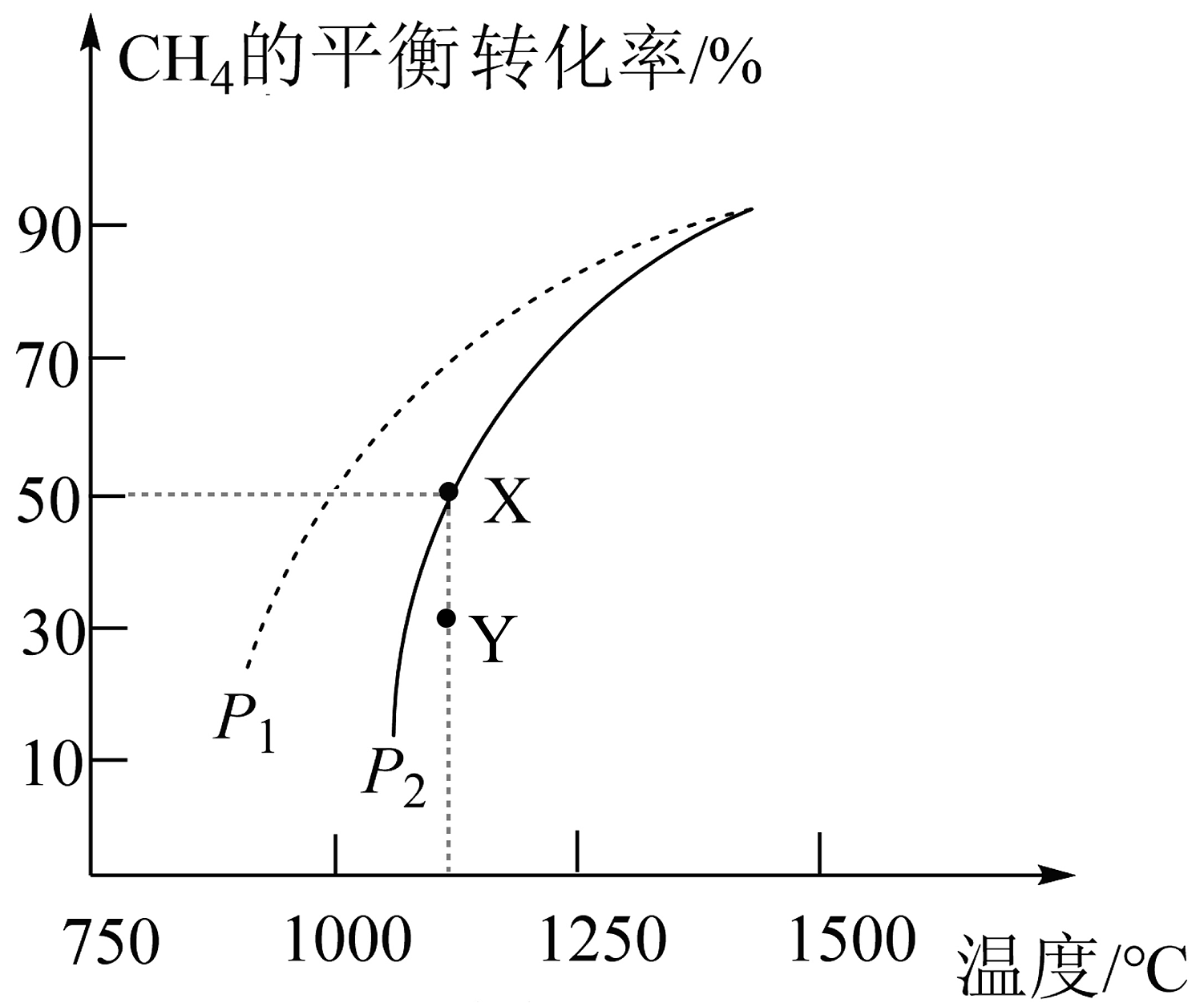
(3)若反应在恒温、恒容密闭容器中进行,能说明反应到达平衡状态的是_______(填序号)。
A. 反应速率: B. 同时断裂键和键 C. 容器内混合气体的压强保持不变 D. 容器中混合气体的密度保持不变 (4)由图可知,Y点速率________(填“>”、“<”或“=”,下同);容器内压强________。
-
15、一种储能电池的工作原理如下图所示。下列说法正确的是
 A、放电时电子由多孔碳流向电极 B、放电时多孔碳电极反应: C、储能时电极发生氧化反应 D、储能时总反应
A、放电时电子由多孔碳流向电极 B、放电时多孔碳电极反应: C、储能时电极发生氧化反应 D、储能时总反应 -
16、下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
工业用电解熔融NaCl制备金属钠
金属钠的还原性很强
B
装有NO2的密闭烧瓶冷却后颜色变浅
NO2转化为N2O4的反应吸热
C
高温,高压下,H2和N2在催化剂作用下合成氨
升高温度、增大压强均可使反应物分子中活化分子的百分数增加
D
1 mol/LNaCl溶液导电性比同浓度醋酸强
NaCl溶液的pH比醋酸的高
A、A B、B C、C D、D -
17、可活化制得 , 其反应历程如下图所示:下列说法不正确的是
 A、总反应为 B、总反应的速率由“中间体2→中间体3”决定 C、选用高效催化剂、可以降低反应的 D、降低温度可增大乙烷的平衡转化率
A、总反应为 B、总反应的速率由“中间体2→中间体3”决定 C、选用高效催化剂、可以降低反应的 D、降低温度可增大乙烷的平衡转化率 -
18、在反应中,表示反应速率最快的是A、 mol⋅L-1⋅min-1 B、 mol⋅L-1⋅min-1 C、 mol⋅L-1⋅s-1 D、 mol⋅L-1⋅min-1
-
19、在蒸发皿中蒸干并灼烧下列溶液,可以获得原溶液溶质固体的是A、溶液 B、溶液 C、溶液 D、溶液
-
20、常温下用0.1000 mol∙L−1盐酸滴定25mL0.1000 mol∙L−1Na2CO3溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法正确的是
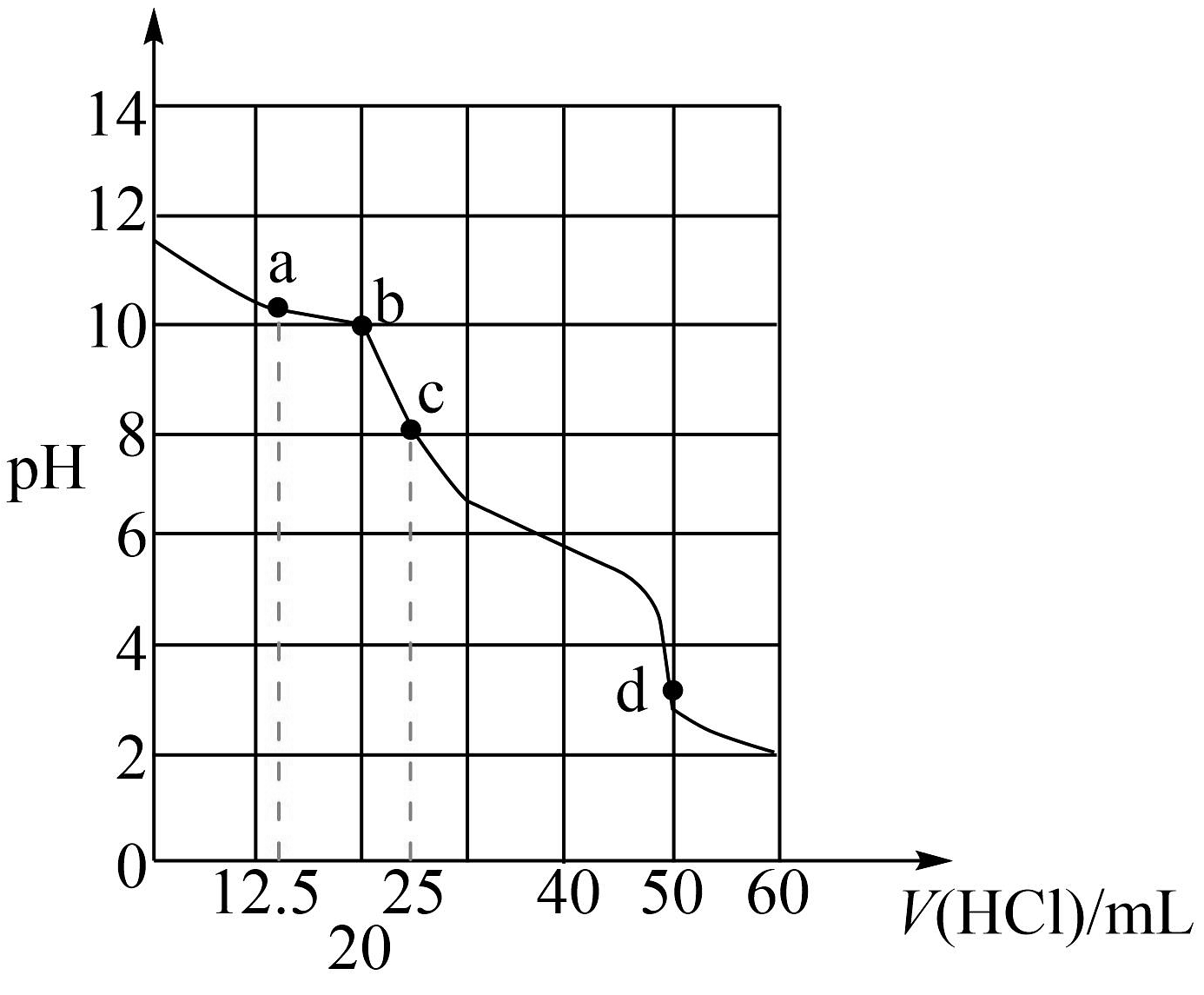 A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)
A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)