相关试卷
-
1、工业上常用催化除去重整气(主要成分为、、、、和少量等)中含有的少量。主要反应为;。(1)、用大孔径的催化剂载体可以提高催化氧化效果。
①制备泡沫铜载体。三羟甲基氨基甲烷()和硝酸铜混合均匀,在氩气的保护下点燃,冷却清洗后得到泡沫铜。三羟甲基氨基甲烷作用为。
②做载体。导热性差,会导致反应管温度过高去除率明显降低,除因为催化剂失活外,还有(用化学方程式表示)。
(2)、(Ce是活泼金属)中添加能提高反应催化效果。将的混合气体(其余为氮气)以一定流速通过装有催化剂的反应管,实验表明催化剂中氧空位的数量影响反应速率,可能机理如图-1所示。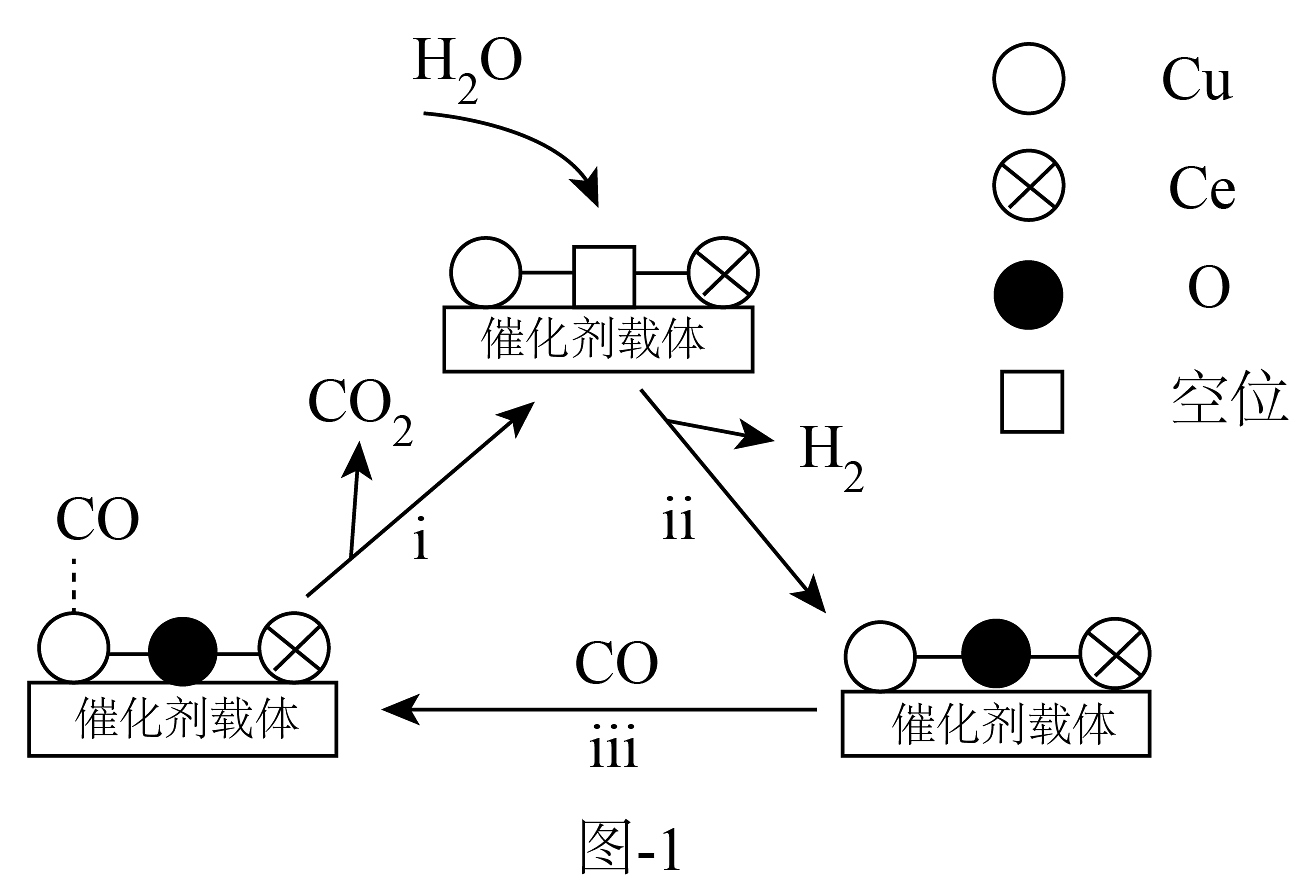
①中加入少量能提高的去除率,其原因是。
②催化剂中铜原子上会形成少量碱性基团(
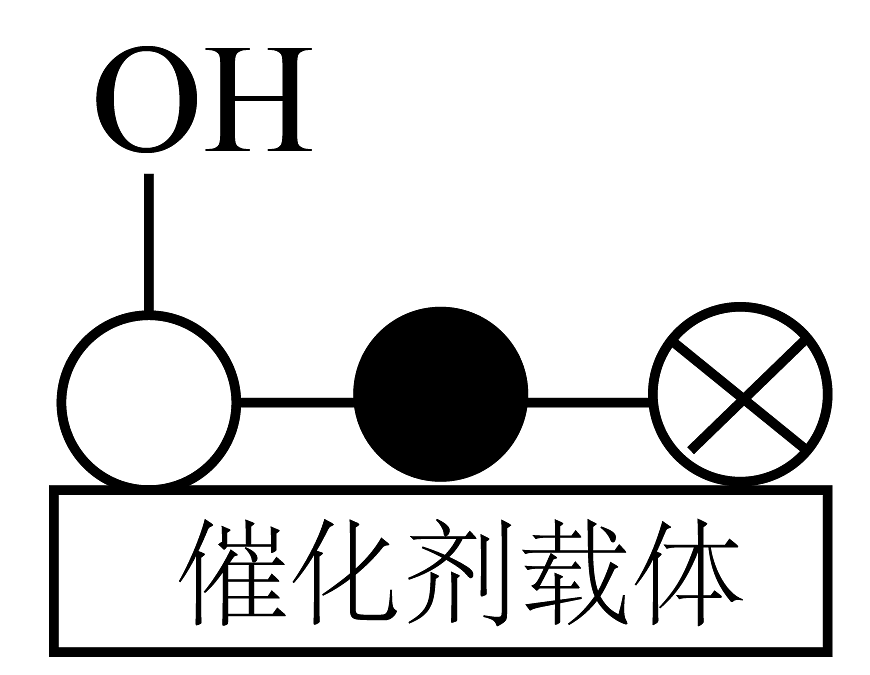 ),其存在会降低去除率的原因是。
),其存在会降低去除率的原因是。③步骤ⅱ氧气也会参与反应。若参加反应的和物质的量相等,则每转化产生的物质的量为。
(3)、、均能催化反应。重整气通过装有催化剂的反应管,的转化率和生成选择性随温度变化的曲线如图-2所示。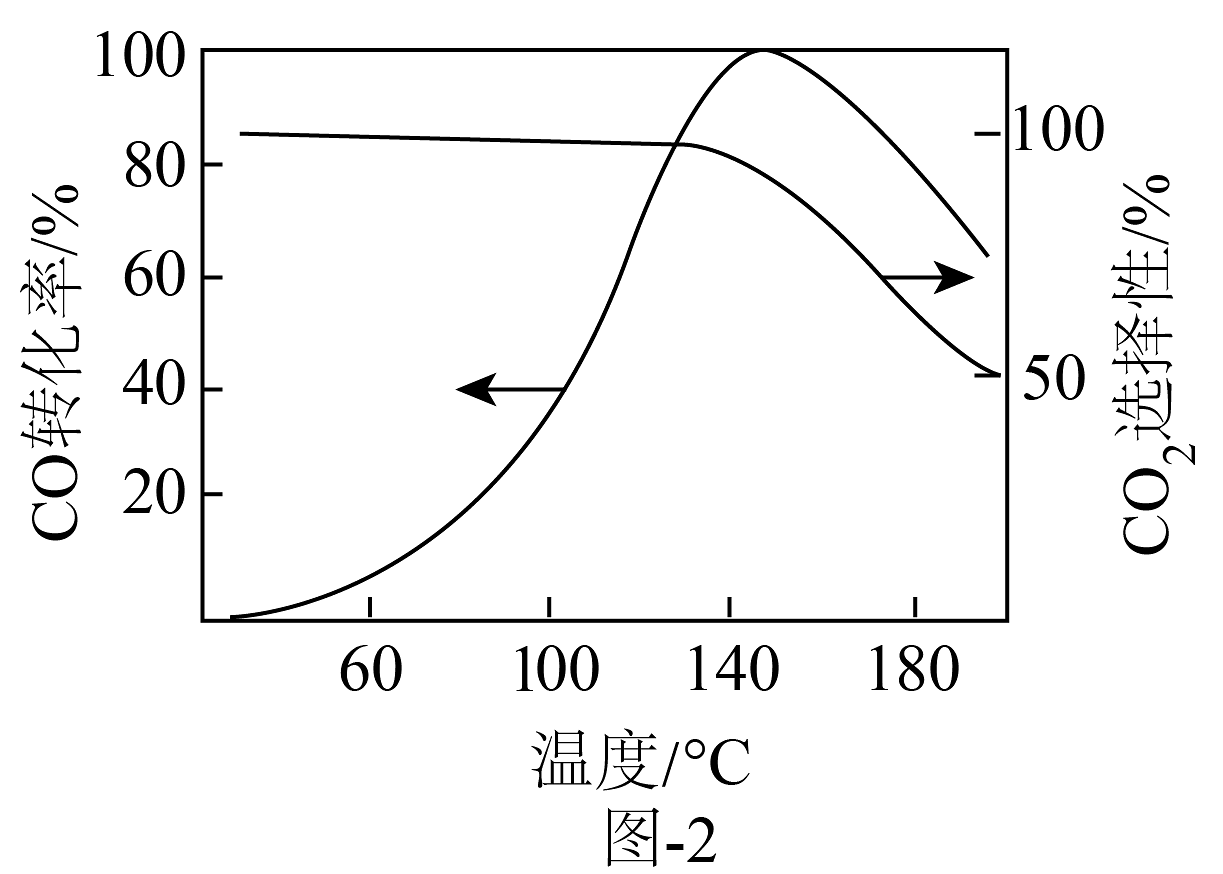
①产物选择性下降的原因可能是。
②相对于催化剂,其优点是。
-
2、
实验室利用重晶石废料(主要成分为、等)制备。
Ⅰ.制备粗。制备流程如下:

(1)转化。常温下,向重晶石废料中加入饱和碳酸钠(浓度为)溶液浸泡充分浸泡。
①已知: , 。浸泡后溶液中浓度最高为。
②常温下的溶解度大约是的5倍,浸泡重晶石废料用饱和而不用溶液的原因是。
(2)溶解。向过滤1所得的滤渣中加入溶液,加热后溶解。溶液溶解的离子方程式为。
Ⅱ.测定粗样品中铁元素的含量。
取5.0000g的粗样品,用20%充分溶解,再加入足量溶液充分反应,然后加蒸馏水配制成100mL溶液。准确量取20.00mL配制的溶液于锥形瓶中,调节溶液 , 用()溶液滴定至终点(滴定反应为),平行滴定3次,平均消耗EDTA溶液20.00mL。
(3)测定过程中,加入足量溶液的目的是。
(4)计算粗样品中铁元素的质量分数(写出计算过程)。
(5)若稀释后滤液用酸性滴定,测得的数值明显高于上述方法测定的数值,原因是。
Ⅲ.制备。
(6)粗中含有杂质。补充完整由粗制取高纯度的实验方案:取一定量粗固体, , 用蒸馏水充分洗涤沉淀,干燥,得到高纯度。[已知:时沉淀完全。实验中必须使用的试剂:稀、溶液]
-
3、G是合成治疗心血管药物的中间体,其合成路线如下:

已知:在苯环的取代反应中,酰胺基、醚键为邻位、对位定位基,羧基为间位定位基。
(1)、A→B中还可以生成一种与B有互为同分异构体的副产物,该副产物的结构简式为。(2)、C→D的反应类型为;反应中得到的另一种物质是(填化学式)。(3)、E的分子式为 , 则E的结构简式为。(4)、写出同时满足下列条件的F的一种芳香族同分异构体的结构简式:。能与溶液发生显色反应,能与溶液反应生成。分子中有4种不同化学环境的氢原子,其个数比为1:1:2:6.(5)、已知:。写出以 、、为原料制备
、、为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
4、工业上用锌铜合金灰(含有Cu、Zn、Pb及其氧化物)提取单质Cu和。(1)、锌铜合金灰在空气中焙烧得到烧渣,主要成分为、及少量等,用硫酸酸浸后过滤得到溶液和含铜滤渣。Zn、Cu、Pb浸出率随硫酸浓度变化如图1所示。

①用稀硫酸溶解时,Zn浸出率远高于Cu、Pb浸出率的原因是。
②使用和硫酸溶解时,所得滤渣成分的不同之处为。
(2)、在含有、、的高氯离子浓度的溶液中,先加入适量的Fe粉,后用萃取剂选择性萃取分离锌铁。已知、、可以存在多种含氯配离子。离子
常见配离子
、、、
萃取原理为(也可以被萃取)。
①该过程中萃取剂能有效分离锌铁的原因是。
②向溶液中加入浓盐酸能提高锌的萃取率的原因是。
(3)、向有机相中加入草酸溶液,将Zn(Ⅱ)转化为草酸锌()沉淀,灼烧后得到。已知 , 。①生成草酸锌()的化学方程式为。
②晶体有立方岩盐结构、立方闪锌矿结构等结构,晶胞如图-2所示,立方岩盐结构、立方闪锌矿结构晶胞中锌原子的配位数之比为。
 (4)、向水相加入草酸溶液生成草酸亚铁()沉淀,将沉淀置于氮气氛围中焙烧,剩余固体质量随温度变化曲线如图3所示。220~230℃时,所得固体产物为。的摩尔质量为。
(4)、向水相加入草酸溶液生成草酸亚铁()沉淀,将沉淀置于氮气氛围中焙烧,剩余固体质量随温度变化曲线如图3所示。220~230℃时,所得固体产物为。的摩尔质量为。
-
5、二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应(忽略其他副反应):
反应①:
反应②:
在密闭容器中,、时,催化反应相同时间,测得不同温度下转化率、的选择性如图中实线所示(图中虚线表示相同条件下的平衡转化率随温度的变化)。选择性。下列说法正确的是
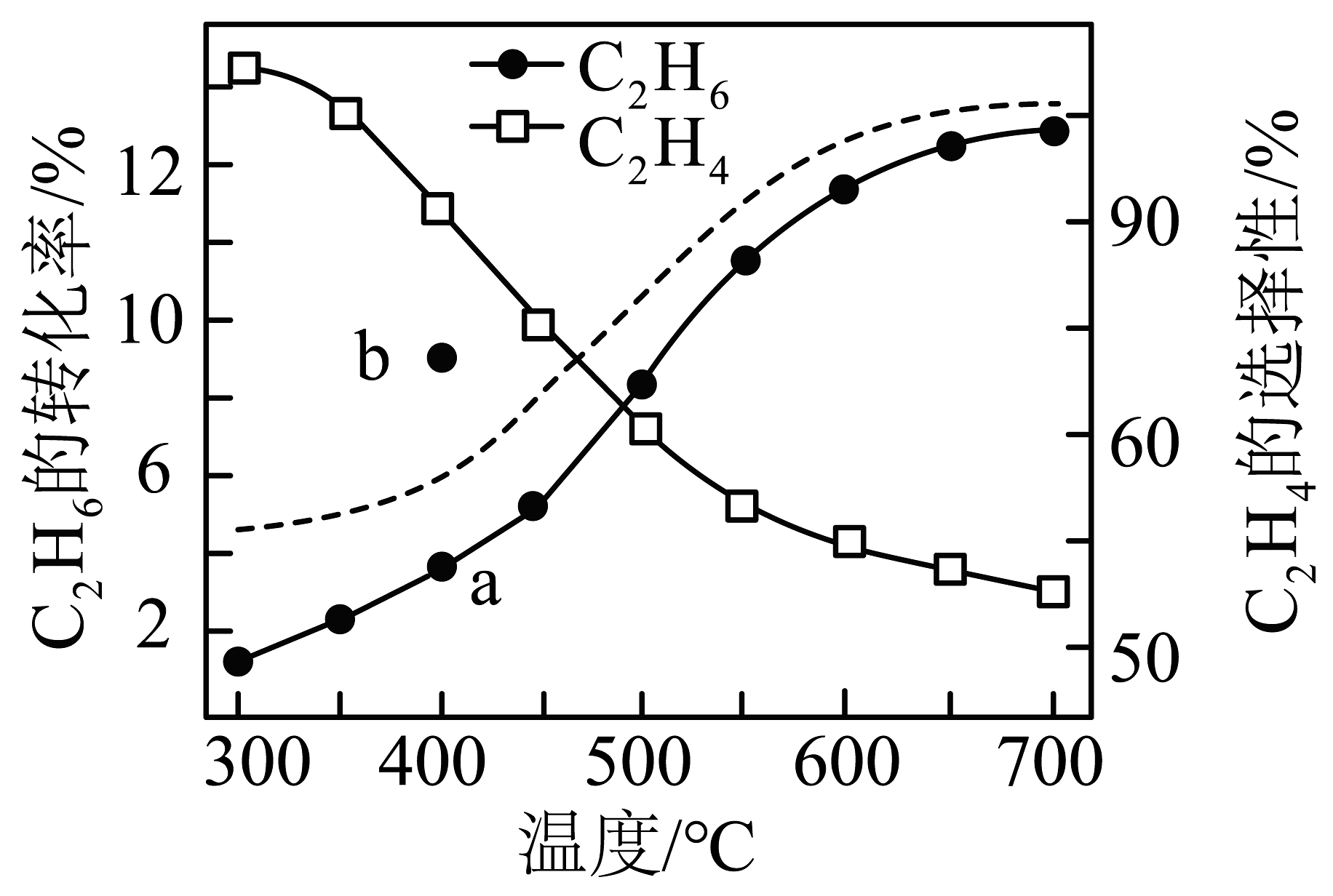 A、反应过程中,的转化率大于的转化率 B、在300~700℃之间,的选择性下降的原因是随温度升高反应①平衡后又向逆反应方向移动 C、保持其他条件不变,400℃时使用高效催化剂能使的转化率从a点的值升高到b点的值 D、随温度升高,转化率接近平衡转化率的主要原因是温度和催化剂共同影响,加快了反应速率
A、反应过程中,的转化率大于的转化率 B、在300~700℃之间,的选择性下降的原因是随温度升高反应①平衡后又向逆反应方向移动 C、保持其他条件不变,400℃时使用高效催化剂能使的转化率从a点的值升高到b点的值 D、随温度升高,转化率接近平衡转化率的主要原因是温度和催化剂共同影响,加快了反应速率 -
6、室温下,通过下列实验探究溶液的性质。
实验1:用pH计测量溶液的pH,测得pH为12.65.
实验2:向的溶液中通入气体至(忽略溶液体积的变化及的挥发)。
实验3:向的溶液中加入溶液。
已知: , , , 。
下列说法正确的是
A、实验1所得溶液中: B、实验2所得溶液中: C、实验3中:反应的平衡常数 D、向溶液中通入少量的离子方程式 -
7、室温下,根据下列卤素单质及其化合物的实验过程及现象,能验证相应实验结论的是
选项
实验过程及现象
实验结论
A
向溶液中通入 , 有白色沉淀产生
酸性:
B
向溶液中先滴加4滴溶液,出现白色沉淀,再滴加4滴溶液,出现黄色沉淀
溶度积常数:
C
用pH计分别测定溶液和溶液pH,溶液pH大
结合能力:
D
向溶液中加入碘单质,有黄绿色气体产生
氧化性:
A、A B、B C、C D、D -
8、利用电解可以将气态苯(
 )转化为环己烷(
)转化为环己烷( ),其电解装置如图所示。下列有关说法正确的是
),其电解装置如图所示。下列有关说法正确的是 A、电解时,电极A与电源的正极相连 B、电解时,电极B上产生的气体为 C、反应中每生成
A、电解时,电极A与电源的正极相连 B、电解时,电极B上产生的气体为 C、反应中每生成 , 转移电子数为
D、电解的总反应方程式:
, 转移电子数为
D、电解的总反应方程式:
-
9、化合物Z是一种药物的重要中间体,部分合成路线如下:

下列说法正确的是
A、X分子中含有2个手性碳原子 B、Y分子不存在顺反异构体 C、Z不能与的溶液反应 D、X、Y、Z均能与溶液反应 -
10、在给定条件下,下列制备过程涉及的物质转化不能实现的是A、金属铝制备: B、锅炉除垢: C、酸雨形成: D、检验葡萄糖:
-
11、阅读下列材料,完成下面小题:
铜及其重要化合物在生产中有着重要的应用。在存在下能与氨水反应生成。单质铜作催化剂可以将氧化为。是一种良好的离子型半导体,加入稀硫酸中,溶液变蓝色并有紫红色固体产生。高温下可以被氧化为和 , 将制得的粗铜通过电解精炼得铜。的盐酸溶液能吸收形成配合物 , 结构如图所示。
 (1)、下列有关说法正确的是A、和中碳原子杂化类型均为 B、与形成 , 提供孤对电子 C、中含有键的数目为 D、、、三者晶体的类型相同(2)、下列化学反应表示正确的是A、、和氨水反应生成: B、被氧化为: C、中加入稀硫酸: D、电解精炼铜阴极上电极反应:(3)、下列说法正确的是A、氧化为中,单质铜能降低反应的焓变 B、具有良好的半导体性能,是利用其晶体与硅晶体类型相同 C、高温下被氧化反应中,既是氧化剂又是还原剂 D、的盐酸溶液可用于吸收 , 是利用了的氧化性
(1)、下列有关说法正确的是A、和中碳原子杂化类型均为 B、与形成 , 提供孤对电子 C、中含有键的数目为 D、、、三者晶体的类型相同(2)、下列化学反应表示正确的是A、、和氨水反应生成: B、被氧化为: C、中加入稀硫酸: D、电解精炼铜阴极上电极反应:(3)、下列说法正确的是A、氧化为中,单质铜能降低反应的焓变 B、具有良好的半导体性能,是利用其晶体与硅晶体类型相同 C、高温下被氧化反应中,既是氧化剂又是还原剂 D、的盐酸溶液可用于吸收 , 是利用了的氧化性 -
12、摩尔盐可以用于配制标准溶液。下列说法正确的是A、半径: B、第一电离能: C、电负性: D、热稳定性:
-
13、实验室利用废旧干电池废料(主要成分、、、碳粉等)回收。下列相关原理、装置及操作不正确的是
 A、用装置甲配制稀硫酸 B、用装置乙溶解废料 C、用装置丙过滤分离混合物 D、用装置丁灼烧获得
A、用装置甲配制稀硫酸 B、用装置乙溶解废料 C、用装置丙过滤分离混合物 D、用装置丁灼烧获得 -
14、反应可用于航天器中吸收。下列说法正确的是A、的结构示意图为
 B、中子数为8的氧原子:
C、为极性分子
D、中既含离子键又含极性键
B、中子数为8的氧原子:
C、为极性分子
D、中既含离子键又含极性键
-
15、侯德榜发明的侯氏制碱法造福了全人类。侯氏制碱法中的“碱”指的是A、 B、 C、 D、
-
16、
中国首次实现了利用二氧化碳人工合成淀粉,为全球的“碳达峰”、“碳中和”起到重大的支撑作用,研究二氧化碳的收集和利用成为了科研方面的热点。
I.热化学法将转化为甲醇
反应①
反应②
(已知:(或)的选择性)
将和混合气体以一定流速通过装有催化剂反应器,选择性、的转化率与温度的关系如图所示。

(1)230℃时,测得的转化率为40%,此时剩余的物质的量为。
(2)随着温度的升高,的转化率增大,其主要原因是。
(3)其他条件不变,增大压强,CO选择性变化为(填“不变”、“变大”或“变小”)。
II.和催化重整制取和
1991年,Ashcroft提出了甲烷二氧化碳重整的技术理论:500℃条件下,气体分子吸附至催化剂表面后发生反应,此过程机理模型如图所示(*表示吸附在催化剂表面的活性物种)。

(4)根据图示写出该反应的化学方程式:。
(5)在催化剂中添加少量多孔能提高转化率,其原因是。
(6)根据反应机理,该催化重整的过程可描述为。
-
17、工业上以金焙砂酸浸液(主要成分为和 , 忽略其它杂质)与硫铁矿(主要成分为 , 忽略其它杂质)为原料制备的流程如下:

回答下列问题:
(1)、硫铁矿和金焙砂酸浸液反应的离子方程式为。还原时间与还原率的关系如图所示,则最佳还原时间为小时。 (2)、加调时,与悬浊液中关系如图所示,则调为(填具体值),向调后的溶液中通入空气的目的是。
(2)、加调时,与悬浊液中关系如图所示,则调为(填具体值),向调后的溶液中通入空气的目的是。 (3)、已知:可以制备晶体。请补充完整以溶液为原料制备的实验方案:取溶液, , 静置、过滤、洗涤、干燥。(实验中须选用的试剂:稀硫酸、双氧水、1mol·L-1溶液、溶液)(4)、亚铁盐常用于氧化还原滴定。某实验测定样品中质量分数的方法如下。取样品,加水溶解,加入过量 , 充分反应后,将溶液加热煮沸除去剩余 , 冷却至室温,加入硫酸酸化,再加入标准溶液 , 充分反应后,用酸性溶液滴定过量的溶液至终点,到达滴定终点时消耗溶液的体积为。
(3)、已知:可以制备晶体。请补充完整以溶液为原料制备的实验方案:取溶液, , 静置、过滤、洗涤、干燥。(实验中须选用的试剂:稀硫酸、双氧水、1mol·L-1溶液、溶液)(4)、亚铁盐常用于氧化还原滴定。某实验测定样品中质量分数的方法如下。取样品,加水溶解,加入过量 , 充分反应后,将溶液加热煮沸除去剩余 , 冷却至室温,加入硫酸酸化,再加入标准溶液 , 充分反应后,用酸性溶液滴定过量的溶液至终点,到达滴定终点时消耗溶液的体积为。已知:酸性条件下与和反应的离子方程式如下:
①加入的目的是除去 , 已知反应后生成 , 写出该反应的化学方程式:。
②计算样品中的质量分数(写出计算过程)。
-
18、物质在水中存在电离平衡、水解平衡。请根据所学知识回答:(1)、25℃时,体积均为10 mL,pH均为2的醋酸溶液与一元酸溶液分别加水稀释至1000 mL,稀释过程中pH的变化如图所示。

①25℃时,醋酸的电离常数HX的电离常数。(填“>”、“<”或“=”,下同)
②稀释100倍后,醋酸溶液中由水电离出的c(H+)HX溶液中由水电离出的c(H+)。
(2)、泡沫灭火器的原理是硫酸铝、碳酸氢钠溶液之间发生反应。①NaHCO3溶液呈碱性的原因是(用离子方程式表示)
②使用时将灭火器倒过来摇动即可,试写出该反应的离子方程式:。
(3)、常温下,将pH=2的HA溶液和pH=12的溶液等体积混合,混合溶液的pH=5。该混合溶液中c(A-)-c(Na+)=mol/L(填准确数值,无需计算)。(4)、已知:二元酸H2R电离方程式是 , , 假设0.1 mol/LNaHR溶液c(H+)=a mol/L,则0.1 mol/LH2R溶液中c(H+)是___________A、小于 B、大于 C、等于 D、等于(5)、T℃时Kw=10-13 , 该温度下将Va LpH=a的NaOH溶液与VbL 10-b mol/L硫酸混合。若所得混合溶液呈中性,且a=12,b=1,则Va:Vb;若Va:Vb=1:3,且a=11,b=3,则所得溶液的pH=。 -
19、食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于 , 实验室用标准溶液测定食醋中醋酸的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示:

 (1)、选用(填“甲”或“乙”)滴定管量取白醋后,滴定管读数如丙图所示,此时液面显示读数为 , 将其稀释至备用。(2)、为尽可能的减少实验误差,应该选(填“酚酞”、“甲基橙”或“石蕊”)作指示剂。(3)、用标准氢氧化钠溶液滴定待测的白醋时,眼睛应该注视。(4)、该滴定实验达到终点时的现象是。(5)、用标准溶液滴定上述稀释后的醋酸溶液,滴定结果如表所示:
(1)、选用(填“甲”或“乙”)滴定管量取白醋后,滴定管读数如丙图所示,此时液面显示读数为 , 将其稀释至备用。(2)、为尽可能的减少实验误差,应该选(填“酚酞”、“甲基橙”或“石蕊”)作指示剂。(3)、用标准氢氧化钠溶液滴定待测的白醋时,眼睛应该注视。(4)、该滴定实验达到终点时的现象是。(5)、用标准溶液滴定上述稀释后的醋酸溶液,滴定结果如表所示:滴定次数
待测溶液的体积
标准溶液的体积
滴定前刻度
滴定后刻度
1
0.02
25.01
2
0.70
25.71
3
0.50
24.20
则该品牌白醋中醋酸含量为。
(6)、下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是______(填字母,下同)。A、读取溶液体积时,开始时仰视读数,滴定结束时俯视读数 B、取待测液的滴管,取液前滴定管尖嘴处无气泡,取液后尖嘴处出现气泡 C、碱式滴定管未用标准溶液润洗就直接注入标准溶液 D、滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥 -
20、乙醇-水催化重整可获得 , 其主要反应为:
反应①
反应②
在、 , 若仅考虑上述反应,平衡时和的选择性及的产率随温度的变化如图所示。
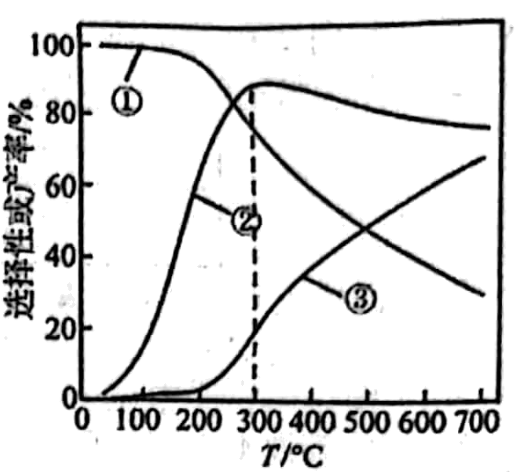
的选择性
下列说法不正确的是
A、反应的 B、图中曲线①表示平衡时选择性随温度的变化 C、一定温度下,增大可提高的平衡转化率 D、由图可知,后升高温度曲线②呈下降趋势,说明温度对反应②速率的影响比对反应①的大