相关试卷
-
1、已知:①白磷和的分子结构和部分化学键的键能分别如下图、表所示:

化学键
键能
②(白磷,)(红磷,) 。
下列说法正确的是
A、白磷和红磷互为同位素 B、相同条件下白磷比红磷稳定 C、等质量的白磷、红磷分别完全燃烧,放出热量更多的是白磷 D、(白磷,) -
2、某化学研究小组探究外界条件对化学反应:速率和平衡的影响图像如图所示。下列判断错误的是
 A、由图1可知: , 该反应 B、由图2可知:该反应 C、图3中,表示反应速率的是点1 D、图4中,则a曲线一定使用了催化剂
A、由图1可知: , 该反应 B、由图2可知:该反应 C、图3中,表示反应速率的是点1 D、图4中,则a曲线一定使用了催化剂 -
3、通过以下反应均可获取:
①太阳光催化分解水制氢:
②焦炭与水反应制氢:
③甲烷与水反应制氢:
下列有关说法正确的是
A、反应①中电能转化为化学能 B、压缩体积有利于反应②的发生 C、反应③若使用液态水,增大 D、 -
4、常温下,0.1mol∙L-1的HCOOH溶液加水稀释至0.010mol∙L-1的过程中,下列量始终保持增大的是A、 B、 C、 D、
-
5、下列说法正确的是A、 , 恒温恒容下达平衡后加入 , 反应增大 B、燃烧热为 , 则 C、 , 则完全破坏等质量和中的化学键,所需能量大 D、 , 则在中完全燃烧放热
-
6、某温度下,浓度都是的两种气体和 , 在密闭容器中反应生成气体。反应后,测得剩余的为 , 用表示的反应速率 , 生成的为 , 则该反应的化学方程式是A、 B、 C、 D、
-
7、为实现废物“资源化”利用的目的,以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3 , 其主要流程如图所示:

已知:氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2受热分解为CaCl2和O2。
(1)、下列措施可以提高氯气利用率的是(填序号)。A.提高通入Cl2的速率 B.充分搅拌浆料 C.氯化时控制电石渣过量
(2)、“氯化”中Cl2转化为Ca(ClO3)2的总反应方程式为(该反应的化学方程式中有两种生成物的化学计量数比为1:5)。(3)、活性炭的作用是。(4)、下图为有关物质的溶解度曲线,“转化”中加入稍过量KCl固体,在低温下可析出KClO3晶体的原因。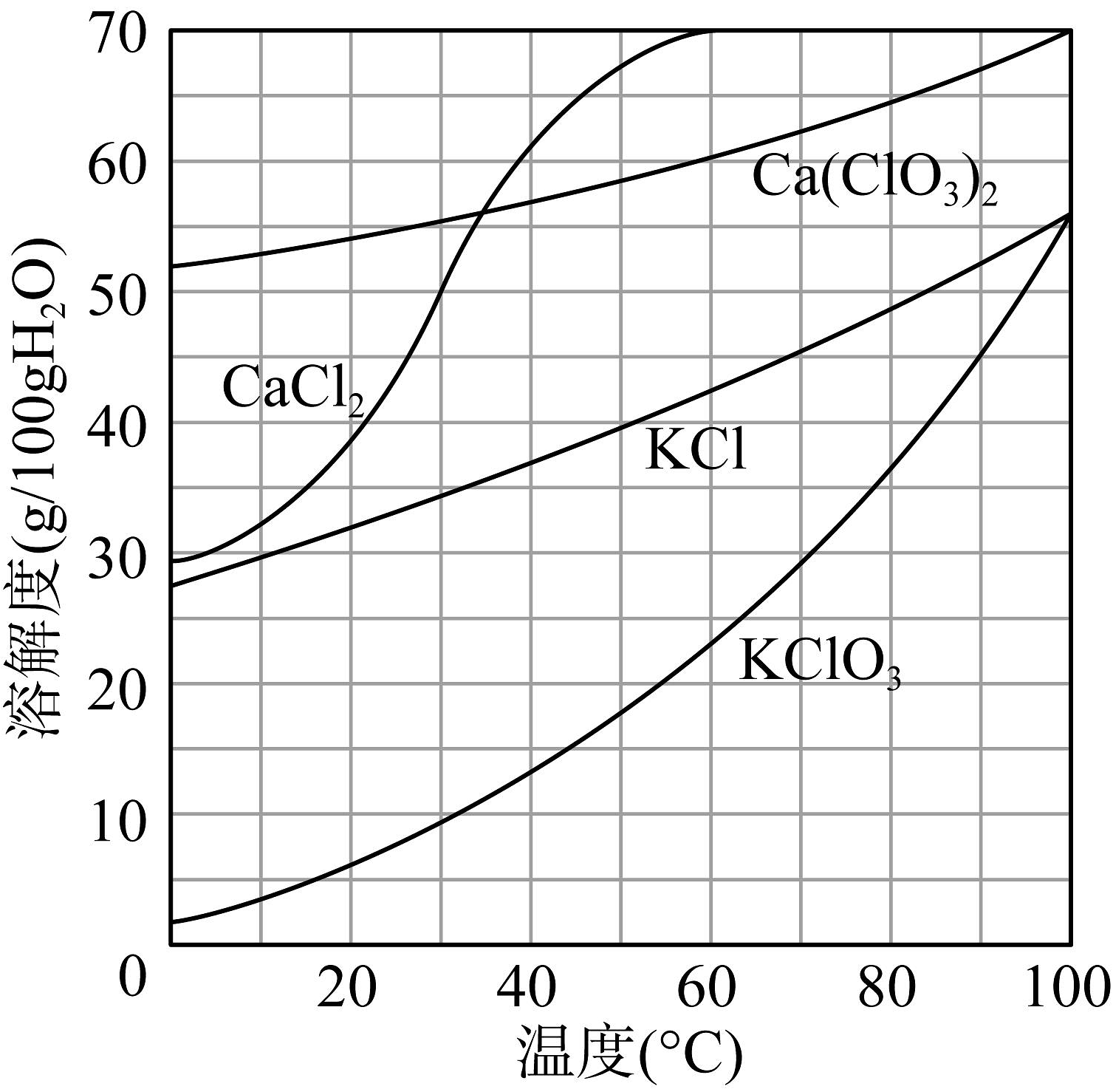 (5)、“分解比”是衡量氯化程度的标准,氯化后溶液中CaCl2总质量与Ca(ClO3)2总质量的比值称为“分解比”,分解比的理论值是(精确至小数点后两位)。下图为分解比与氯化温度的关系,分解比的数值随氯化温度升高而增大的原因可能是。
(5)、“分解比”是衡量氯化程度的标准,氯化后溶液中CaCl2总质量与Ca(ClO3)2总质量的比值称为“分解比”,分解比的理论值是(精确至小数点后两位)。下图为分解比与氯化温度的关系,分解比的数值随氯化温度升高而增大的原因可能是。
-
8、氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备和 , 探究其氧化还原性质。

回答下列问题:
(1)、盛放粉末的仪器名称是 , a中的试剂为。(2)、b中采用的加热方式是 , c中采用冰水浴冷却的目的是。(3)、d的作用是 , 可选用试剂(填标号)。A. B. C. D.
(4)、实验中有同学发现二氧化锰粉末和浓盐酸的反应随着盐酸浓度的降低,反应会停止。针对上述现象小组同学对“影响氯气生成的原因”进行了讨论,提出假设:假设1:浓度降低影响氯气的生成。
假设2:。
并设计实验方案进行验证:(限选试剂:浓、固体、固体、稀盐酸)
步骤
实验操作
预测现象和结论
①
往不再产生氯气的装置中,加入继续加热
若有黄绿色气体生成,则假设1成立
②
若有黄绿色气体生成,则假设2成立
(5)、利用次氯酸钠的强氧化性可以去除水体中过量氨氮(以表示),防止水体富营养化,其反应过程可以表示如下:I.
II.
III.
①写出用次氯酸钠去除氨氮的总反应的化学方程式:。
②从该反应过程并结合HClO的性质分析,温度过高时氨氮的去除率降低的主要原因是(用化学方程式表示)。
-
9、物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图1、图2分别为钠和氯及其化合物的“价-类”二维图,请回答下列问题:
 (1)、填写二维图中缺失的化学式:① , ②。(2)、物质③常用于实验室制取 , 则③的化学式是。(3)、①从物质类别角度看,HClO属于 , 一般能与下列(填字母序号)类别物质发生反应。
(1)、填写二维图中缺失的化学式:① , ②。(2)、物质③常用于实验室制取 , 则③的化学式是。(3)、①从物质类别角度看,HClO属于 , 一般能与下列(填字母序号)类别物质发生反应。a.金属单质 b.非金属单质 c.酸性氧化物 d.碱性氧化物 e.酸 f.碱 g.盐
②从化合价角度看,HClO具有(填“还原性”或“氧化性”或“既有氧化性又有还原性”),已知少量与溶液反应有生成,该反应的离子方程式为。
(4)、氢化钠(NaH)可在野外用作生氢剂,用作生氢剂时的化学反应原理为: , 氧化剂和还原剂的化学计量数之比为。(5)、若将84消毒液(有效成分)与双氧水混用给游泳池消毒,反应产生的会促进藻类快速生长,使池水变绿。已知 , 且该反应只生成一种气体,写出化学方程式并用单线桥法表示电子转移的方向和数目:。 -
10、碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是
 A、用KI淀粉试纸和食醋可以检验加碘盐中是否含 B、足量能使湿润的KI淀粉试纸变白的原因可能是: C、由图可知氧化性的强弱顺序为 D、途径Ⅱ反应生成I2 , 该反应中NaHSO3作还原剂
A、用KI淀粉试纸和食醋可以检验加碘盐中是否含 B、足量能使湿润的KI淀粉试纸变白的原因可能是: C、由图可知氧化性的强弱顺序为 D、途径Ⅱ反应生成I2 , 该反应中NaHSO3作还原剂 -
11、下列关于钠及其化合物的说法错误的是A、将金属钠放入盛有饱和溶液的小烧杯中,既有气体放出,又有沉淀产生 B、与的阴、阳离子个数比相同 C、、、、长期放置在空气中,最终都会转变成 D、溶液和发生反应时,产物不会随反应物用量的改变而改变
-
12、天然气是应用广泛的燃料,但含有少量H2S等气体。在酸性溶液中利用硫杆菌可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
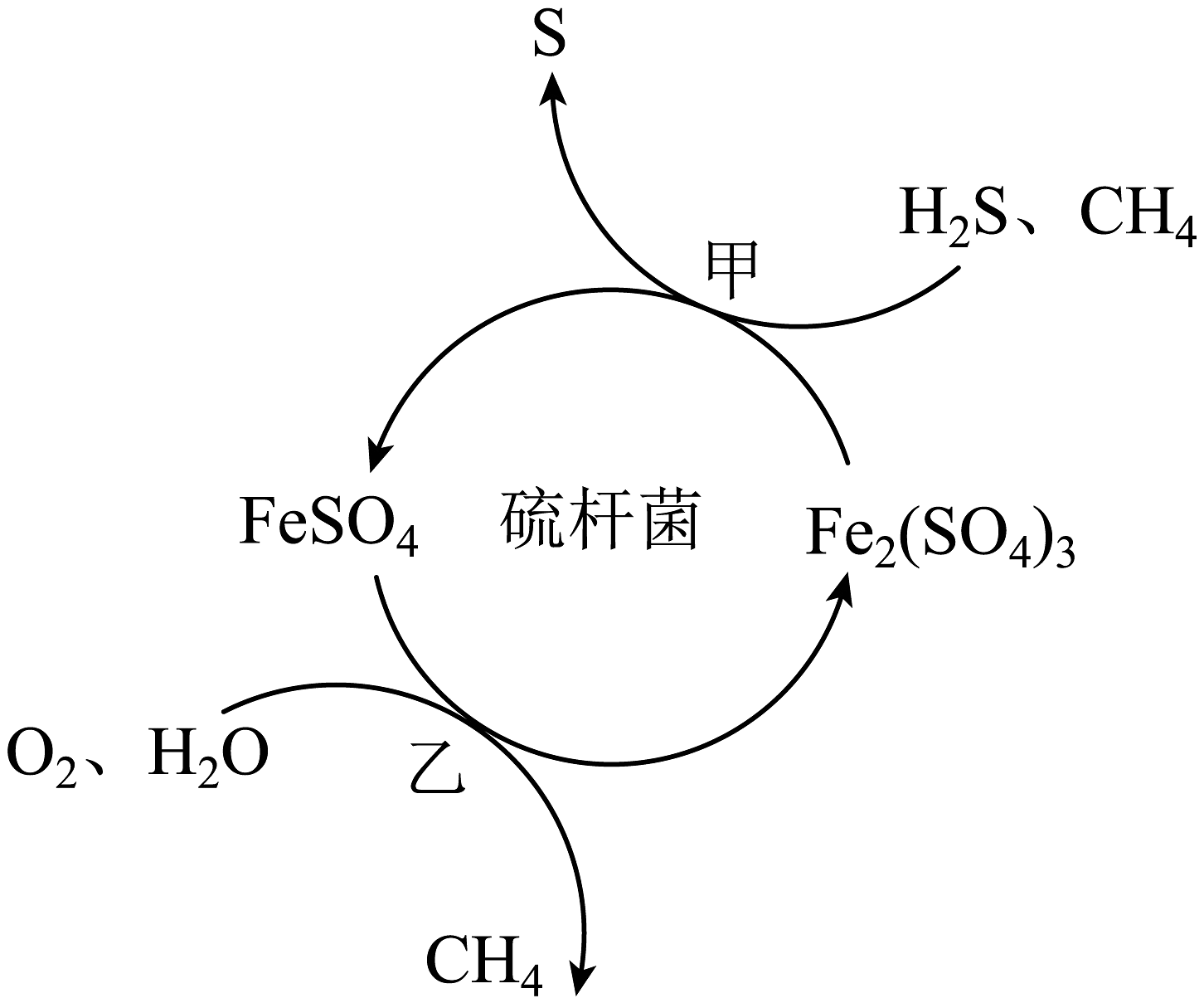 A、过程甲中氧化产物与还原产物的化学计量数之比为1:2 B、脱硫过程O2间接氧化H2S C、该脱硫过程需要不断添加Fe2(SO4)3溶液 D、过程乙发生反应的离子方程式为:
A、过程甲中氧化产物与还原产物的化学计量数之比为1:2 B、脱硫过程O2间接氧化H2S C、该脱硫过程需要不断添加Fe2(SO4)3溶液 D、过程乙发生反应的离子方程式为: -
13、使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是

试剂a
试剂b
A.
B.
C.
CuSO4
D.
CH3COOH
A、A B、B C、C D、D -
14、用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
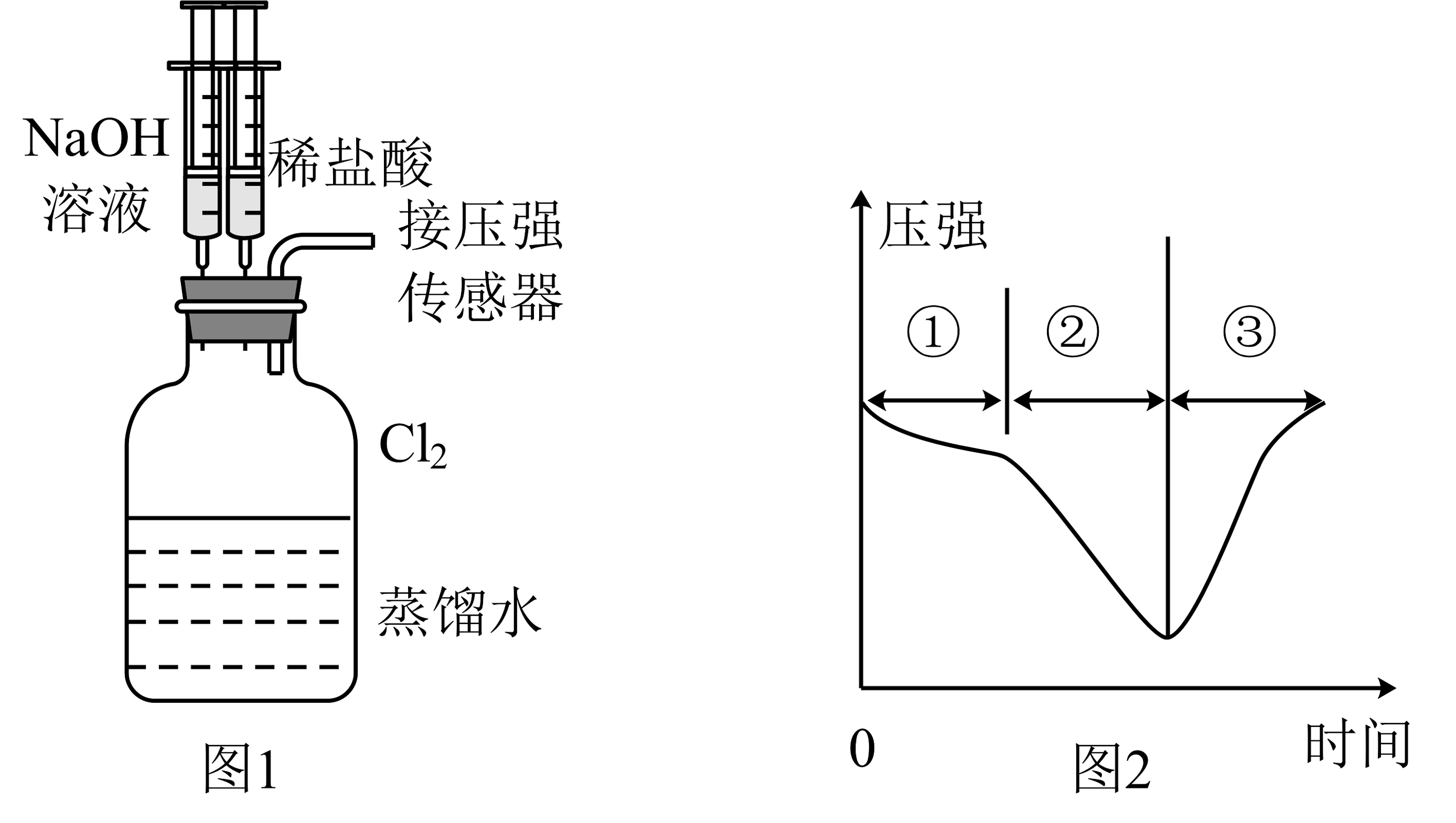 A、阶段①说明氯气溶于水,溶于水的氯气全部与水反应 B、阶段②的压强变小,可利用该过程发生的反应制备漂白粉 C、阶段③发生反应的离子方程式为 D、若将换成 , 则压强变化不会出现图2趋势
A、阶段①说明氯气溶于水,溶于水的氯气全部与水反应 B、阶段②的压强变小,可利用该过程发生的反应制备漂白粉 C、阶段③发生反应的离子方程式为 D、若将换成 , 则压强变化不会出现图2趋势 -
15、“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A.
环保行动:用净水
具有氧化性
B.
化学实验员:检验是否失效
C.
用卤水点热豆浆制豆腐
卤水中电解质能使豆浆胶体聚沉
D.
农业活动:用生石灰改良酸性土壤
CaO是一种碱性氧化物
A、A B、B C、C D、D -
16、下列“类比”结果正确的是A、向固体中加入少量水放出热量,则向固体中加入少量水也放出热量 B、相同温度下,的溶解度比的大,则的溶解度也比的大 C、酸性氧化物与水反应生成碳酸,则酸性氧化物与水反应生成硫酸 D、少量通入溶液中产生白色沉淀,则通入溶液也产生白色沉淀
-
17、下列叙述正确的是A、NH3溶于水能导电,所以NH3为电解质 B、等质量的与足量氧气反应,在常温、加热条件下转移电子数一样多 C、漂白液和漂白粉都可用于棉、麻、纸张的漂白剂,但二者的原理不同 D、金属元素发生化学反应形成各种焰色用以制五彩缤纷的烟花
-
18、化学是一门以实验为基础的学科。下列实验方案能够达到实验目的的是
实验方案


实验目的
A.通过焰色反应确认溶液中是否含有K+
B.验证Na与水反应是否为放热反应
实验方案


实验目的
C.比较Na2CO3和NaHCO3的热稳定性
D.制备Fe(OH)3胶体
A、A B、B C、C D、D -
19、下列关于的化合物之间转化反应的离子方程式书写正确的是A、碱转化为酸式盐: B、过氧化物转化为碱: C、单质转化为一种盐: D、碱转化为两种盐:
-
20、利用可将废水中的转化为对环境无害的物质后排放。反应原理为:(未配平)下列说法正确的是A、是氧化产物 B、可用替换 C、氧化剂与还原剂的化学计量数之比为 D、若生成 , 则理论上消耗