相关试卷
-
1、下列各图与对应叙述不相符的是
 A、图甲向碳酸钠固体中逐滴加入过量稀盐酸 B、图乙表示等质量的Na2CO3固体和NaHCO3固体溶于等量水的热量变化,曲线1代表的是NaHCO3溶于水时温度的变化情况 C、图丙向CuSO4溶液中加入过量Ba(OH)2溶液 D、图丁表示氯水在光照过程中氯离子的浓度变化
A、图甲向碳酸钠固体中逐滴加入过量稀盐酸 B、图乙表示等质量的Na2CO3固体和NaHCO3固体溶于等量水的热量变化,曲线1代表的是NaHCO3溶于水时温度的变化情况 C、图丙向CuSO4溶液中加入过量Ba(OH)2溶液 D、图丁表示氯水在光照过程中氯离子的浓度变化 -
2、对于反应:2NaClO3+SO2+H2SO4 = 2ClO2 +2NaHSO4 , 下列说法不正确的是A、NaClO3是氧化剂 B、SO2发生氧化反应 C、还原性:SO2 <ClO2 D、每有1mol电子转移将生成1molClO2
-
3、下列说法正确的是A、金属钠着火时,可用湿抹布将其盖灭 B、为防止试剂污染,取用金属钠后多余的钠不能放回原试剂瓶中 C、做焰色试验时需用盐酸洗净铂丝 D、可用pH试纸测氯水的酸碱性
-
4、下列离子方程式正确的是A、钠与水反应: B、碳酸氢钠溶液与氢氧化钠溶液混合: C、稀硫酸和氢氧化钡溶液反应: D、Fe与盐酸反应:
-
5、实验室利用下列装置进行实验,能达到实验目的的是
 A、用装置甲制取Cl2 B、用装置乙除去Cl2中混有的HCl气体 C、用装置丙验证潮湿的Cl2具有漂白性 D、用装置丁吸收尾气中的Cl2
A、用装置甲制取Cl2 B、用装置乙除去Cl2中混有的HCl气体 C、用装置丙验证潮湿的Cl2具有漂白性 D、用装置丁吸收尾气中的Cl2 -
6、下列关于物质的性质与用途不具有对应关系的是A、盐酸具有酸性,可用于金属除锈 B、Cl2能溶于水,可用于工业制盐酸 C、常温下氯气与铁不反应,液氯可以保存在干燥的钢瓶中 D、NaHCO3与盐酸反应,可用作抗酸药
-
7、下列有关说法正确的是A、将5.85gNaCl固体完全溶于1L水中,所得氯化钠溶液物质的量浓度为0.1mol/L B、0.1mol/LMgCl2溶液中含有 C、标准状况下18g水的体积约为22.4L D、同温同压下,等质量的CO与CO2的体积之比为11∶7
-
8、在给定条件下,下列物质间转化能实现的是A、 B、 C、 D、
-
9、下列各组中的离子,能在溶液中大量共存的是A、 B、 C、 D、
-
10、下列物质中属于电解质的是A、蔗糖 B、CO2 C、K2SO4 D、盐酸
-
11、化学与生活、环境和生产密切相关。下列过程不涉及氧化还原反应的是A、用氯气对自来水进行消毒 B、漂白粉失效 C、新切开的钠表面变暗 D、用小苏打蒸制糕点
-
12、航天科技的发展与化学密切相关。下列说法不正确的是A、新一代运载火箭使用的液氢为非金属单质 B、光束通过空间站使用的纳米气凝胶时,可观察到丁达尔效应 C、空间站使用石墨烯存储器,石墨烯与金刚石互为同素异形体 D、航天飞船内安装盛有过氧化钠颗粒的装置,它的用途是再生氧气,过氧化钠属于碱性氧化物
-
13、化学需氧量(COD)是指用强氧化剂将1 L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以O2为氧化剂时所消耗O2的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一。Fenton(Fe2+/H2O2)法能产生Fe3+和具有强氧化性的羟基自由基(·OH)并引发一系列链式反应,被广泛应用于有机废水的治理。(1)、羟基自由基(·OH)的电子式为。(2)、分别取初始pH=4、COD=80的废水200 mL,加入2 mL H2O2 , 改变起始投加FeSO4·7H2O的量,反应相同时间,测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g/L时,反应后水样COD不降反升的原因可能是。
 (3)、已知:·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是。(4)、在Fenton法的基础上改进的基于硫酸根自由基()的氧化技术引起关注。研究发现,一种Mn3O4-GO石墨烯纳米复合材料对催化活化产生具有很好的效果。的结构为
(3)、已知:·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是。(4)、在Fenton法的基础上改进的基于硫酸根自由基()的氧化技术引起关注。研究发现,一种Mn3O4-GO石墨烯纳米复合材料对催化活化产生具有很好的效果。的结构为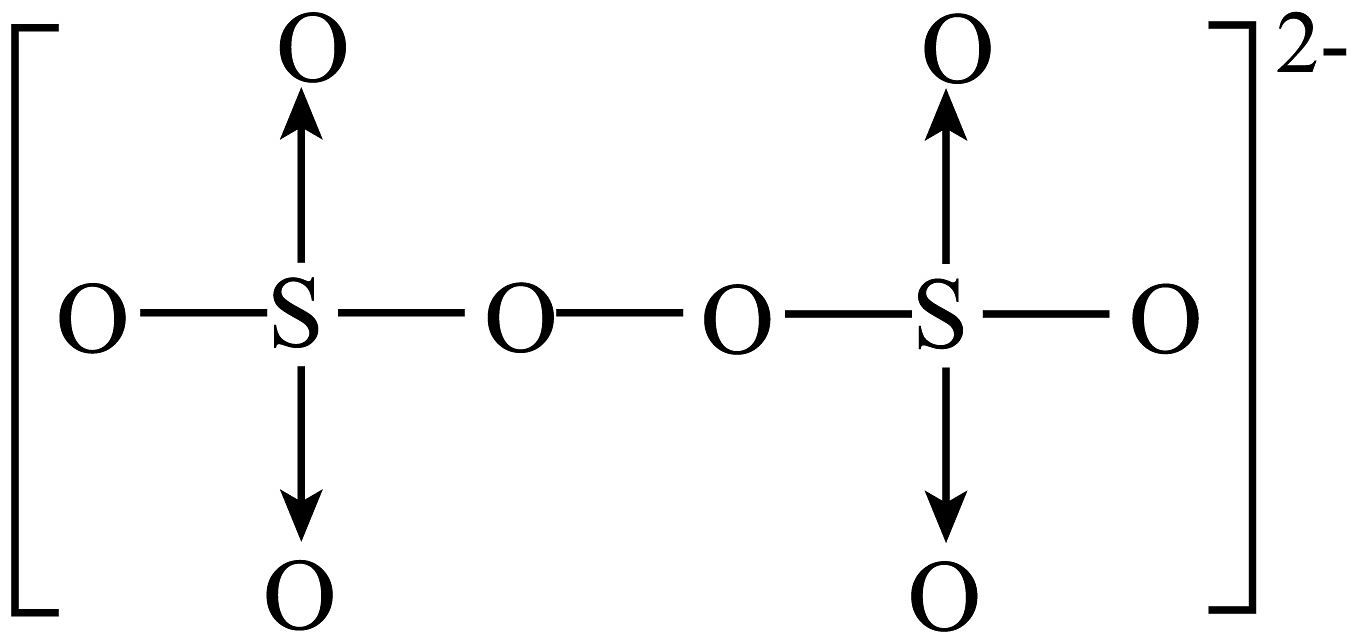 。
。①中-2价氧原子与-1价氧原子的个数之为。
②一种制取Mn3O4-GO石墨烯纳米复合材料的物种转化关系如图所示(GO表示石墨烯),在石墨烯表面制得1 mol Mn3O4-GO,理论上需要消耗NaBH4的物质的量为。
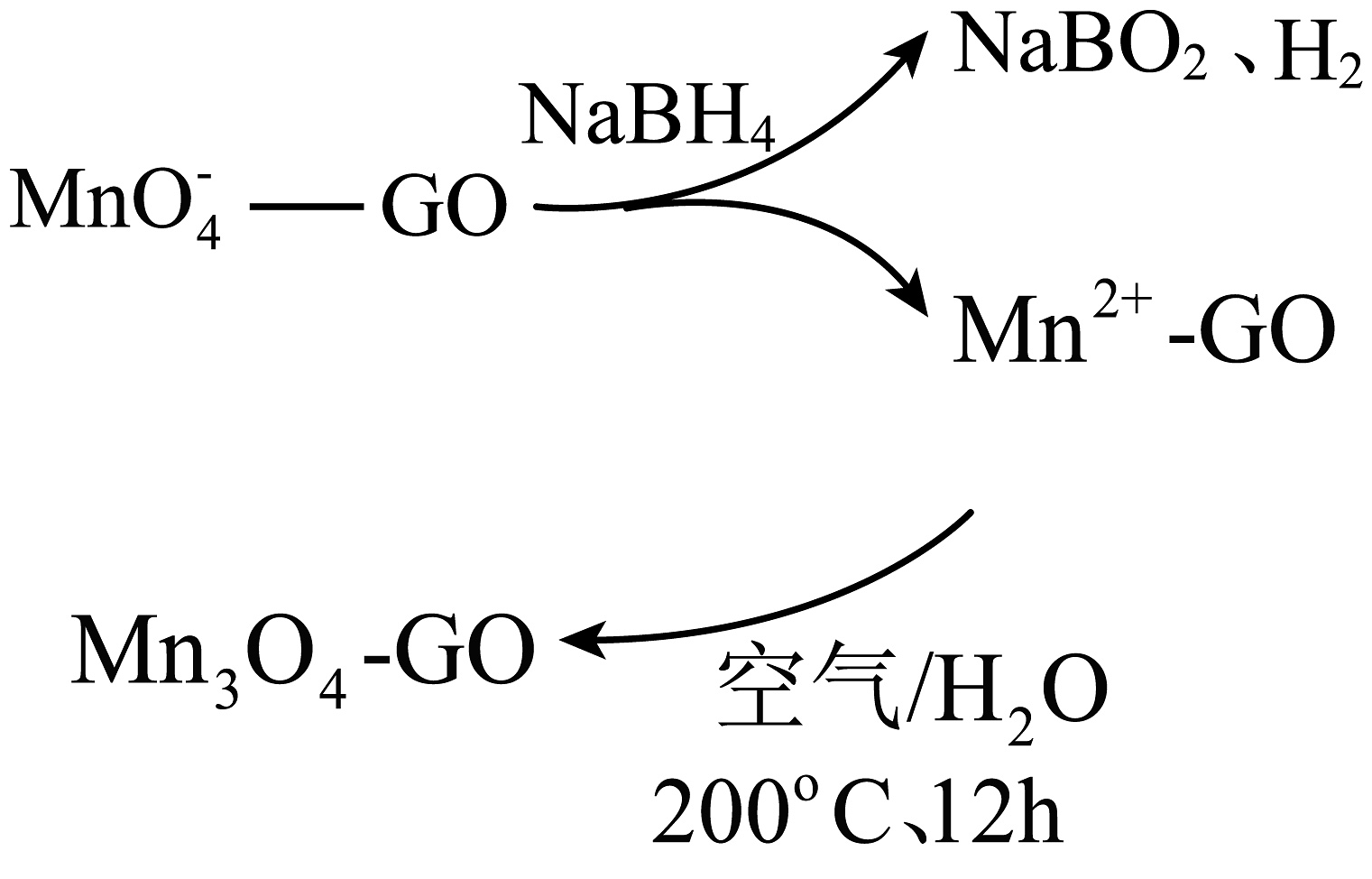
-
14、深共晶溶剂(DESs)是由两种或多种物质通过氢键、范德华力等相互作用形成的低熔点混合物。深共晶溶剂主要由氢键供体(能形成氢键的氢原子)的组分与含氢键受体(能与氢原子形成氢键的原子)的组分混合,其中氢键供体通常包括多元醇、尿素和羧酸等;氢键受体通常有季铵盐类、酰胺、有机酸等。(1)、将乙二醇(HOCH2CH2OH)与氯化胆碱(
 )按一定比例混合搅拌至形成均一透明液体,制得DESs。
)按一定比例混合搅拌至形成均一透明液体,制得DESs。① 乙二醇分子中氢键供体的数目为。
② 不同配比氯化胆碱与乙二醇混合的二元相图如图所示。相同条件下,氯化胆碱的熔点(填“>”“=”或“<”)乙二醇的熔点。制备熔点达到最低值的DESs时,氯化胆碱与乙二醇的物质的量之比为。
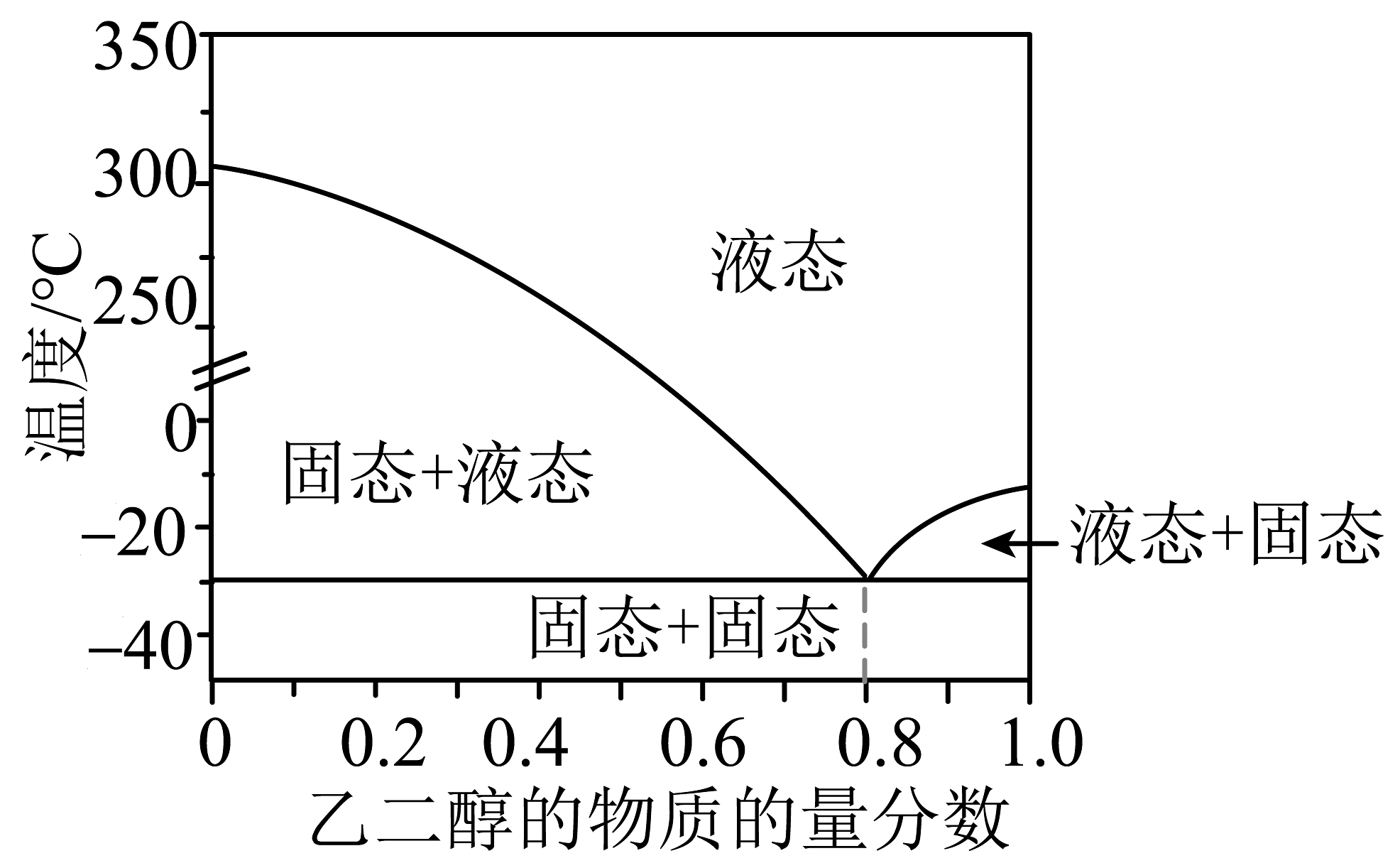 (2)、深共晶溶剂(DESs)可从电池正极材料LiFePO4中回收锂,将LiFePO4与DESs按照一定比例混合,再通入O3 , 能氧化浸出锂。实验装置如图所示。
(2)、深共晶溶剂(DESs)可从电池正极材料LiFePO4中回收锂,将LiFePO4与DESs按照一定比例混合,再通入O3 , 能氧化浸出锂。实验装置如图所示。
①冷凝管的作用为。
②LiFePO4的晶胞结构如图所示。其中“○”表示Li+ , O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。晶胞中含有LiFePO4的单元数有个。
 (3)、已知:电负性H−2.1,C−2.5,O−3.5,通常用酯基和NH3生成酰胺(官能团
(3)、已知:电负性H−2.1,C−2.5,O−3.5,通常用酯基和NH3生成酰胺(官能团 ),不用羧基和NH3直接反应,根据元素电负性的变化规律,解释原因。
),不用羧基和NH3直接反应,根据元素电负性的变化规律,解释原因。 -
15、氮元素是地球上极为丰富的元素,氮元素可形成多种化合物。(1)、NH3分子的空间结构为 , C、N、O三种元素的电负性从大到小的顺序是。(2)、肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。肼能与硫酸反应生成N2H6SO4 , N2H6SO4与硫酸铵化合物类型相同。
①N2H4的结构式为。
②写出肼与硫酸反应生成N2H6SO4的化学方程式。
③N2H6SO4晶体内不存在(填字母)。
a.离子键 b.共价键 c.配位键 d.范德华力
④肼可用作火箭燃料,火箭推进器中装入液态肼和过氧化氢,当它们混合时即产生气体,并放出大量热。已知1 g肼与足量过氧化氢反应生成氮气和水蒸气,放出20.1kJ的热量,写出该反应的热化学方程式为。
(3)、下图表示某种含氮有机物的结构,其分子内4个氮原子分别位于正四面体的4个顶点,分子内存在空腔,能嵌入某离子或某分子并形成4个氢键予以识别。下列分子或离子中,能被该有机物识别的是___________(填字母)。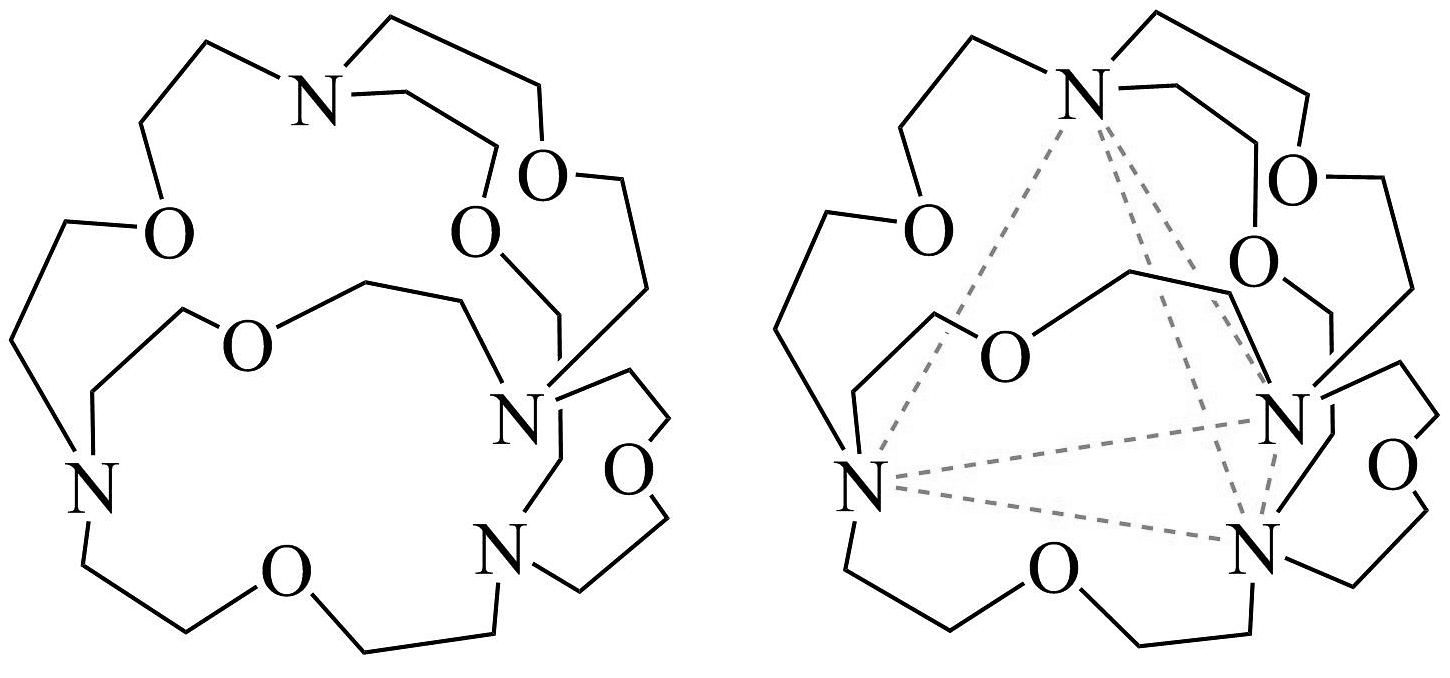 A、CF4 B、CH4 C、 D、H2O
A、CF4 B、CH4 C、 D、H2O -
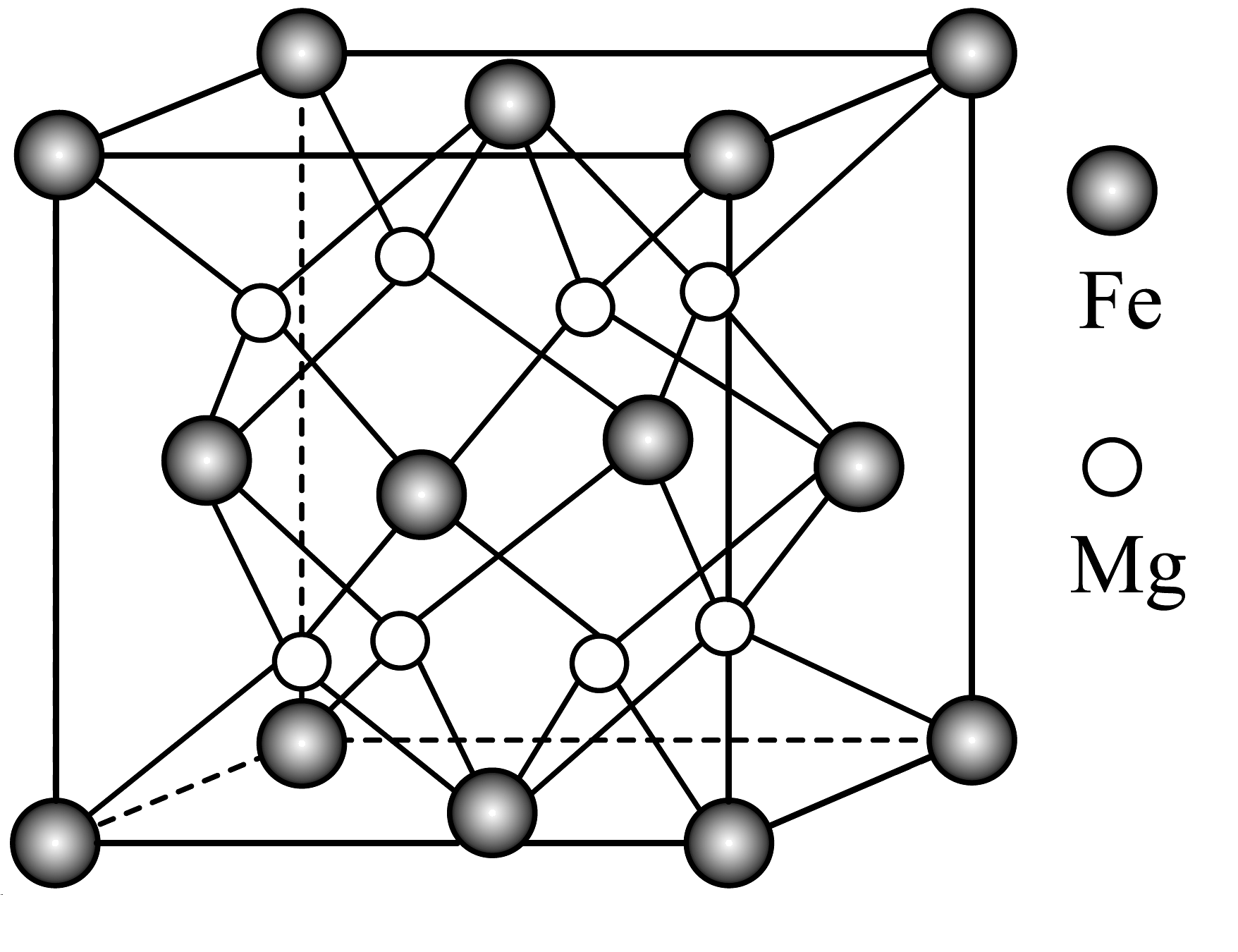
16、铁及其化合物在生活中有广泛应用。(1)、Fe元素在周期表中的位置是 , 位于元素周期表区。(2)、铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图所示。储氢时,H2分子位于晶胞体心和棱的中心位置。该合金储满氢后所得晶体的化学式是。
 (3)、实验室用KSCN溶液、苯酚检验Fe3+。
(3)、实验室用KSCN溶液、苯酚检验Fe3+。①苯酚分子中碳原子的杂化方式为。
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H—S—C≡N )和异硫氰酸(H—N=C=S ),异硫氰酸分子σ键与π键的个数之比为 。
(4)、FeBr2为只含有离子键的离子化合物,其晶胞结构如图,距一个Fe2+最近的所有Br-为顶点构成的几何形状为。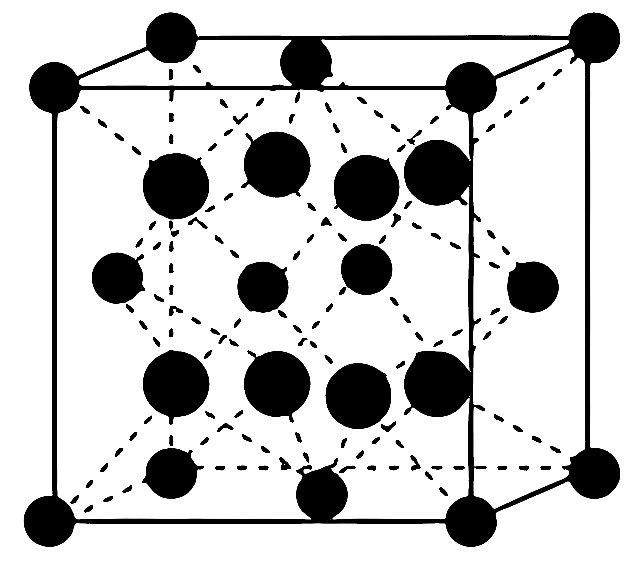
-
17、下列变化中:
①干冰气化;②硝酸钾熔化;③食盐溶于水;④HCl溶于水;⑤蔗糖溶于水;⑥HI分解。
(1)、未破坏化学键的是(填序号,下同)。(2)、仅离子键被破坏的是。(3)、仅共价键被破坏的是。 -
18、由硫酸铜溶液制取硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}的实验如下:
步骤1:向盛有4 mL 0.1 mol·L-1蓝色CuSO4溶液的试管中,滴加几滴1 mol·L-1氨水,有蓝色沉淀生成;
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液;
步骤3:向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法不正确的是
A、最终所得溶液中大量存在NH、[Cu(NH3)4]2+、 B、步骤2所发生反应的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- C、步骤3中用加入乙醇降低了溶剂的极性从而析出晶体 D、H2O与Cu2+的配位能力大于NH3 -
19、室温下,下列实验探究方案能达到探究目的的是
选项
实验方案
探究目的
A
用pH试纸测定CH3COOH和CH2ClCOOH溶液的酸性
键的极性对羧酸酸性的影响
B
将SO2气体通入紫色石蕊溶液中,观察溶液颜色变化
SO2是否具有漂白性
C
向0.1 mol·L-1H2O2溶液中滴加0.01 mol·L-1KMnO4溶液,溶液褪色
H2O2具有还原性
D
在饱和Na2CO3溶液中通入足量CO2气体,观察现象
比较Na2CO3和NaHCO3在水中溶解度大小
A、A B、B C、C D、D -
20、下列叙述正确的是A、锗原子(32Ge)基态电子排布式为[Ar]4s24p2 B、Na2O和Na2O2固体中含有的阳离子和阴离子的个数比均为1:2 C、液氨作为清洁能源的反应原理是4NH3+5O24NO+6H2O D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同