相关试卷
-
1、L/mol是哪个物理量的单位A、摩尔质量 B、体积 C、气体摩尔体积 D、密度
-
2、近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示)。苯(
 )属于
)属于 A、氧化物 B、硫化物 C、无机物 D、有机物
A、氧化物 B、硫化物 C、无机物 D、有机物 -
3、化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是A、苏打--NaHCO3 B、醋酸--C2H5OH C、明矾—KAl(SO4)2 D、生石灰—CaO
-
4、自然界含量最多的金属元素是A、氧 B、镁 C、铝 D、钠
-
5、我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Al、Ni、Fe 等元素。回答下列问题:(1)、下列不同状态的硼中,失去一个电子需要吸收能量最多的是 (填标号)。
A.

B.

C.
 (2)、镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是。(3)、Al2O3的熔点(2054℃)很高,工业冶炼铝时要加入冰晶石(化学式为Na3AlF6)来降低生产成本,如下图所示为冰晶石的晶胞。用“
(2)、镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是。(3)、Al2O3的熔点(2054℃)很高,工业冶炼铝时要加入冰晶石(化学式为Na3AlF6)来降低生产成本,如下图所示为冰晶石的晶胞。用“ ”和“
”和“  ”代表Na+”或“AlF ”。图中“
”代表Na+”或“AlF ”。图中“  ”位于大立方体顶点和面心,“
”位于大立方体顶点和面心,“  ”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是(填“Na+”或“AlF”);与Na+距离相等且最近的Na+有个。
”位于大立方体的12条棱的中点和8个小立方体的体心。则大立方体的体心处△代表的微粒是(填“Na+”或“AlF”);与Na+距离相等且最近的Na+有个。
-
6、
根据物质的结构特点,回答以下问题。
I.磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是 , 该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,双聚分子中存在四元环结构。画出双聚FeCl3分子的结构式。
(3)苯胺(
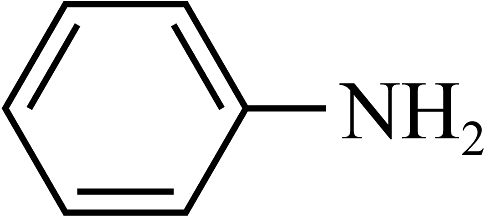 )的晶体类型是。苯胺与甲苯(
)的晶体类型是。苯胺与甲苯(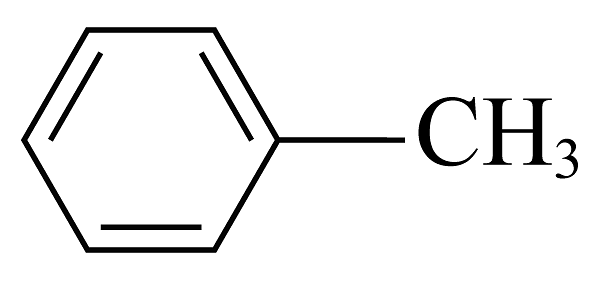 )的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),主要原因是。相同条件下,苯胺(
)的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),主要原因是。相同条件下,苯胺( )在水中的溶解能力(填“大于”、“小于”或“等于”)甲苯(
)在水中的溶解能力(填“大于”、“小于”或“等于”)甲苯( )的在水中的溶解能力。
)的在水中的溶解能力。II.有机物的结构与性质息息相关,官能团决定了有机物的主要化学性质。
(4)具有α-H的醛或酮,在酸或碱的催化作用下,与另一分子醛或酮发生缩合,生成β-羟基醛或β-羟基酮。以乙醛为例,其过程可表示如下:

请从元素电负性的角度解释第一步加成反应发生的原理。
(5)已知醛基(—CHO)能够和银氨溶液发生银镜反应,如乙醛(CH3CHO)发生的银镜反应:CH3CHO+2[Ag(NH3)2]OH2Ag↓+CH3COONH4+3NH3↑+H2O。请根据甲醛(HCHO)的结构,推测并写出甲醛和银氨溶液发生的化学反应方程式:。
-
7、碳、氮、氧、氯等元素形成的一系列化合物广泛应用于科研、医疗、工农业生产等领域。钴单质及其化合物在生产、生活中有广泛应用。回答下列问题:
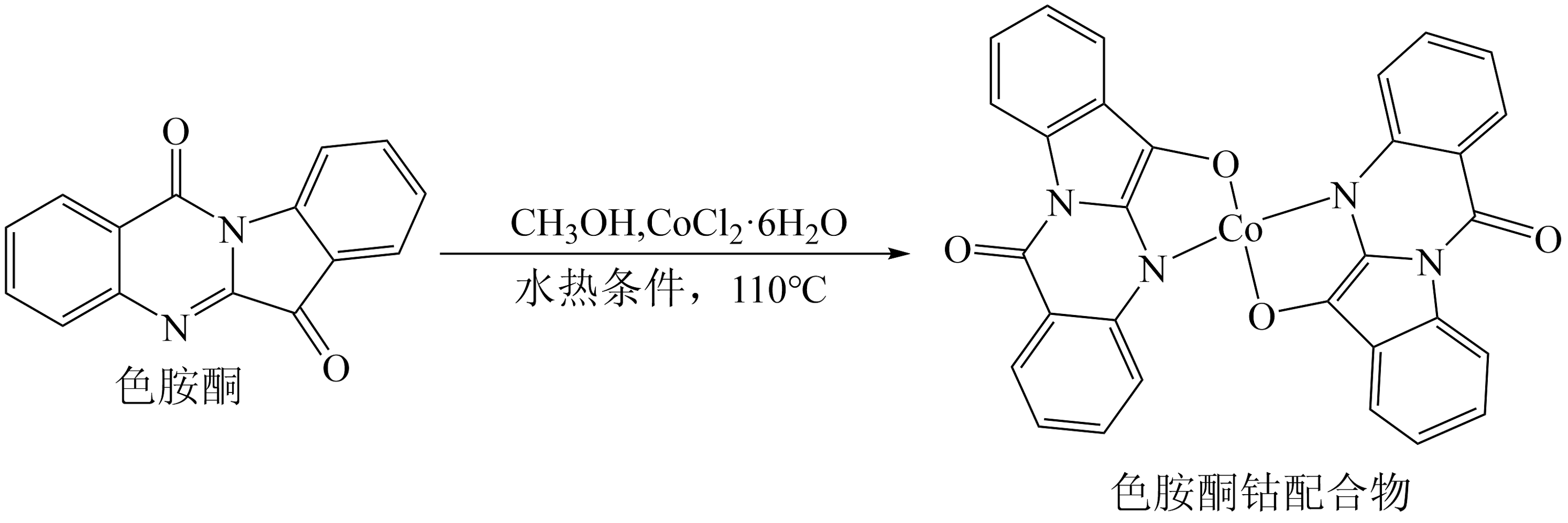 (1)、写出基态C原子核外电子排布的轨道表示式。(2)、C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是_______(填编号)。A、 B、 C、 D、苯(3)、与光气反应可用于制取四氯化钛。中σ 键和π键的数目比为 , 其空间构型为。(4)、基态Co原子的价层电子排布式为。(5)、用甲醇作为溶剂,可以与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如上图所示),色胺酮分子中所含的四种元素(H、C、N、O)的电负性由大到小的顺序为(填元素符号),色胺酮分子中N原子的杂化类型有。(6)、乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是。
(1)、写出基态C原子核外电子排布的轨道表示式。(2)、C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是_______(填编号)。A、 B、 C、 D、苯(3)、与光气反应可用于制取四氯化钛。中σ 键和π键的数目比为 , 其空间构型为。(4)、基态Co原子的价层电子排布式为。(5)、用甲醇作为溶剂,可以与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如上图所示),色胺酮分子中所含的四种元素(H、C、N、O)的电负性由大到小的顺序为(填元素符号),色胺酮分子中N原子的杂化类型有。(6)、乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是。 -
8、下列关于化学式为[Co(NH3)4Cl2]Cl的配合物的说法正确的是A、配体是NH3 , 配位数是4 B、配合物[Co(NH3)4Cl2]Cl中Co元素的化合价是+2价 C、配合物中的NH3的H—N—H键角大于游离NH3的键角 D、在1 mol该配合物中加入足量AgNO3溶液,可以得到3 mol AgCl沉淀
-
9、硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,环状分子的结构为
 。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关说法正确的是 A、的空间构型为正四面体 B、是共价晶体 C、和中的键角相等 D、的沸点高于
。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关说法正确的是 A、的空间构型为正四面体 B、是共价晶体 C、和中的键角相等 D、的沸点高于 -
10、下列说法正确的是
①Na核外电子存在6种空间运动状态
②在金属活动性顺序表中,金属镁比铝活泼,因此镁的第一电离能小于铝的第一电离能
③杂化轨道用于形成键或用来容纳孤电子对
④熔、沸点由高到低:氯化钠>金刚石>二氧化碳
⑤键角:H2O<NH3
A、①③⑤ B、②③⑤ C、③④⑤ D、①②④ -
11、芳樟醇结构如下图所示,在一定条件下发生消去反应生成芳樟烯。下列说法正确的是
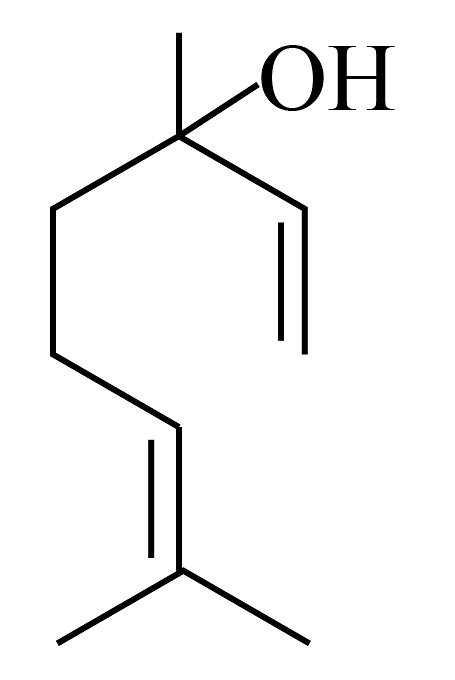 A、芳樟醇存在顺反异构体 B、芳樟醇中含有1个手性碳原子 C、芳樟醇在水中溶解度小于芳樟烯 D、芳樟醇不能发生消去反应
A、芳樟醇存在顺反异构体 B、芳樟醇中含有1个手性碳原子 C、芳樟醇在水中溶解度小于芳樟烯 D、芳樟醇不能发生消去反应 -
12、第三周期,基态原子的第一电离能处于Al、P之间的元素有A、1种 B、2种 C、3种 D、4种
-
13、我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物下列化学用语或图示表达不正确的是A、的电子式:
 B、基态的价电子排布式:3d54s1
C、H2O的球棍模型:
B、基态的价电子排布式:3d54s1
C、H2O的球棍模型: D、基态S原子的价层电子的轨道表示式:
D、基态S原子的价层电子的轨道表示式:
-
14、一种钠硫电池以钠和硫为电极反应物,为正极材料,陶瓷为电解质隔膜。下列说法正确的是A、电离能大小: B、半径大小: C、电负性大小: D、酸性强弱:
-
15、
自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
I.某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为:。
(1)冰水浴的作用是________。
(2)用双线桥表示该反应电子转移的方向和数目________。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(),需将其转化为除去。下列试剂中,可将转化为的是_______(填字母序号)。
A. B. C. D. (4)ClO2的定量测定:为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:量取二氧化氯消毒液于锥形瓶中,加蒸馏水稀释至 , 再向其中加入过量溶液,充分振荡,发生反应2ClO2+2KI=2KClO2+I2;再用0.10 mol·L-1Na2S2O3标准溶液与I2反应,通过测定消耗Na2S2O3标准溶液的体积可计算出ClO2与KI反应生成I2的物质的量为2.75×10-4mol。计算该二氧化氯消毒液中ClO2的物质的量浓度________。(写出计算过程)
Ⅱ.用过氧化钠制备高铁酸钾:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: , 再加入适量饱和KOH溶液反应得到K2FeO4。
(5)该反应的还原剂是________。
(6)当该反应转移20mol电子时,产生标准状况下氧气的体积为________L。
(7)上述反应在熔融状态下进行,而不在水溶液中进行的原因是________(用化学方程式表示)。
-
16、
某实验小组制取“84”消毒液(主要成分为NaClO)并探究其性质。
I.制取NaClO的装置如下图所示(夹持装置略):

(1)装置A制取氯气的反应原理为:16HCl(浓)+2KMnO4=2MnCl2+8H2O+2KCl+5Cl2↑,在该反应中,氧化剂与还原剂的物质的量之比为。该反应中盐酸表现的性质。
(2)上述装置存在一个缺陷,会导致“84”消毒液的产率降低,改进的方法是。
(3)装置B中得到“84”消毒液的化学方程式为。装置B中生成物的物质的量和溶液的温度随时间的变化如下图所示,经分析发现实验过程中装置B中温度上升过快会导致产物中存在杂质,为避免此状况的发生,应进行的操作为。

II.探究“84”消毒液的性质:
为探究“84”消毒液(含NaClO和NaCl)的性质,设计的实验与观察到的现象如下表所示。
实验



现象
混合后溶液呈蓝色,一段时间后蓝色褪去
混合后溶液呈紫色,紫色迅速褪去,无气体产生
混合后溶液呈红色,红色迅速褪去,并产生大量气体,该气体能使湿润的淀粉碘化钾试纸变蓝
(4)84消毒液的有效成分是次氯酸钠,由实验①可知:次氯酸钠溶液呈。
A.酸性 B.中性 C.碱性
(5)对比实验①和②可知:在酸性条件下,NaClO的氧化性(填“增强”或“减弱”)。
(6)由实验③可知:产生的气体是Cl2 , 用离子方程式解释产生Cl2的原因。
-
17、某同学进行实验时需要100 mL 0.10 mol·L-1 Na2CO3溶液,但实验室只有Na2CO3•10H2O晶体和2.5mol·L-1Na2CO3溶液。该同学利用所给试剂配制所需溶液。完成下列填空:(1)、无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、量筒、玻璃棒外,至少还需要的两种玻璃仪器是、。(2)、若用Na2CO3•10H2O晶体配制100 mL所需溶液,需用电子天平称取晶体的质量为g(保留两位小数);若用2.5mol·L-1Na2CO3溶液配制100 mL所需溶液,需要用量筒量取mL溶液(保留一位小数)。(3)、下图是用Na2CO3•10H2O晶体配制溶液的部分过程如图所示,操作正确的是。
 (4)、在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。A、容量瓶内壁附有水珠而未干燥处理 B、转移时,未洗涤烧杯内壁和玻璃棒 C、定容时加水超过刻度线 D、定容时俯视刻度线
(4)、在配制过程中,下列操作会使溶液浓度偏小的是_______(填字母)。A、容量瓶内壁附有水珠而未干燥处理 B、转移时,未洗涤烧杯内壁和玻璃棒 C、定容时加水超过刻度线 D、定容时俯视刻度线 -
18、Na2CO3和NaHCO3是重要的化工原料。(1)、写出NaHCO3在溶液中的电离方程式。(2)、Na2CO3在物质分类中属于_______(填字母)。A、钠盐 B、氧化物 C、碳酸盐 D、含氧酸(3)、可用下图来比较NaHCO3、Na2CO3的稳定性,Na2CO3应放在处(填“A”或“B”),写出受热处发生反应的化学方程式为。
 (4)、某化学兴趣小组模拟“侯氏制碱法”制纯碱。
(4)、某化学兴趣小组模拟“侯氏制碱法”制纯碱。
①写出装置I中反应的离子方程式。
②为除去CO2中的HCl,装置Ⅱ中的试剂为。
③装置Ⅲ中析出的晶体是 (填化学式)。
-
19、水体中氨氮含量超标会造成水体富营养化,用次氯酸钙除去氨氮的原理如图所示。下列说法错误的是
 A、反应①为非氧化还原反应 B、反应②的离子方程式为: C、反应②每生成1molN2 , 转移6mol电子 D、CO2在该反应中能够循环利用
A、反应①为非氧化还原反应 B、反应②的离子方程式为: C、反应②每生成1molN2 , 转移6mol电子 D、CO2在该反应中能够循环利用 -
20、下列化学实验事实的结论不正确的是
选项
实验事实
结论
A
将CO2通入含Ca(ClO)2的溶液中生成HClO
H2CO3的酸性比HClO强
B
用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色
该溶液一定含钠元素
C
向某溶液中加入硝酸银溶液,有白色沉淀生成
溶液中一定含Cl-
D
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性比Cu2+的氧化性弱
A、A B、B C、C D、D