相关试卷
-
1、常温下,下列溶液中各粒子的物质的量浓度关系正确的是A、溶液中: B、将等物质的量浓度的和溶液混合: C、等物质的量浓度的溶液与溶液等体积混合溶液显碱性,则溶液中: D、将和的稀溶液混合恰好至溶液中
-
2、根据下列图示所得出的结论不正确的是
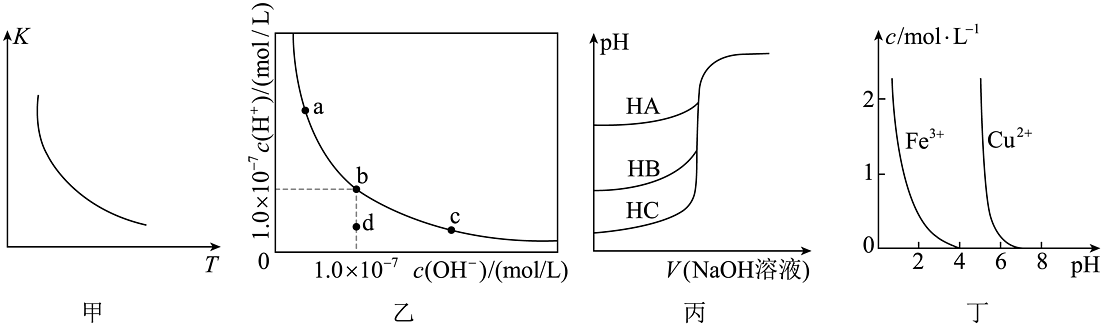 A、图甲是一定条件下的平衡常数K随温度变化的曲线,可推知该反应的 B、图乙是一定温度下水溶液中、的变化曲线。该温度下,加水稀释NaOH溶液可能引起沿曲线由c向b的变化 C、图丙是室温下用0.01mol/L NaOH溶液分别滴定同浓度同体积的HA、HB、HC三种酸的滴定曲线,可推知HA的酸性最强 D、图丁是在溶液中、的浓度与pH的关系曲线。可推知用氢氧化物沉淀除去溶液混有的 , 所调pH的范围大致应为4~5
A、图甲是一定条件下的平衡常数K随温度变化的曲线,可推知该反应的 B、图乙是一定温度下水溶液中、的变化曲线。该温度下,加水稀释NaOH溶液可能引起沿曲线由c向b的变化 C、图丙是室温下用0.01mol/L NaOH溶液分别滴定同浓度同体积的HA、HB、HC三种酸的滴定曲线,可推知HA的酸性最强 D、图丁是在溶液中、的浓度与pH的关系曲线。可推知用氢氧化物沉淀除去溶液混有的 , 所调pH的范围大致应为4~5 -
3、下列说法正确的是A、常温下,向稀醋酸溶液中缓慢通入NH3 , 溶液中的值增大 B、298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0 C、标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023 D、用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
-
4、在给定条件下,下列选项所示的物质间转化均能实现的是( )A、Ca(OH)2Ca(ClO)2(aq)HClO(aq) B、Fe(s)Fe2O3(s)FeCl3(aq) C、S(s)SO2(g)BaSO3(s) D、NH3(g)NO(g)HNO3(aq)
-
5、阅读下列材料,完成有关问题:
族元素及其化合物应用广泛。催化氧化生成继续被氧化为 , 将通入水中可制得;肼常温下为液态,燃烧热为(642kJ•mol-1),产物无污染,常用作火箭燃料:白磷为正四面体结构,常用来制烟雾弹、燃烧弹;雄黄具有解毒、杀虫功效,燃烧后生成砒霜和一种具有刺激性气味的气体;锑是一种银白色金属,其氧化物可用于制造颜料,铅锑合金可用作铅蓄电池的电极材料。
(1)、下列说法正确的是A、分子中既有极性键,又有非极性键 B、相同条件下,在水中的溶解度小于 C、白磷和红磷互为同位素 D、非金属性强于P(2)、下列化学反应表示正确的是A、雄黄燃烧: B、制的离子方程式: C、肼的燃烧: D、铅蓄电池放电时的负极反应:(3)、下列有关物质的性质与用途具有对应关系的是A、氨气易液化,可用于工业制硝酸 B、肼具有碱性,可用作火箭燃料 C、三氧化二锑呈白色,可用于制造颜料 D、铅锑合金熔点低,可用作铅蓄电池电极材料 -
6、同一周期的X、Y、Z三种主族元素,已知其最高价氧化物对应水化物的化学式分别为、、 , 下列说法正确的是A、气态氢化物的稳定性: B、原子半径:X>Y>Z C、最高价氧化物对应水化物酸性: D、元素非金属性强弱关系:X>Y>Z
-
7、侯德榜是我国近代化学工业的奠基人之一,他将氨碱法和合成氨工艺联合起来,发明了“联合制碱法”。氨碱法中涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
下列制取少量相关的实验原理和装置能达到实验目的的是
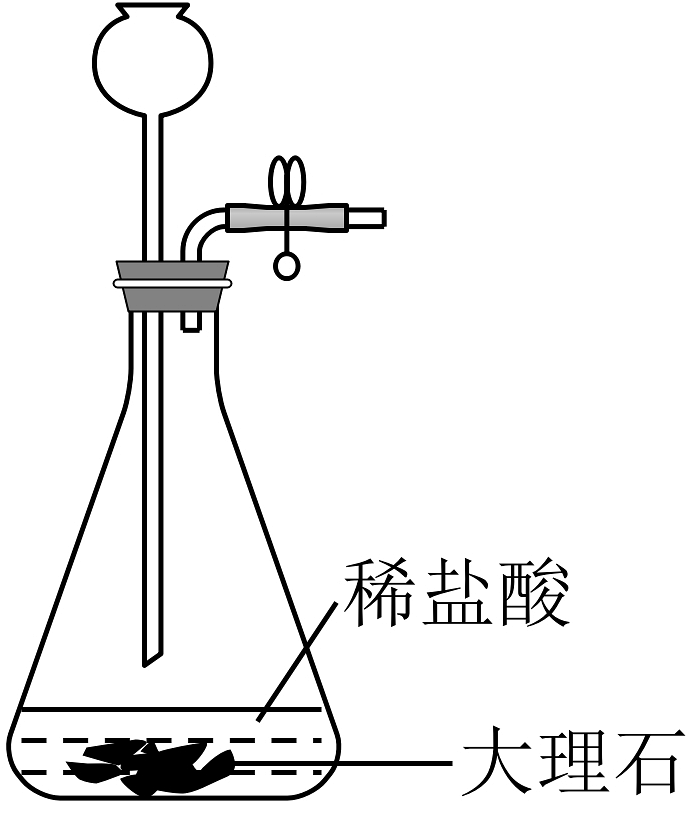
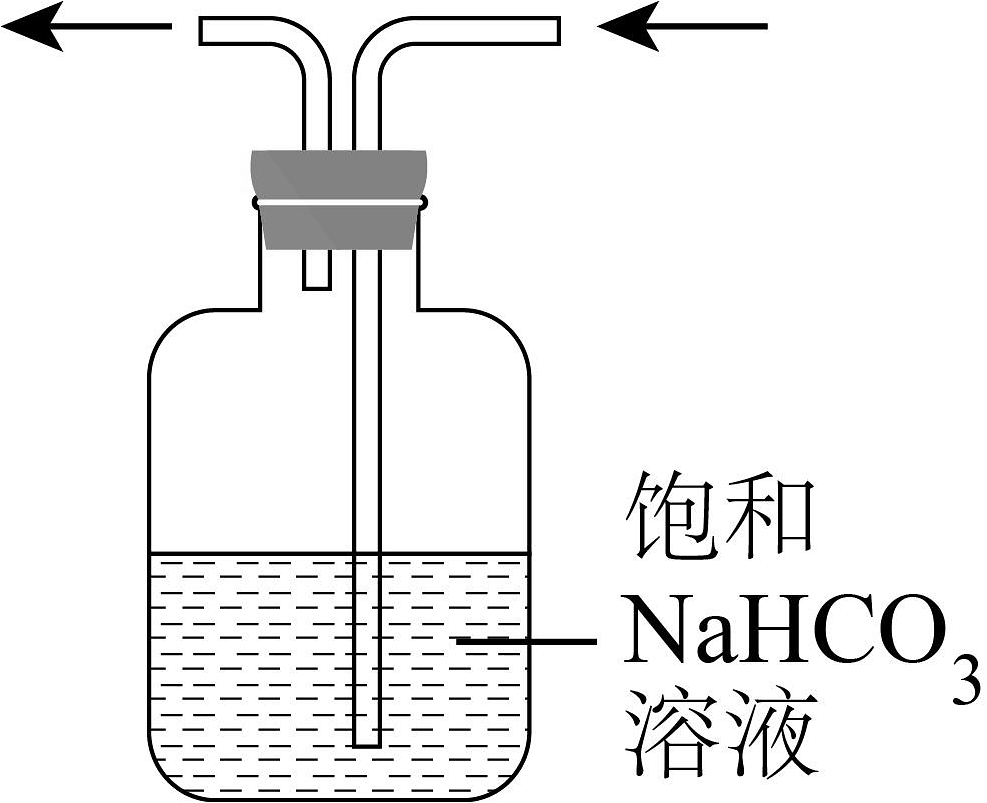
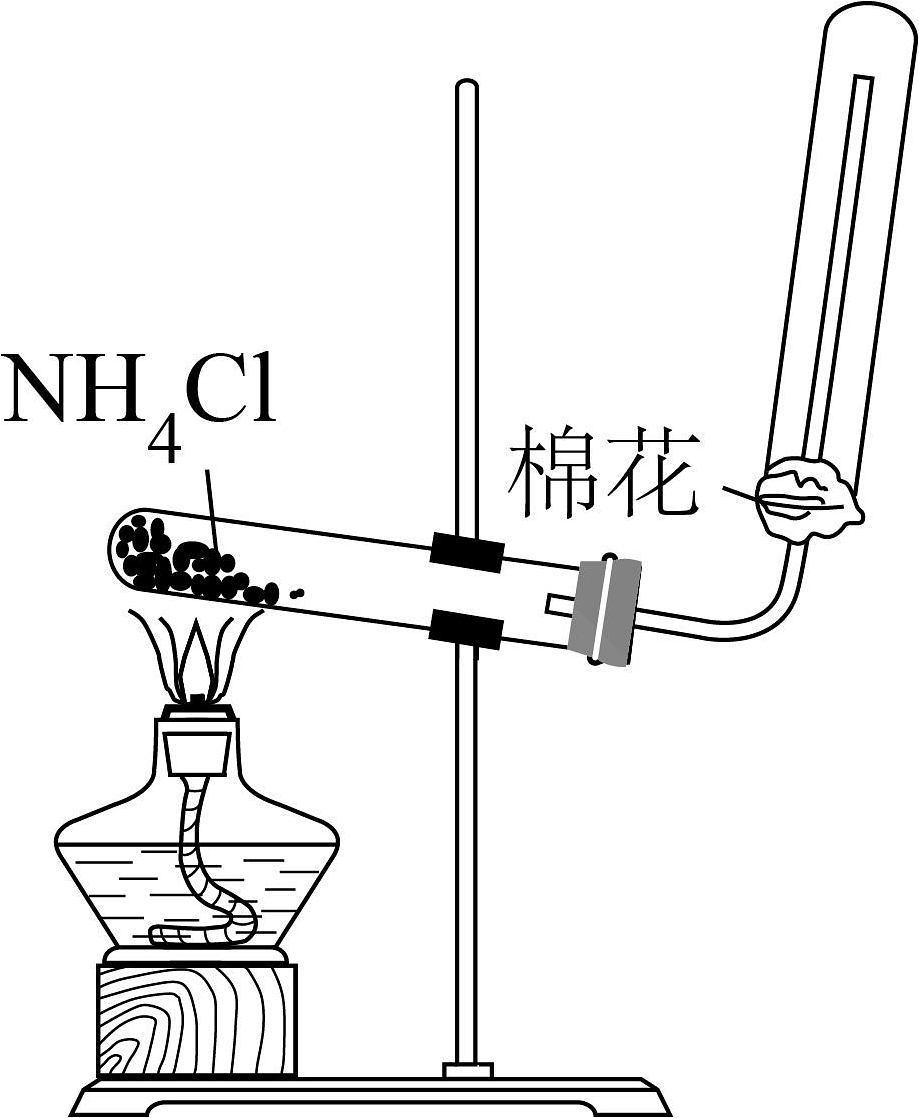
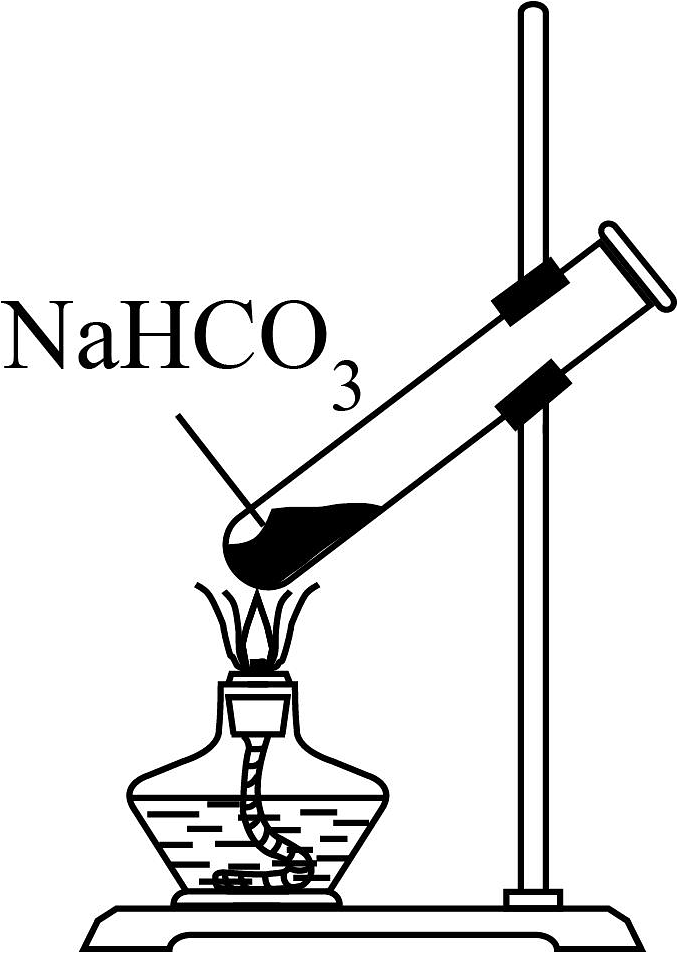
A.制取
B.除去中HCl
C.制取并收集氨气
D.制取
A、A B、B C、C D、D -
8、草酸易被NaClO氧化: , 下列说法不正确的是A、CO2分子中有极性共价键 B、NaClO属于离子化合物 C、H2O的电子式为
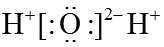 D、Cl的结构示意图为
D、Cl的结构示意图为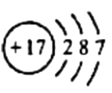
-
9、水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置(夹持装置略),采用碘量法测定学校周边河水中的溶解氧的含量。

实验步骤及测定原理如下:
I.取样、氧的固定
a.用溶解氧瓶采集水样,记录大气压及水体温度。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL无氧溶液(过量)和2mL碱性KI无氧溶液(过量)开启搅拌器,反应生成 , 实现氧的固定。
II.酸化、滴定
d.搅拌,并向烧瓶中加入2mL硫酸无氧溶液至被还原为 , 溶液为中性或弱酸性。
e.在暗处静置5min后,取一定量溶液,用标准溶液滴定生成的 , 记录数据。
f.重复e中滴定操作2~3次。
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)、配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为。(2)、取水样时应尽量避免扰动水体表面,这样操作的主要目的是。(3)、“氧的固定”中发生主要反应的化学方程式为。(4)、“步骤e”中,用a标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为;若200mL水样经处理后,共消耗标准溶液的体积为b mL,则水样中溶解氧的含量为(用含字母的式子表示)。 -
10、实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
 (1)、为提高溶解速率,还可以采取的措施有(写一种)。(2)、加入H2O2的目的是。(3)、加入锌粉发生主要反应的离子方程式为。
(1)、为提高溶解速率,还可以采取的措施有(写一种)。(2)、加入H2O2的目的是。(3)、加入锌粉发生主要反应的离子方程式为。 -
11、侯氏制碱法的基本过程如下图所示。下列说法错误的是
 A、食盐水精制时一般加入BaCl2后,再加入Na2CO3 B、为提高原料利用率,先通入CO2再通入NH3 C、若沉淀结块,煅烧前需将沉淀研磨成粉末状 D、生产中将X和母液循环利用,可以提高原料利用率和产率
A、食盐水精制时一般加入BaCl2后,再加入Na2CO3 B、为提高原料利用率,先通入CO2再通入NH3 C、若沉淀结块,煅烧前需将沉淀研磨成粉末状 D、生产中将X和母液循环利用,可以提高原料利用率和产率 -
12、下列关于的说法中不正确的是A、有刺激性气味,有毒 B、既有氧化性又有还原性 C、能使酸性高锰酸钾溶液褪色,体现漂白性 D、可按照食品添加剂使用标准用作食品的添加剂
-
13、请阅读下列材料,2019年是门捷列夫发现周期律150周年,联合国大会指定这一年为“化学元素周期表国际年”,在纪念门捷列夫先生的同时,以表彰其元素周期表对人类进步的推动作用。回答下列问题。(1)、可用核素测定文物的年代,该核素的中子数为A、6 B、14 C、8 D、20(2)、Mg和Si都属于元素周期表第三周期元素,它们原子结构中相同的是A、质子数 B、核外电子数 C、电子层数 D、最外层电子数(3)、判断Na的金属性比Mg的强,可依据的事实是A、钠与水反应比镁反应更剧烈 B、钠的密度小于镁的密度 C、相同物质的量钠失电子比镁少 D、Mg(OH)2的碱性比NaOH的碱性强(4)、氟是第二周期ⅦA族元素,下列有关氟元素性质推测正确的是A、最高化合价为+7 B、原子半径比氯的大 C、单质与氢气的反应比氯气更剧烈 D、HCl的稳定性比HF强
-
14、如图为某原电池装置,下列关于该装置的说法正确的是
 A、碳棒是正极 B、该装置能将电能转化为化学能 C、外电路中电子由碳棒流向铁片 D、该装置的总反应为2Fe+3Cu2+=2Fe3++3Cu
A、碳棒是正极 B、该装置能将电能转化为化学能 C、外电路中电子由碳棒流向铁片 D、该装置的总反应为2Fe+3Cu2+=2Fe3++3Cu -
15、下列反应条件的改变对3CO+Fe2O33CO2+2Fe反应速率的影响正确的是A、增加Fe2O3的物质的量能加快反应速率 B、减小CO2的浓度能加快反应速率 C、升高温度能加快反应速率 D、添加催化剂对反应速率无影响
-
16、下列反应过程中的能量变化情况符合下图的是
 A、NaOH与H2SO4发生中和反应 B、氧化钙和水反应 C、红热的炭和水蒸气反应 D、一氧化碳气体的燃烧
A、NaOH与H2SO4发生中和反应 B、氧化钙和水反应 C、红热的炭和水蒸气反应 D、一氧化碳气体的燃烧 -
17、下列属于取代反应的是A、C2H4+3O22CO2+2H2O B、CH2=CH2+HBr→ CH3CH2Br C、CH4+Cl2CH3Cl+HCl D、2CH3CH2OH+O22CH3CHO+2H2O
-
18、下列说法正确的是A、甲烷与乙烯互为同系物 B、32S与33S是同种核素 C、正丁烷与异丁烷互为同素异形体 D、乙醇和二甲醚(CH3-O-CH3)互为同分异构体
-
19、下列反应的离子方程式书写正确的是A、BaCl2溶液和Na2SO4溶液反应:Ba2+ +SO42- = BaSO4↓ B、Na与水反应:Na + H2O = Na+ + OH- + H2↑ C、CaCO3与盐酸反应:CO32- + 2H+ = H2O + CO2↑ D、Al与稀硫酸反应:Al + 2H+ = Al3++ H2↑
-
20、下列装置能达到实验目的的是




A.收集氨气
B.测氯水的pH
C.除Cl2中的HCl
D.蒸发NaCl溶液
A、A B、B C、C D、D