相关试卷
-
1、CH4与CO2混合气体在催化剂表面会发生积碳反应和消碳反应。反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。在其余条件不变的情况下,该催化剂表面积碳量随温度升高呈现先增大后减小的变化。
积碳反应
消碳反应
活化能
催化剂M
催化剂N
下列关于升温过程中积碳、消碳反应的平衡常数(K),反应速率(v)以及催化剂的说法正确的是
A、K积增加、K消减小 B、v消增加倍数比v积增加倍数大 C、K积减小倍数比K消减小倍数大 D、催化剂M优于催化剂N -
2、是一元酸,可由制得,燃烧放出大量热量,其燃烧热为;铋()熔点为271.3℃,铋酸钠()不溶于水,有强氧化性,能与反应生成和。下列方程式书写正确的是A、过量的铁粉溶于稀硝酸: B、与足量溶液反应: C、的燃烧: D、铋酸钠氧化的反应:
-
3、利用如图装置,完成了很多电化学实验。有关此装置的叙述中,不正确的是
 A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极保护法 B、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将不变 C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子会向铜电极移动 D、若X为碳棒,Y为NaCl溶液,开关K置于M处,可观察到X极处冒气泡
A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极保护法 B、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将不变 C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子会向铜电极移动 D、若X为碳棒,Y为NaCl溶液,开关K置于M处,可观察到X极处冒气泡 -
4、下列各装置能达到相应实验目的的是
 A、图甲,中和热的测定 B、图乙,该装置可持续供电 C、图丙,在铁制品表面镀锌 D、图丁,测定稀硫酸的pH
A、图甲,中和热的测定 B、图乙,该装置可持续供电 C、图丙,在铁制品表面镀锌 D、图丁,测定稀硫酸的pH -
5、在含、和的溶液中,发生反应: , 其分解机理及反应进程中的能量变化如下:
步骤①:
步骤②:
下列有关该反应的说法正确的是
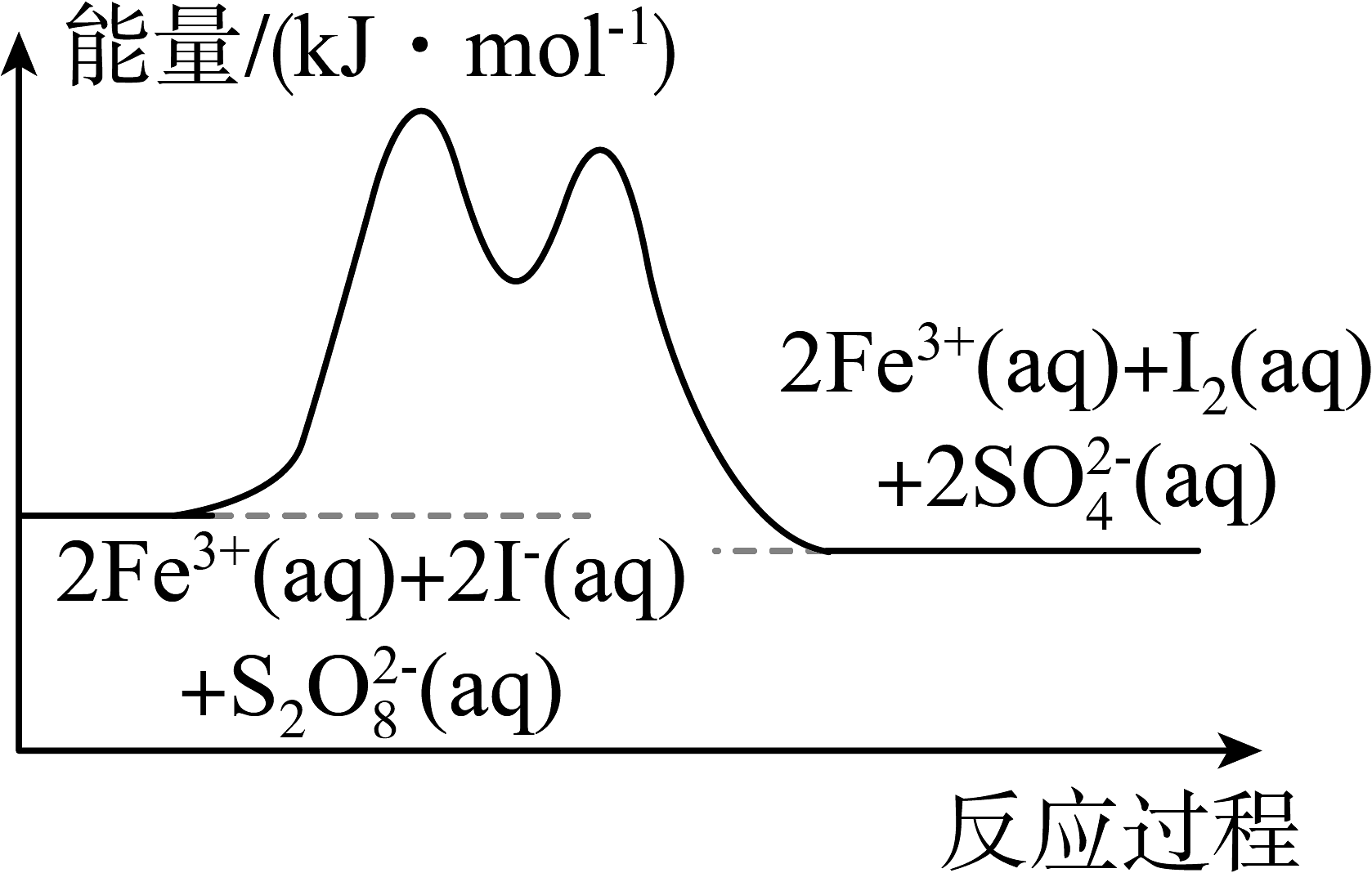 A、加入可以使反应物分子中活化分子百分数增大 B、该反应的催化剂是 C、步骤②是整个反应的决速步骤 D、若不加 , 则正反应的活化能比逆反应的大
A、加入可以使反应物分子中活化分子百分数增大 B、该反应的催化剂是 C、步骤②是整个反应的决速步骤 D、若不加 , 则正反应的活化能比逆反应的大 -
6、下列化学用语或表述正确的是A、的空间结构:V形 B、KI的电子式:
 C、基态Ni原子价电子轨道表示式:
D、的名称:3-甲基戊烷
C、基态Ni原子价电子轨道表示式:
D、的名称:3-甲基戊烷
-
7、硫代硫酸钠 (Na2S2O3)是分析化学中常用的试剂,在酸性溶液中易发生如下化学反应。设为阿伏加德罗常数,下列说法正确的是A、的固体中含有的离子 B、常温常压下,中含有键的个数为 C、中含有的质子数为 D、生成的转移电子的个数为
-
8、华南师范大学兰亚乾教授课题组从催化剂结构与性能间关系的角度,设计了一种催化剂同时作用在阳极和阴极,用于CH3OH氧化和CO2还原反应耦合的混合电解,工作原理如图甲所示。不同催化剂条件下CO2→CO电极反应历程如图乙所示。下列说法不正确的是

 A、电解总反应为2CO2+CH3OH2CO+HCOOH+H2O B、理论上若有44gCO2被转化,则有2molH+从左侧向右侧迁移 C、与Ni8-TET催化剂相比,使用Ni-TPP时催化效果更好 D、若以铅蓄电池为电源,则B极应与PbO2极相连接
A、电解总反应为2CO2+CH3OH2CO+HCOOH+H2O B、理论上若有44gCO2被转化,则有2molH+从左侧向右侧迁移 C、与Ni8-TET催化剂相比,使用Ni-TPP时催化效果更好 D、若以铅蓄电池为电源,则B极应与PbO2极相连接 -
9、CO2资源化利用具有重要意义。(1)、CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
I.CH4(g) + CO2(g)=2CO(g) + 2H2(g)
II.CH4(g) + 3CO2(g)=4CO(g) + 2H2O (g)
反应CO2(g) + H2(g)=CO(g) + H2O (g) 。
(2)、燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
①吸收剂X的结构简式是。
②X具有很好的水溶性的原因是。
(3)、CO2与环氧化合物反应可以转化为有价值的有机物。转化过程如图所示。Y为五元环状化合物,Y的结构简式为;N原子上的孤电子对主要进攻甲基环氧乙烷中“CH2”上的碳原子,而不是“CH”上的碳原子,原因是。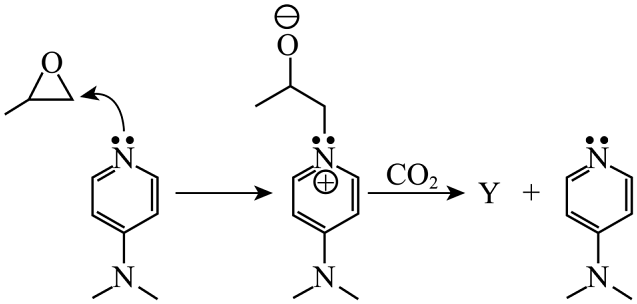 (4)、利用电化学可以将CO2转化为有机物
(4)、利用电化学可以将CO2转化为有机物多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。阴极生成C2H4的电极反应式为。
 (5)、装置工作时,阴极主要生成C2H4 , 还可能生成副产物降低电解效率。标准状况下,当阳极生成O2的体积为224mL时,测得阴极区生成C2H456mL,则电解效率为。(忽略电解前后溶液体积的变化)已知:电解效率
(5)、装置工作时,阴极主要生成C2H4 , 还可能生成副产物降低电解效率。标准状况下,当阳极生成O2的体积为224mL时,测得阴极区生成C2H456mL,则电解效率为。(忽略电解前后溶液体积的变化)已知:电解效率 -
10、废旧锂电池正极材料(含LiCoO2及少量Al、Fe等)为原料制备CoSO4溶液,再以CoSO4溶液、NaOH溶液、氨水和水合肼为原料制得微米级Co(OH)2。
已知:
① Co2+、Co3+易与NH3形成配合物;
② 水合肼(N2H4·H2O)为无色油状液体,具有强还原性,氧化产物为N2;
③ 沉淀的生成速率越快,颗粒越小,呈凝乳状胶体,不易过滤。
(1)、写出钴基态原子的价层电子排布式。(2)、制备CoSO4溶液。
取一定量废旧锂电池正极材料,粉碎后与Na2SO3溶液混合配成悬浊液,边搅拌边加入1 mol/LH2SO4溶液充分反应。LiCoO2转化为CoSO4、Li2SO4的化学方程式为。从分液漏斗中滴入1 mol/LH2SO4时,滴加速率不能太快且需要快速搅拌的原因是。
(3)、制备微米级Co(OH)260℃时在搅拌下向500mL 1mol/LCoSO4溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级Co(OH)2。制备时,在加入NaOH溶液前必须先加氨水的原因是。
(4)、经仪器分析,测得按题(3)步骤制得的Co(OH)2晶体结构中含有Co(Ⅲ),进一步用碘量法测得Co(Ⅱ)的氧化程度为8%。因此制备时必须加入一定量的还原剂。为确保制得的Co(OH)2产品中不含Co(Ⅲ),制备时至少需加入水合肼的质量为g。(写出计算过程)(5)、利用含钴废料(主要成分为Co3O4 , 还含有少量的石墨、LiCoO2等杂质)制备碳酸钴CoCO3。已知:①CoCO3几乎不溶于水,Li2CO3微溶于水;
②钴、锂在有机磷萃取剂(HR)中的萃取率与pH的关系如图所示;

③酸性条件下的氧化性强弱顺序为:Co3+>H2O2。
请补充完整实验方案:取一定量含钴废料,粉碎后 , 充分反应后,静置后过滤,洗涤、干燥得到CoCO3。【实验中必须使用的试剂:2 mol/L H2SO4溶液、2 mol/LNaOH溶液、有机磷(HR)、0.5 mol/LNa2CO3溶液、30%H2O2溶液。】
-
11、F是一种有机工业制备的重要中间体,其一种合成工艺流程如下图:
 (1)、E中含氧官能团的名称为。(2)、A→B时发生取代反应,所得产物为化合物B和CH3OH。则X的结构简式为。(3)、Y的结构简式为。(4)、E→F的反应实际上经历了两步反应,两步反应类型依次是、。(5)、写出一种符合下列条件的化合物C的同分异构体。
(1)、E中含氧官能团的名称为。(2)、A→B时发生取代反应,所得产物为化合物B和CH3OH。则X的结构简式为。(3)、Y的结构简式为。(4)、E→F的反应实际上经历了两步反应,两步反应类型依次是、。(5)、写出一种符合下列条件的化合物C的同分异构体。①结构中含有苯环,无其他环状结构;苯环上的一元取代物只有一种;
②红外光谱显示结构中含“-C≡N”和“C=S”结构;
③核磁共振氢谱显示结构中有3种化学环境的氢原子,个数比为1:6:6。
(6)、设计以化合物CH2=CH2、n-BuLi、 、
、 为原料,合成化合物
为原料,合成化合物
的路线图(无机试剂及有机溶剂任用)。
-
12、以废干电池[主要含MnO2、MnOOH、Zn、Zn(OH)2、Fe、KOH]和钛白厂废酸(主要含H2SO4 , 还有少量Ti3+、Fe2+、Ca2+、Mg2+等)为原料,制备锰锌铁氧体[MnxZn1-xFe2O4]的流程如下:

已知: ① 25℃时,Ksp(MgF2)=7.5×10-11 , Ksp(CaF2)=1.5×10-10;酸性较弱时,MgF2、CaF2均易形成[MFn]2-n配离子(M代表金属元素);
② (NH4)2S2O8在煮沸时易分解
(1)、酸浸过程中含锰物质被溶液中的FeSO4还原为Mn2+ , 其中MnO2参与反应的离子方程式为。(2)、氧化时加入H2O2将Ti3+、Fe2+氧化,再加入Na2CO3调节溶液pH为1~2,生成偏钛酸(H2TiO3)和黄钾铁矾[K2Fe6(SO4)4(OH)12]沉淀,使得钛、钾得以脱除。① 加入Na2CO3生成黄钾铁矾的离子方程式为。
② 若加入Na2CO3过多,将导致产品的产率下降,其原因是。
(3)、①氟化过程中溶液pH与钙镁去除率关系如图1所示。当2.5 < pH < 4.0时,溶液pH过高或过低,Ca2+、Mg2+去除率都会下降,其原因是。
②氟化后,溶液中为。
③CaF2晶胞结构如图2所示,其中Ca2+的配位数为。
 (4)、共沉淀前,需测定溶液中锰元素含量。先准确量取1.00 mL氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银(Ag+是催化剂)溶液振荡;将溶液加热至80℃,加入3 g (NH4)2S2O8充分反应后,再将溶液煮沸,冷却后,再用0.0700 mol/L的(NH4)2Fe(SO4)2标准液滴定至溶液由浅红色变为无色。请写出Mn2+与S2反应的离子方程式。
(4)、共沉淀前,需测定溶液中锰元素含量。先准确量取1.00 mL氟化后溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银(Ag+是催化剂)溶液振荡;将溶液加热至80℃,加入3 g (NH4)2S2O8充分反应后,再将溶液煮沸,冷却后,再用0.0700 mol/L的(NH4)2Fe(SO4)2标准液滴定至溶液由浅红色变为无色。请写出Mn2+与S2反应的离子方程式。 -
13、CO2催化加氢是转化CO2的一种方法,其过程中主要发生下列反应:
反应Ⅰ:
反应Ⅱ:
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CO的选择性随温度的变化如图。其中:。

下列说法正确的是
A、 B、△H1<0 C、温度高于300℃时主要发生反应Ⅱ D、其他条件不变,图中A点选择合适催化剂可提高CO的选择性 -
14、硫酸工业尾气(主要含SO2、N2和O2),用Na2SO3溶液吸收尾气中的SO2可将其转化为NaHSO3 , 当c(HSO):c(SO)≈10时,吸收能力下降,需要加热再生为Na2SO3溶液。已知Ka1(H2SO3)= , Ka2(H2SO3)= , 下列说法不正确的是A、NaHSO3溶液中存在:2c(SO) + c(HSO)> c(Na+) B、Na2SO3溶液吸收SO2的离子方程式为:SO+SO2+H2O=2HS C、当c(HSO):c(SO)=10时,此时吸收液的pH=6.2 D、与原Na2SO3溶液相比,吸收液充分分解放出SO2再生后吸收SO2能力几乎不变
-
15、下列实验方案能达到探究目的的是
选项
探究目的
实验方案
A
Al与结合H+ 能力大小
分别测量浓度均为0.1mol·L-1Na2CO3溶液和Na[Al(OH)4]溶液的pH,比较pH的大小
B
H2S与H2SO4的酸性强弱
向CuSO4溶液中通入H2S气体,观察现象
C
检验Fe2+对H2O2分解是否有催化作用
向H2O2溶液中滴入FeCl2溶液,观察产生气泡的速率
D
检验Fe3O4中含有Fe(II)
将Fe3O4溶于盐酸所得溶液浓缩后,滴入酸性KMnO4溶液,观察溶液颜色的变化
A、A B、B C、C D、D -
16、实验室以含锌废液(主要成分为ZnSO4 , 还含有少量的Fe2+、Mn2+ , 溶液pH≈5)为原料制备ZnCO3的实验流程如图甲所示,具有强氧化性,易被还原为 , 的结构如图乙所示。下列说法正确的是
 A、“除锰”反应的离子方程式为+Mn2++2H2O=2+MnO2↓+4H+ B、“除锰”反应中每消耗1 mol , 硫元素共得到2 mol电子 C、试剂X可以选用Zn、ZnO等物质 D、滤液中一定大量存在的阳离子有Na+、NH和Zn2+
A、“除锰”反应的离子方程式为+Mn2++2H2O=2+MnO2↓+4H+ B、“除锰”反应中每消耗1 mol , 硫元素共得到2 mol电子 C、试剂X可以选用Zn、ZnO等物质 D、滤液中一定大量存在的阳离子有Na+、NH和Zn2+ -
17、化合物Z是一种有机合成中的重要中间体,其部分合成路线如下:

下列说法正确的是
A、Y与Z分子均存在顺反异构体 B、用酸性高锰酸钾溶液鉴别X和Y C、用FeCl3溶液可以鉴别X、Y D、Y与足量H2加成后的产物中含有手性碳原子 -
18、在给定条件下,下列选项中所示的物质间转化均能实现的是A、由FeS2制备BaSO3: B、由MgO制备MgCl2: C、由CuSO4生成Cu2O:CuSO4溶液 D、SiO2制Na2SiO3:
-
19、阅读下列材料,完成下列小题
氮的常见氢化物有氨(NH3)和肼(N2H4)。Mg3N2可与水反应生成NH3.液氨可发生微弱电离产生 , 液氨能与碱金属(如Na、K)反应产生H2.NH3中一个H被—NH2取代可得N2H4 , 常温下N2H4为液体,具有很高的燃烧热(622kJ·mol-1)。以硫酸为电解质,通过催化电解可将N2转化为N2H4;碱性条件下,NaClO氧化NH3也可制备N2H4。
(1)、下列说法正确的是A、NH3和N2H4分子中N原子杂化轨道类型不同 B、液氨电离可表示为:2NH3⇌ C、N2H4的结构式为 D、Mg3N2中存在N≡N键
(2)、下列化学反应表示正确的是A、肼在氧气中燃烧:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-622.1kJ·mol-1 B、液氨与钠反应:2Na+2NH3=2NaNH2+H2↑ C、NaClO氧化NH3制备N2H4;4NH3+ClO-+2OH-=2N2H4+Cl-+3H2O D、电解法制备N2H4的阴极反应:N2+4H+-4e-=N2H4(3)、下列物质结构与性质或物质性质与用途不具有对应关系的是A、NH3分子间存在氢键,NH3极易溶于水 B、液氨汽化时吸收大量的热,可用作制冷剂 C、N2H4中N原子能与形成配位键,N2H4的水溶液呈碱性 D、N2H4具有还原性,可用作燃料电池的燃料
D、Mg3N2中存在N≡N键
(2)、下列化学反应表示正确的是A、肼在氧气中燃烧:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-622.1kJ·mol-1 B、液氨与钠反应:2Na+2NH3=2NaNH2+H2↑ C、NaClO氧化NH3制备N2H4;4NH3+ClO-+2OH-=2N2H4+Cl-+3H2O D、电解法制备N2H4的阴极反应:N2+4H+-4e-=N2H4(3)、下列物质结构与性质或物质性质与用途不具有对应关系的是A、NH3分子间存在氢键,NH3极易溶于水 B、液氨汽化时吸收大量的热,可用作制冷剂 C、N2H4中N原子能与形成配位键,N2H4的水溶液呈碱性 D、N2H4具有还原性,可用作燃料电池的燃料 -
20、臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为S和N。下列关于N、O、S、Fe元素及其化合物的说法正确的是A、原子半径:S>O>N B、1mol[Fe(H2O)6]2+含有键数目为12mol C、键角:H2O>NH3 D、第一电离能: I1(N)>I1(O)>I1(S)