相关试卷
-
1、用肼(N2H4)的水溶液处理核冷却系统内壁上的铁氧化物时,通常加入少量CuSO4 , 反应原理如图所示。下列说法正确的是( )
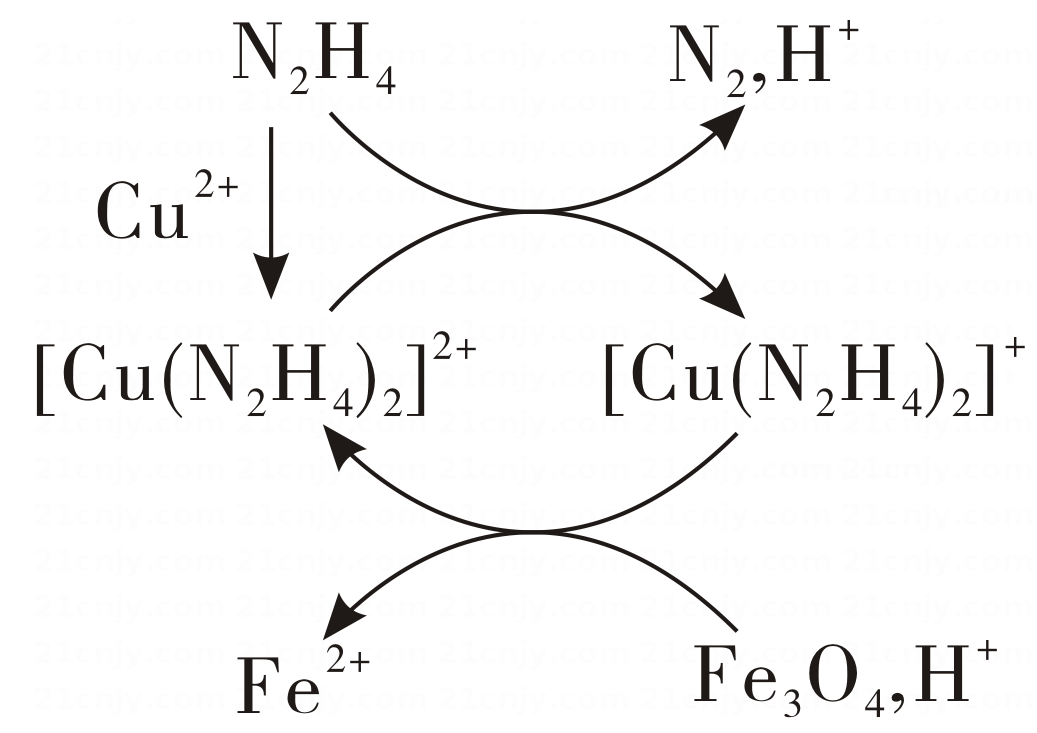 A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+
A、N2是还原反应的产物 B、还原性:N2H4<Fe2+ C、处理后溶液的pH增大 D、图示反应过程中起催化作用的是Cu2+ -
2、物质性质与组成元素的性质有关,下列对物质性质差异解释错误的是( )
性质差异
主要原因
A
沸点:H2O>H2S
电离能:O>S
B
酸性:HClO>HBrO
电负性:Cl>Br
C
硬度:金刚石>晶体硅
原子半径:Si>C
D
熔点:MgO>NaF
离子电荷: Mg2+ >Na+ , O2- >F-
A、A B、B C、C D、D -
3、用硫酸和NaN3可制备一元弱酸HN3。下列说法错误的是( )A、NaN3的水溶液显碱性 B、N3-的空间构型为V形 C、NaN3为含有共价键的离子化合物 D、N3-的中心N原子所有价电子均参与成键
-
4、 第70号元素镱(Yb)的基态原子价电子排布式为4f146s2。下列说法正确的是( )A、Yb的中子数与质子数之差为 104 B、Yb与°Yb是同一种核素 C、基态Yb原子核外共有10个d电子 D、Yb位于元素周期表中第6周期
-
5、下列实验涉及反应的离子方程式书写正确的是( )A、用NaOH 溶液吸收少量SO2:SO2+ OH" = HSO3- B、用Na2O2和水制备少量O2: Na2O2+H2O =2Na++2O2↑ C、用MnO2和浓盐酸制备Cl2: D、用稀硝酸溶解少量Cu粉:3Cu+8H++8NO3-= 3Cu(NO3)2+2NO↑+4H2O
-
6、 称取1.6g 固体 NaOH 配制400mL浓度约为0.1mol·L-1的NaOH 溶液,下列仪器中不需要使用的是( )A、100mL烧杯 B、500mL容量瓶 C、500mL量筒 D、500mL细口试剂瓶(具橡胶塞)
-
7、实验室中,下列试剂保存方法正确的是( )A、液溴加水封保存在广口试剂瓶中 B、硝酸银溶液保存在棕色细口试剂瓶中 C、高锰酸钾与苯酚存放在同一药品柜中 D、金属锂保存在盛有煤油的广口试剂瓶中
-
8、化学应用体现在生活的方方面面,下列用法不合理的是( )A、用明矾净化黄河水 B、用漂白粉漂白蚕丝制品 C、用食醋去除水壶中水垢 D、用小苏打作烘焙糕点膨松剂
-
9、下列在化学史上产生重要影响的成果中,不涉及氧化还原反应的是( )A、侯德榜发明了以NH3CO2和NaCl为原料的联合制碱法 B、戴维电解盐酸得到H2和CI2 , 从而提出了酸的含氢学说 C、拉瓦锡基于金属和O2的反应提出了燃烧的氧化学说 D、哈伯发明了以N2和H2为原料合成氨的方法
-
10、 化合物I具有杀虫和杀真菌活性,以下为其合成路线之一(部分反应条件已简化)。

回答下列问题:
(1)、I中含氧官能团的名称是。(2)、A的结构简式为。(3)、由B生成C的化学方程式为。反应时,在加热搅拌下向液体B中滴加异丙醇;若改为向异丙醇中滴加B则会导致更多副产物的生成,副产物可能的结构简式为(写出一种即可)。(4)、由D生成E的反应类型为。(5)、由F生成H的反应中可能生成中间体J,已知J的分子式为 , 则J的结构简式为(写出一种即可)。(6)、G的同分异构体中,含有碳氧双键的还有种(不考虑立体异构);其中,能发生银镜反应,且核磁共振氢谱显示为两组峰的同分异构体的结构简式为。 -
11、 的热分解与催化的重整结合,可生产高纯度合成气 , 实现碳资源的二次利用。主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)、位于元素周期表中区;基态的价电子排布式为。(2)、水分子的模型与其空间结构模型不同,原因是。(3)、的晶胞如图1所示(晶胞参数),该物质的化学式为。 (4)、恒压条件下,重整反应可以促进分解,原因是。(5)、在温度分别为和下,的平衡转化率与压强的关系如图2所示,反应温度最高的是(填“”“”或“”),原因是。
(4)、恒压条件下,重整反应可以促进分解,原因是。(5)、在温度分别为和下,的平衡转化率与压强的关系如图2所示,反应温度最高的是(填“”“”或“”),原因是。 (6)、一定温度、下,向体系中加入和 , 假设此条件下其他副反应可忽略,恒压反应至平衡时,体系中转化率为 , 转化率为 , 物质的量为 , 反应Ⅲ的平衡常数(保留小数点后一位),此时原位利用率为。
(6)、一定温度、下,向体系中加入和 , 假设此条件下其他副反应可忽略,恒压反应至平衡时,体系中转化率为 , 转化率为 , 物质的量为 , 反应Ⅲ的平衡常数(保留小数点后一位),此时原位利用率为。已知:原位利用率
-
12、 某研究小组设计了如下实验测定某药用硫黄中硫的含量,其中硫转化的总反应为。
主要实验步骤如下:
Ⅰ.如图所示,准确称取细粉状药用硫黄于①中,并准确加入乙醇溶液(过量),加入适量蒸馏水,搅拌,加热回流。待样品完全溶解后,蒸馏除去乙醇。

Ⅱ.室温下向①中加入适量蒸馏水,搅拌下缓慢滴加足量溶液,加热至 , 保持 , 冷却至室温。
Ⅲ.将①中溶液全部转移至锥形瓶中,加入2滴甲基橙指示剂,用标准溶液滴定至终点,消耗溶液体积为。
Ⅳ.不加入硫黄,重复步骤Ⅰ、Ⅱ、Ⅲ做空白实验,消耗标准溶液体积为。计算样品中硫的质量分数。
Ⅴ.平行测定三次,计算硫含量的平均值。
回答下列问题:
(1)、仪器①的名称是:;②的名称是。(2)、步骤Ⅰ中,乙醇的作用是。(3)、步骤Ⅰ中,样品完全溶解后,必须蒸馏除去乙醇的原因是。(4)、步骤Ⅱ中不宜采用水浴加热的原因是。步骤Ⅱ结束后,若要检验反应后溶液中的 , 实验操作是。(5)、步Ⅲ中,判断滴定达到终点的现象为。(6)、单次样品测定中硫的质量分数可表示为(写出计算式)。 -
13、 一种从预处理得到的贵金属合金粉[主要成分为、(铑)、 , 含有少量]中尽可能回收铑的工艺流程如下:

回答下列问题:
(1)、“酸溶1”的目的是。(2)、已知“酸溶2”中转化为 , 则生成该物质的化学方程式为;“滤渣”的主要成分是(填化学式)。(3)、“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量和 , 则“高温还原”中发生反应的化学方程式为。(4)、若“活化还原”在室温下进行,初始浓度为 , 为避免生成沉淀,溶液适宜的为____(填标号)[已知的]。A、2.0 B、4.0 C、6.0(5)、“活化还原”中,必须过量,其与(III)反应可生成 , 提升了的还原速率,该配离子中的化合价为;反应中同时生成 , (III)以计,则理论上和(III)反应的物质的量之比为。(6)、“酸溶3”的目的是。 -
14、 乙二胺( , 简写为Y)可结合转化为(简写为)(简写为)。与Y可形成和两种配离子。室温下向溶液中加入Y,通过调节混合溶液的改变Y的浓度,从而调控不同配离子的浓度(忽略体积变化)。混合溶液中和Y的初始浓度分别为和。与的变化关系如图1所示(其中M代表、或),分布系数与的变化关系如图2所示(其中N代表Y、或)。比如。

下列说法错误的是( )
A、曲线I对应的离子是 B、最大时对应的 C、反应的平衡常数 D、时, -
15、 在负载的催化剂作用下,可在室温下高效转化为 , 其可能的反应机理如图所示。

下列说法错误的是( )
A、该反应的原子利用率为 B、每消耗可生成 C、反应过程中,和的化合价均发生变化 D、若以为原料,用吸收产物可得到 -
16、 一种液流电解池在工作时可以实现海水淡化,并以形式回收含锂废弃物中的锂元素,其工作原理如图所示。

下列说法正确的是( )
A、Ⅱ为阳离子交换膜 B、电极a附近溶液的减小 C、电极b上发生的电极反应式为 D、若海水用溶液模拟,则每脱除 , 理论上可回收 -
17、 可持续高分子材料在纺织、生物医用等领域具有广阔的应用前景。一种在温和条件下制备高性能可持续聚酯P的路线如图所示。

下列说法错误的是( )
A、E能使溴的四氯化碳溶液褪色 B、由和G合成M时,有生成 C、P在碱性条件下能够发生水解反应而降解 D、P解聚生成M的过程中,存在键的断裂与形成 -
18、 在催化剂a或催化剂b作用下,丙烷发生脱氢反应制备丙烯,总反应的化学方程式为 , 反应进程中的相对能量变化如图所示(*表示吸附态,中部分进程已省略)。

下列说法正确的是( )
A、总反应是放热反应 B、两种不同催化剂作用下总反应的化学平衡常数不同 C、和催化剂b相比,丙烷被催化剂a吸附得到的吸附态更稳定 D、①转化为②的进程中,决速步骤为 -
19、 自旋交叉化合物在分子开关、信息存储等方面具有潜在的应用价值。某自旋交叉化合物的结构及在氯气气氛下的热重曲线分别如图1和图2所示。该化合物的相对分子质量(x为整数)。

下列说法正确的是( )
A、 B、第一电离能: C、该化合物中不存在离子键 D、该化合物中配位数与配体个数相等 -
20、 某同学设计以下实验,探究简单配合物的形成和转化。

下列说法错误的是( )
A、②中沉淀与④中沉淀不是同一种物质 B、③中现象说明配体与的结合能力: C、④中深蓝色物质在乙醇中的溶解度比在水中小 D、若向⑤中加入稀硫酸,同样可以得到黄绿色溶液