相关试卷
-
1、中国是礼仪之邦,礼器承载着国家尊严与荣光。下列有关礼器主要成分不同于其余三个的是


A.四羊方尊
B.良渚玉琮


C.西周利簋
D.商青铜觚
A、A B、B C、C D、D -
2、酸性溶液主要组成为与(与会络合为),其具有溶铜速率快、稳定、易控制及易再生等优点,常应用于印刷线路板(PCB)的刻蚀。刻蚀原理为 ,(1)、CuCl中基态亚铜离子的价层电子轨道表示式为。(2)、溶液中存在平衡: , 下列说法不正确的是_______(填序号)。A、加入几滴溶液,平衡逆向移动 B、加热溶液,溶液由蓝绿色变为黄绿色,平衡常数增大 C、加水稀释,的比值会减小 D、加入少量固体,平衡正向移动,转化率增大(3)、盐酸的浓度会影响刻蚀速率,浓度相同,盐酸浓度分别为、、时,随时间的变化曲线如图所示,中间速率变缓慢的可能原因是。
时,在内,的平均生成速率为。
 (4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的浓度的负对数)的关系如图所示。
(4)、能形成多种配合物。铜氨溶液具有显著的抗菌作用。往溶液中通入氨气,测得和铜氨各级配合物的物质的量分数与平衡体系的浓度的负对数)的关系如图所示。
①曲线5代表的含铜微粒为。
②b点的纵坐标为。
③结合图像信息,计算反应的平衡常数。(已知的 , 写出计算过程)
-
3、锗单质在光纤通信、国防科技、航空航天技术和半导体材料等领域的应用日趋广泛。工业上一种以冶锌废渣(主要为Zn、Fe、Ge等的氧化物)为原料制备锗的流程如图所示。

已知:①25℃时, , ;
②当离子浓度小于等于时认为该离子已沉淀完全。
③溶浸中元素形式存在回答下列问题:
(1)、“溶浸”时要先把废渣粉碎过筛,目的是;加入的作用是。(2)、在实验室进行“沉锗”后分离得到操作所需的玻璃仪器有。(3)、“氧化”时反应(氧化产物标准状况下为气态)的氧化剂和还原剂的物质的量之比为。(4)、选择氢气还原氧化锗,而不是焦炭,原因可能是(答出一条即可);写出该步骤反应的化学方程式:。(5)、若采用加入氨水沉淀法获得 , 当溶液中恰好完全沉淀时,此时沉淀后溶液中(填“>”“<”或“=”)。(6)、通过掺杂硅可将锗单质转化为不同掺杂比例的硅锗合金,某种硅锗合金的立方晶胞结构如图所示。图中①指示的锗原子的分数坐标为;若该合金的密度为 , 则阿伏加德罗常数(用含、的代数式表示)。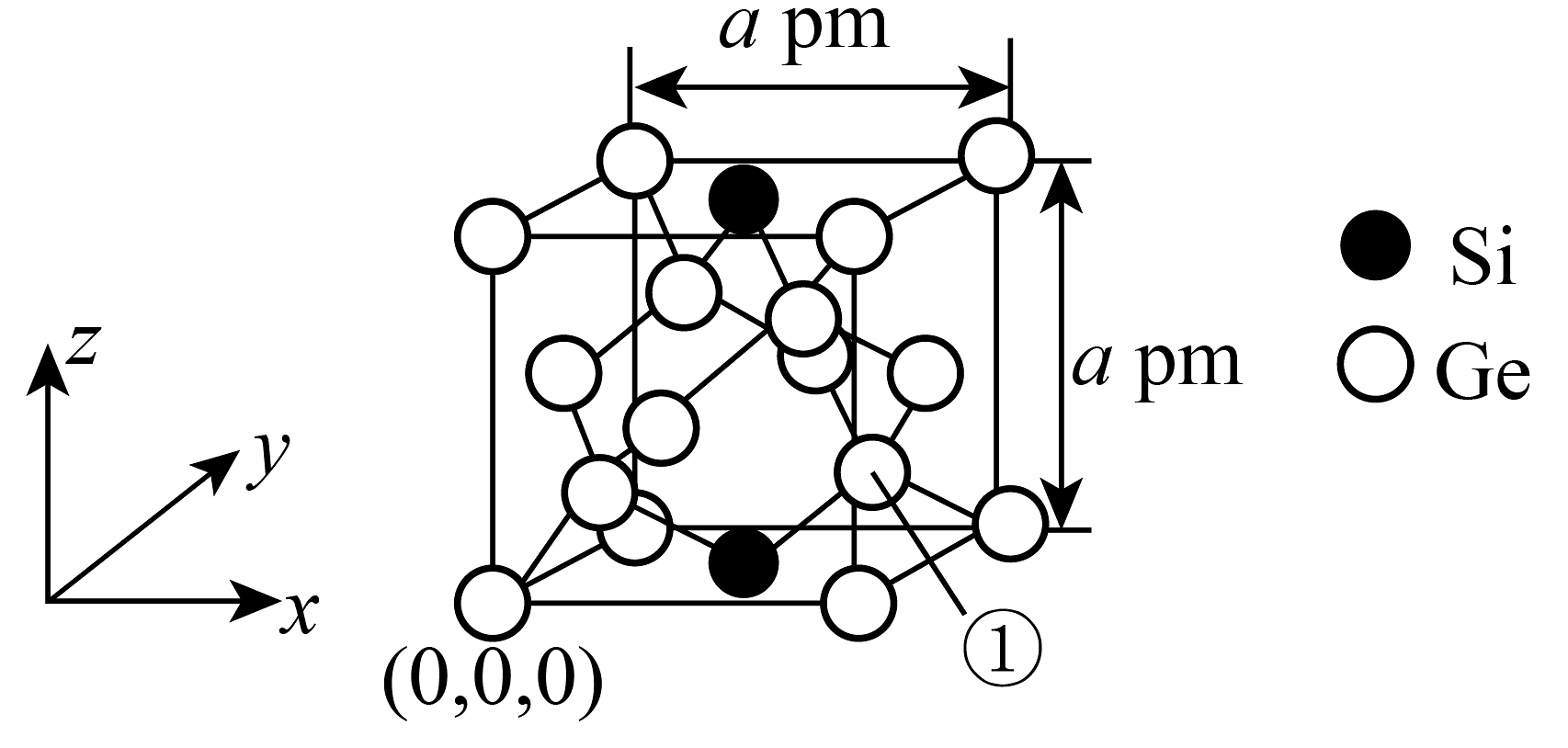
-
4、
I.关于氨的研究学习
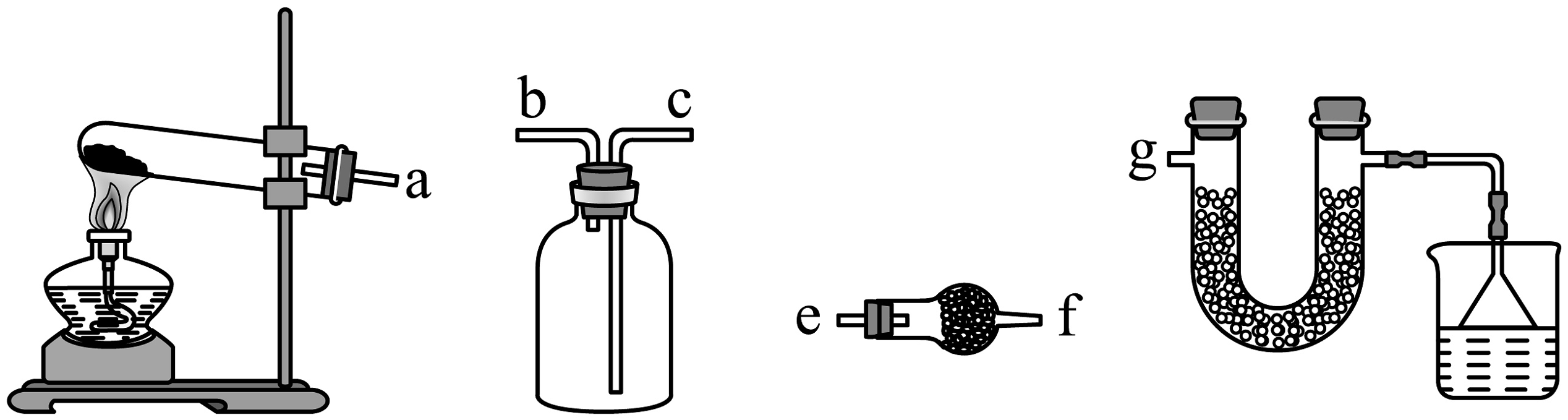
(1)氨气制备装置如下图
①利用上图装置进行实验室制备NH3 , 反应的化学方程式为。
②制取并收集纯净干燥NH3 , 连接装置:ag(填接口字母)。
③球形干燥管和U形管中装干燥剂,下列干燥剂可以选择的是。
A.P2O5 B.碱石灰 C.无水CaCl2
(2)检验某盐溶液中是否含有 , 实验操作和现象:取少量该溶液于试管中,(完成该实验操作、现象和结论)。
(3)用氨水洗涤离心试管中残留的AgCl固体,离子方程式:。
Ⅱ.探究银氨溶液与醛基的反应
实验1:往20mL0.1mol/LAgNO3溶液中滴加3滴乙醛,水浴加热。无明显现象。
实验2:往20mL0.1mol/L银氨溶液中滴加3滴乙醛,水浴加热。出现光亮的银镜。
针对上述实验甲同学基于氧化还原的知识提出以下假设:
假设1:乙醛在碱性条件下还原性增强。假设2:……
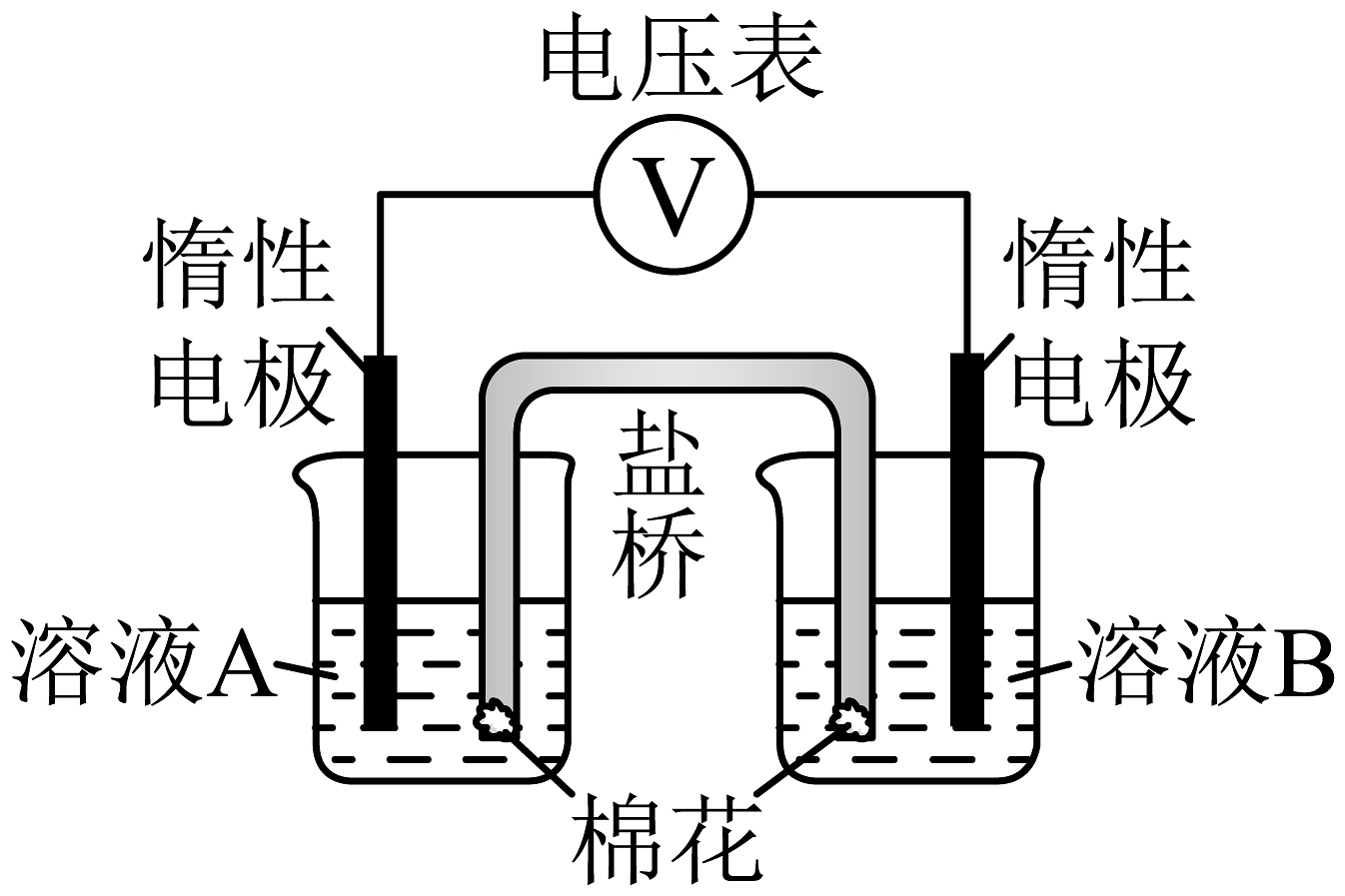
为验证以上假设,甲同学设计了如图所示的电化学装置,并进行了以下四组实验。每组实验中,溶液A和溶液B体积均为20mL,浓度均为0.1mol/L,向溶液B中滴加3滴乙醛后,测得电压表读数如表所示。
已知:参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大。
编号
溶液A
溶液B
电压表读数
ⅰ
AgNO3溶液
NaCl溶液
U1
ⅱ
AgNO3溶液
NaOH溶液
U2
ⅲ
银氨溶液
NaCl溶液
U3
ⅳ
银氨溶液
溶液
U4
(4)实验ⅰ和实验ⅲ中,溶液B选用NaCl溶液,而不使用蒸馏水的原因是。
(5)①由实验数据可知假设1成立。假设1成立的判断依据是:。
②碱性条件下,乙醛发生氧化反应的电极方程式为:。
(6)甲同学分别对比了实验ⅰ和实验ⅲ、实验ⅱ和实验ⅳ数据,你认为甲同学想研究的问题是:
(7)乙同学使用pH计测得0.1mol/LAgNO3溶液的pH=6,并指出:在酸性环境,也可能氧化乙醛;这会影响数据的测定和实验结果的判断。
针对该质疑,甲同学在实验ⅰ的基础上进行改进和优化,增设了一组实验v,测得电压表读数远小于U1,因此实验中的影响可忽略。请你简述该改进和优化的方案:。
-
5、某实验小组尝试设计如下装置,利用光伏发电,以甲苯为原料通过间接氧化法制取苯甲酸并实现储能,反应原理如下图所示。下列有关说法错误的是
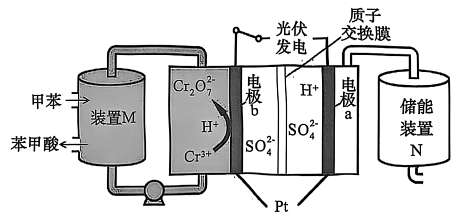 A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应:
A、电极a为阴极,通过质子交换膜移向a极 B、装置中发生反应: C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
C、每生成 , 理论上装置中可获得苯甲酸
D、电极发生电极反应为
-
6、部分含硫元素或氮元素物质的类别与相应化合价关系如图所示。

下列描述不合理的是
A、在自然界中存在c,说明该元素非金属性较弱 B、一定条件下,b与e可发生反应转化为c C、f、g为常见的强酸,常温下其浓溶液可用铁制容器储运 D、a、b分子中中心原子的VSEPR模型相同 -
7、已知:甲酸可以分解制取;某学习小组设计实验制取并验证其性质的装置如图所示(部分夹持装置略),下列说法不正确的是
 A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气
A、浓硫酸的作用为催化剂、脱水剂 B、碱石灰可吸收水蒸气和甲酸蒸气以及可能产生的和 C、该装置可验证具有还原性 D、可用NaOH溶液吸收尾气,防止污染空气 -
8、酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法错误的是
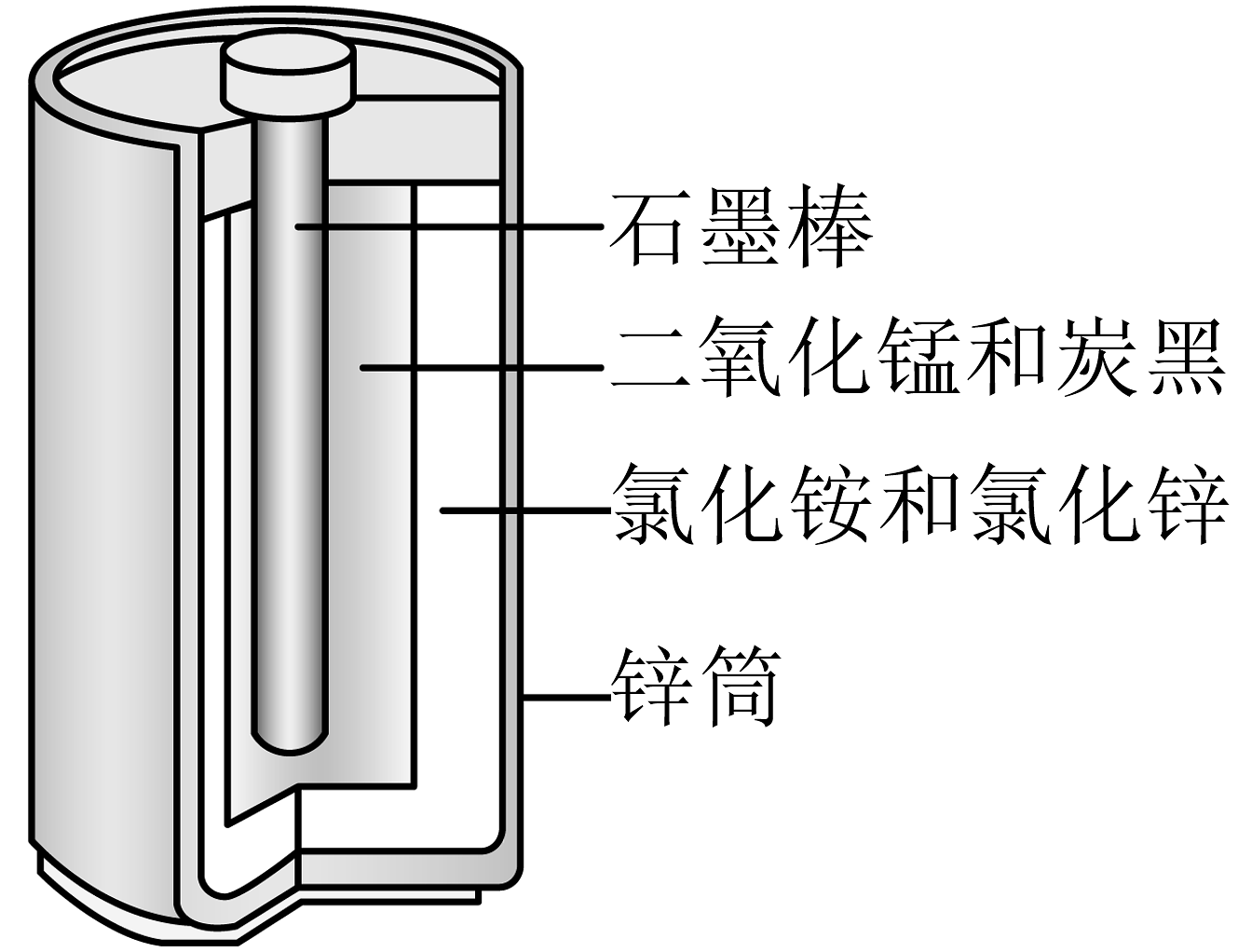 A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为
A、石墨作电池的正极材料 B、电池工作时,向正极方向移动 C、发生氧化反应 D、锌筒发生的电极反应为 -
9、提纯混有少量苯甲酸的苯甲醇(常温为液态,微溶于水)过程如图所示,其中操作为
 A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液
A、冷却结晶 B、蒸发结晶 C、蒸馏 D、萃取分液 -
10、劳动开创未来,下列劳动项目与所述的化学知识有关联的是
选项
劳动项目
化学知识
A
做水果罐头时加入维生素C
维生素C受热易分解
B
用固体疏通剂处理管道堵塞
C
用除去废水中的
具有很强的还原性
D
用氢氟酸雕刻玻璃花纹
氢氟酸具有弱酸性
A、A B、B C、C D、D -
11、1774年舍勒发现了氯气。下列有关氯气制备的实验装置不正确的是

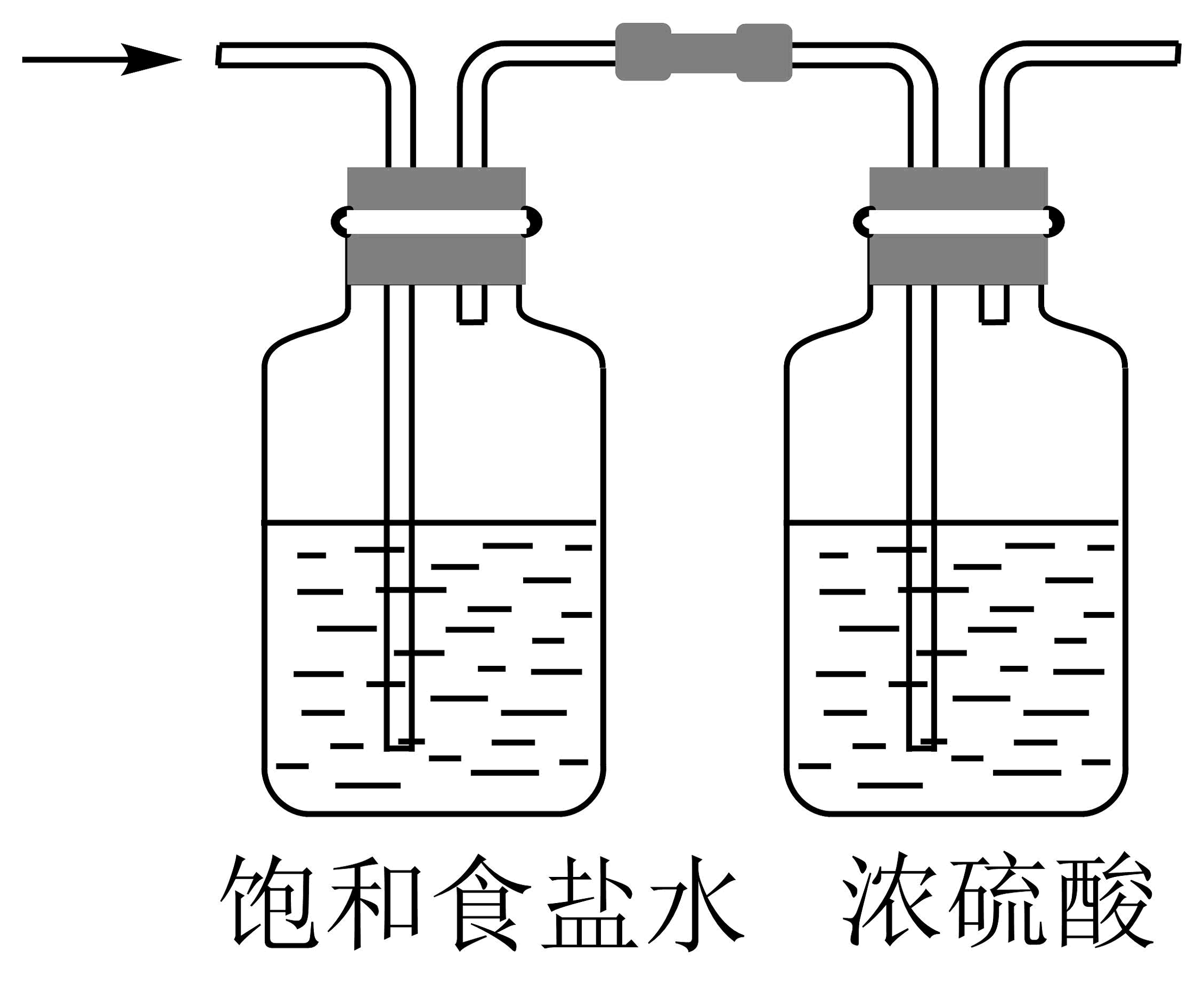
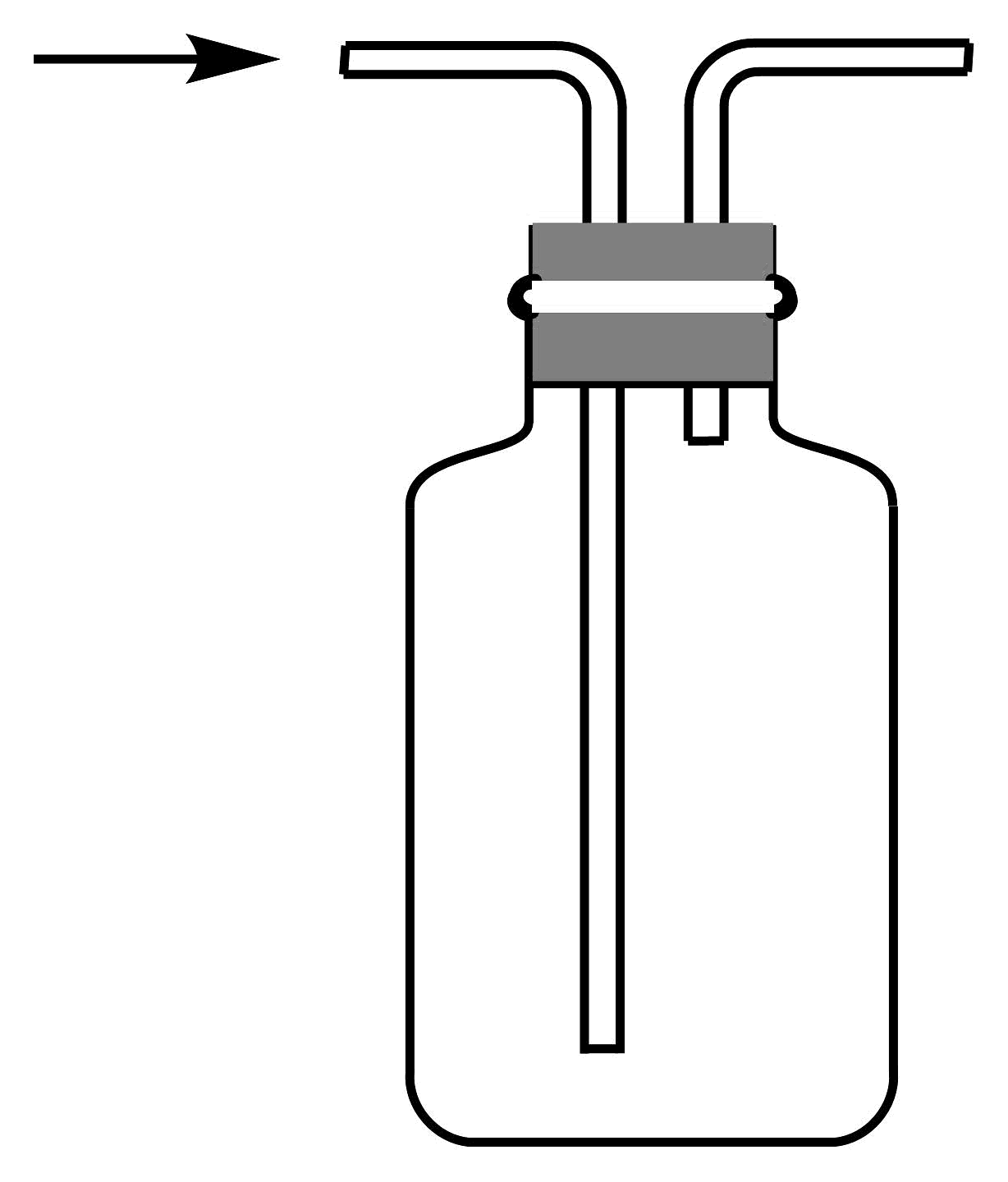

A.制备氯气
B.净化氯气
C.收集氯气
D.尾气处理
A、A B、B C、C D、D -
12、化学助力于人类创造美好生活,下列说法正确的是A、节日里燃放五颜六色的烟花,电子从基态跃迁到激发态以光的形式释放能量 B、传感器测土壤酸碱性,用改善酸性土壤 C、乘氢能源电池公交车出行,沸点低、极易液化 D、锂电池无人机助力现代农业,锂电池放电时化学能转化为电能
-
13、最近,我国在战斗机技术和预警机技术上实现重大跨越,第六代战机歼36试飞成功以及空警3000预警机首次亮相,标志着中国军事力量的全面提升。下列说法正确的是A、钛合金是一种高强度、耐腐蚀的复合材料,钛元素在元素周期表中位于第ⅡB族 B、碳化硅(SiC)是一种耐高温陶瓷材料,属于分子晶体 C、发动机用到的超高温合金含有铌、铁、镍等元素,的中子数为30 D、氢气是战斗机的主要燃料之一,H和D互为同素异形体
-
14、岭南文化源远流长,对社会的发展起着积极的推动作用。下列地方文化涉及的材料不属于有机高分子化合物的是
选项
A
B
C
D
地方文化

顺德木制龙舟

石湾陶塑

广东剪纸

粤剧现代戏服
A、A B、B C、C D、D -
15、抗癌药物(G)对胃肠道肿瘤、胰腺癌有一定治疗作用,合成G的一种方法如下:

已知:遇水即放出和。
Ⅰ:

Ⅱ:

回答下列问题:
(1)、化合物A中含有的官能团名称为、。(2)、的反应中,的作用是。(3)、的反应类型是 , 反应的方程式为。(4)、的过程中,若用与直接反应制 , 所需试剂较多,后续处理麻烦;若用与 反应制处理较为简单,易于操作,制备过程中加入有机碱吡啶
反应制处理较为简单,易于操作,制备过程中加入有机碱吡啶 或可提高的产率,原因是 , 实验测得用比用吡啶的产率更高,原因是。 (5)、化合物
或可提高的产率,原因是 , 实验测得用比用吡啶的产率更高,原因是。 (5)、化合物 是上述合成路线中的重要中间体,写出同时符合下列条件的该化合物的同分异构体的结构简式。
是上述合成路线中的重要中间体,写出同时符合下列条件的该化合物的同分异构体的结构简式。①是苯的二取代物;
②核磁共振氢谱和红外光谱检测表明:分子中有4种不同化学环境的氢原子,有碳氧双键无碳氧单键。
(6)、参照上述合成路线,设计以 、
、 和
和 为原料合成
为原料合成 的路线(无机试剂任选)。
的路线(无机试剂任选)。 -
16、为应对全球气候变暖等环境问题,碳捕集、利用和封存(CCUS)技术得到了越来越多的关注。加氢制甲醇既可实现资源化利用,也可实现可再生能源的化学储存,是一种重要的CCUS技术。回答下列问题(1)、200℃时,加氢制甲醇主要发生下列反应:
反应的 , 该反应自发进行的条件是。
(2)、从分子水平上探究反应机理可为设计高效催化剂提供理论指导。加氢制甲醇反应在不同载体的催化剂催化作用下反应的过程如图所示。其中带“*”的物种表示吸附在催化剂表面。
根据势能图,COOH*羧酸盐路径决速步的活化能为 , HCOO*甲酸盐路径中反应速率影响最大的基元反应方程式是 , 实验测得甲酸盐路径更容易进行,原因是。
(3)、一定压强条件下,催化剂A和催化剂B在不同温度下的催化性能分别如图1、2所示,应选用的催化剂是(填“A”或“B”),理由是。 (4)、200℃、压强为的条件下,在恒容密闭容器中加入催化剂、和反应并达到平衡状态,测得反应的数据如图1,平衡转化率为 , 甲醇选择性为80%,计算主反应在该温度下的分压平衡常数。[列出计算式即可,分压总压物质的量分数,甲醇选择性](5)、为深入研究催化剂和催化剂对转化率的影响,根据Arrhenius方程( , 是速率常数,是定值,是活化能,是气体常数,是绝对温度)测定了催化剂A、B的反应活化能,结果如图,催化剂B对应的曲线是。
(4)、200℃、压强为的条件下,在恒容密闭容器中加入催化剂、和反应并达到平衡状态,测得反应的数据如图1,平衡转化率为 , 甲醇选择性为80%,计算主反应在该温度下的分压平衡常数。[列出计算式即可,分压总压物质的量分数,甲醇选择性](5)、为深入研究催化剂和催化剂对转化率的影响,根据Arrhenius方程( , 是速率常数,是定值,是活化能,是气体常数,是绝对温度)测定了催化剂A、B的反应活化能,结果如图,催化剂B对应的曲线是。 (6)、科学家发明了一种由阴离子交换树脂——碳纳米管构成的膜分离装置(如图)可以连续去除空气中的 , 在富集的同时获得基本不含的空气,除去的空气可用于碱性燃料电池。
(6)、科学家发明了一种由阴离子交换树脂——碳纳米管构成的膜分离装置(如图)可以连续去除空气中的 , 在富集的同时获得基本不含的空气,除去的空气可用于碱性燃料电池。
①写出侧转化成的电极反应方程式。
②膜分离装置中复合薄膜的作用是。
-
17、近年来全球电动汽车销量激增,废旧锂电池的回收愈发迫在眉睫。以废旧三元锂电池正极材料的硫酸浸出液(含Ni、Co、Mn、Li)为研究对象,采用Cyanex 301(一种酸性萃取剂)选择性分离回收其中的和;和代表萃取率。工艺流程如图所示:

回答下列问题:
(1)、Co在周期表中的位置。(2)、水相经加碱调节后,通入空气可将氧化成固体氧化物,从而实现分离,写出反应的离子方程式。(3)、遇到氨性溶液(由、和配制)会转化为 , 此时氧化剂与还原剂的物质的量之比为。(4)、Cyanex 301是一种酸性萃取剂,其与金属离子的萃取反应可简易表示为:式中:为被萃金属离子;为萃取剂Cyanex 301,结合下图第一次反萃取过程中HCl的浓度应为mol/L,简述选择此浓度的原因。 (5)、提纯的镍和钴可用于制取镍四甲基酞箐与钴四氨基酞箐双位点电催化剂,下图中镍的化合价为。
(5)、提纯的镍和钴可用于制取镍四甲基酞箐与钴四氨基酞箐双位点电催化剂,下图中镍的化合价为。 (6)、从溶液中获取干燥的晶体的操作步骤为。(7)、由等物质可制备晶体,其立方晶胞如图所示。与最小间距大于与最小间距,、为整数。则在晶胞中的位置为;晶体中一个Al周围与其最近的O的个数为。
(6)、从溶液中获取干燥的晶体的操作步骤为。(7)、由等物质可制备晶体,其立方晶胞如图所示。与最小间距大于与最小间距,、为整数。则在晶胞中的位置为;晶体中一个Al周围与其最近的O的个数为。
-
18、乙烯是合成纤维、橡胶、塑料和乙醇的基本化工原料。某实验小组利用如图装置(夹持装置省略)制备乙烯并进行产率的测定:

Ⅰ.乙烯的制备方法
检查装置的气密性,将适量的固体乙烯利加入到滴液式气体发生器的反应容器中,储液杯中加入碱液,打开a,使碱液滴入反应容器后与固体乙烯利充分接触产生气体,收集乙烯并验纯。
Ⅱ.碱溶液的选择
称取乙烯利固体分别与不同浓度氢氧化钠溶液和氢氧化钾溶液反应,根据实验现象,确定最佳反应溶液。
Ⅲ.乙烯产率的测定
用分析天平分别称取不同质量的乙烯利固体与步骤Ⅱ中确定的最佳反应碱溶液反应,测定产生乙烯的体积并计算产率。
已知:固体乙烯利(
 )难溶于水,和强碱溶液反应除生产乙烯外还产生氯化盐、磷酸盐等。回答下列问题:(1)、a的作用。(2)、步骤Ⅱ的实验现象如下表:
)难溶于水,和强碱溶液反应除生产乙烯外还产生氯化盐、磷酸盐等。回答下列问题:(1)、a的作用。(2)、步骤Ⅱ的实验现象如下表:序号
氢氧化钠溶液浓度/%
实验现象
序号
氢氧化钾溶液浓度/%
实验现象
1
20
产气速率较慢,反应器壁温,气流不平稳,反应过程中出现盐析现象
1
20
产气速率较慢,反应器壁温,气流不平稳,无盐析现象
2
30
产气速率较快,反应器壁温,气流不平稳,反应过程中出现盐析现象
2
30
产气速率较快,反应器壁温,气流平稳,无盐析现象
3
35
产气速率较快,反应器壁温热,气流平稳,反应过程中出现盐析现象
3
35
产气速率很快,反应器壁温热,气流平稳,无盐析现象
由上表分析可知:制备乙烯的最佳反应溶液选择 , 当出现盐析现象时,对反应速率和产率产生不利影响的原因是。
(3)、步骤Ⅱ中称取固体时,下列实验仪器中用到的有、。(填仪器名称) (4)、写出步骤Ⅲ中反应的化学方程式 , 的空间结构为。(5)、步骤Ⅲ的部分实验数据如下表,计算乙烯产率和乙烯平均产率。
(4)、写出步骤Ⅲ中反应的化学方程式 , 的空间结构为。(5)、步骤Ⅲ的部分实验数据如下表,计算乙烯产率和乙烯平均产率。序号
乙烯利的质量(g)
乙烯体积(mL)
乙烯体积理论值(mL)
乙烯产率(%)
乙烯平均产率(%)
1
7.0869
1010
1099
2
7.0561
995
1094
90.95
3
7.0347
993
1091
91.02
(6)、与实验室用乙醇和浓硫酸制备乙烯相比,利用此装置制备乙烯的优点是。 -
19、常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随的变化曲线如图所示。已知:。下列说法错误的是
 A、a点溶液约为3.38 B、b点: C、c点: D、时,
A、a点溶液约为3.38 B、b点: C、c点: D、时, -
20、一种装载双原子双层带电膜(EM)电极材料可将硝酸盐还原为 , 为低浓度的硝酸盐污染提供高效实用的解决方案,工作原理如图所示。下列说法错误的是
 A、装置工作一段时间后,阳极区减小 B、阴极发生的反应为 C、相同条件下,阴阳两极产生气体的体积比为 D、带电膜阳极上的游离氯可将氧化为
A、装置工作一段时间后,阳极区减小 B、阴极发生的反应为 C、相同条件下,阴阳两极产生气体的体积比为 D、带电膜阳极上的游离氯可将氧化为