相关试卷
-
1、如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,W、Y原子中未成对电子数均为3。下列说法正确的是
 A、两种化合物中都有一个苯环 B、原子半径:Z>Y>X>W C、最高价含氧酸的酸性:X>Z>W>Y D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
A、两种化合物中都有一个苯环 B、原子半径:Z>Y>X>W C、最高价含氧酸的酸性:X>Z>W>Y D、Z、W和氢三种元素可形成同时含有离子键和共价键的化合物 -
2、某钙钛矿型太阳能电池吸光材料的晶胞如图所示,其中A为 , 可由分子制得,晶胞参数为a nm,为阿伏加德罗常数的值。下列说法错误的是
 A、1mol 中含有7NAσ键 B、与最近距离的数为8 C、该晶体属于混合型晶体 D、晶胞密度的计算式为
A、1mol 中含有7NAσ键 B、与最近距离的数为8 C、该晶体属于混合型晶体 D、晶胞密度的计算式为 -
3、下列实验操作与现象,得出的结论错误的是
选项
实验操作与现象
结论
A
将充满的玻璃球浸泡在冰水中,红棕色变浅
△H<0
B
用pH试纸测0.01mol/L 溶液的酸碱性,试纸显红色
是弱酸
C
向含有酚酞的溶液中加入少量固体,溶液红色变浅
溶液中存在水解平衡
D
室温下,向0.1mol/L NaCl和0.01mol/L NaI混合溶液中逐滴滴加溶液,立即出现黄色沉淀
相同温度下:(AgCl)>(AgI)
A、A B、B C、C D、D -
4、已知反应 , 为阿伏加德罗常数的值,若消耗44.8L(标准状况) , 下列叙述正确的是A、转移的电子数为12 B、反应的分子数为3 C、生成的中Si-N键数为4 D、生成的CO含有的孤电子对数为6
-
5、使用含氟牙膏是目前应用最广泛的预防龋齿的措施。添入牙膏中的氟化物主要有一氟磷酸钠()等。下列说法错误的是A、一氟磷酸钠水溶液呈碱性 B、和的空间结构均为正四面体形 C、预防龋齿的原理是 D、的溶解度比小
-
6、下列离子方程式中,正确的是A、向稀中滴加少量溶液: B、向溶液中加入少量: C、向溶液中通入少量: D、向溶液中加入过量NaOH溶液并加热:
-
7、下列实验装置及操作能达到相应实验目的的是
 A、配制500mL饱和溶液 B、制备氢氧化铁胶体 C、分离得到氢氧化铁胶体 D、将氢氧化铁胶体转化为氢氧化铁沉淀
A、配制500mL饱和溶液 B、制备氢氧化铁胶体 C、分离得到氢氧化铁胶体 D、将氢氧化铁胶体转化为氢氧化铁沉淀 -
8、有机物M是一种药物合成中间体,其结构简式如图所示。下列有关说法错误的是
 A、M的分子式为 B、M分子中含有四种官能团和1个手性碳原子 C、1mol M与足量氢气反应可消耗5mol D、M既能与盐酸反应又能与氢氧化钠反应
A、M的分子式为 B、M分子中含有四种官能团和1个手性碳原子 C、1mol M与足量氢气反应可消耗5mol D、M既能与盐酸反应又能与氢氧化钠反应 -
9、明矾晶体的培养需要加入铬钾矾晶体,铬钾矾晶体中含有H、O、S、K、Cr五种元素。下列说法正确的是A、Cr位于元素周期表第ⅥB族 B、5种元素中,第一电离能最大的是S C、5种元素中,电负性最小的是H D、基态时,S原子和K原子的单电子数相等
-
10、是火箭固体燃料的重要载体,与某些易燃物作用可全部生成气态产物,如:。下列有关化学用语错误的是A、Cl的原子结构示意图为
 B、的电子式为
B、的电子式为 C、分子的空间结构模型为
C、分子的空间结构模型为 D、分子中的C原子采取杂化
D、分子中的C原子采取杂化
-
11、唑草酮是一种药性强、易降解、污染少的除草剂,其中一种合成路线为:

已知:①DPPA是一种叠氮化试剂
②

回答下列问题:
(1)、A中含有官能团的名称为。(2)、下列说法正确的是 。A、唑草酮含有两个手性碳原子 B、A与B反应得到C的目的是保护氨基 C、F→G的反应类型包括加成反应和消去反应 D、碱性由弱到强的顺序为:E<A<F(3)、G的结构简式为。(4)、D→E的化学方程式为。(5)、C存在多种同分异构体,写出符合下列条件的结构简式(不考虑立体异构)。①分子中含有苯环,且能发生银镜反应;
②核磁共振氢谱图中有5组峰;
③分子中含有手性碳原子
(6)、结合本题流程,以苯胺( )和苯甲醛(
)和苯甲醛(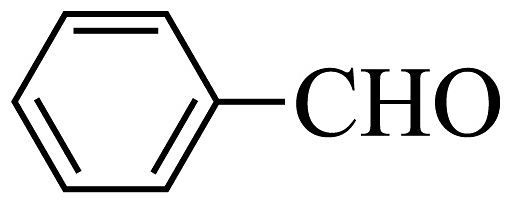 )为有机原料,无机试剂任选,合成化合物M(
)为有机原料,无机试剂任选,合成化合物M( )的合成路线。
)的合成路线。 -
12、实验室分离提纯甲苯、苯胺与苯甲酸的混合物的方案如下。
 (1)、写出水洗操作中用到最主要的玻璃仪器名称:;苯胺沸点高于甲苯沸点的原因是。(2)、步骤①加入盐酸发生反应的化学方程式为。(3)、步骤②利用强酸制弱酸得到的产物固体的主要成分为苯甲酸,为进一步分离提纯固体 , 下列操作步骤正确的排序为(填序号)。
(1)、写出水洗操作中用到最主要的玻璃仪器名称:;苯胺沸点高于甲苯沸点的原因是。(2)、步骤①加入盐酸发生反应的化学方程式为。(3)、步骤②利用强酸制弱酸得到的产物固体的主要成分为苯甲酸,为进一步分离提纯固体 , 下列操作步骤正确的排序为(填序号)。a.趁热过滤 b.冷却结晶 c.加热溶解 d.常温过滤 e.洗涤、干燥
(4)、当时,认为苯甲酸沉淀完全,则苯甲酸恰好沉淀完全时,溶液的(已知:苯甲酸的)。(5)、粗品有机相Ⅲ需要通过水蒸气蒸馏进一步提纯,该方法是将水蒸气通入有机物中,使该有机物在低于100℃的温度下,随着水蒸气一起蒸馏出来,从而保证有机物不被破坏。装置如图所示(夹持装置已略去)。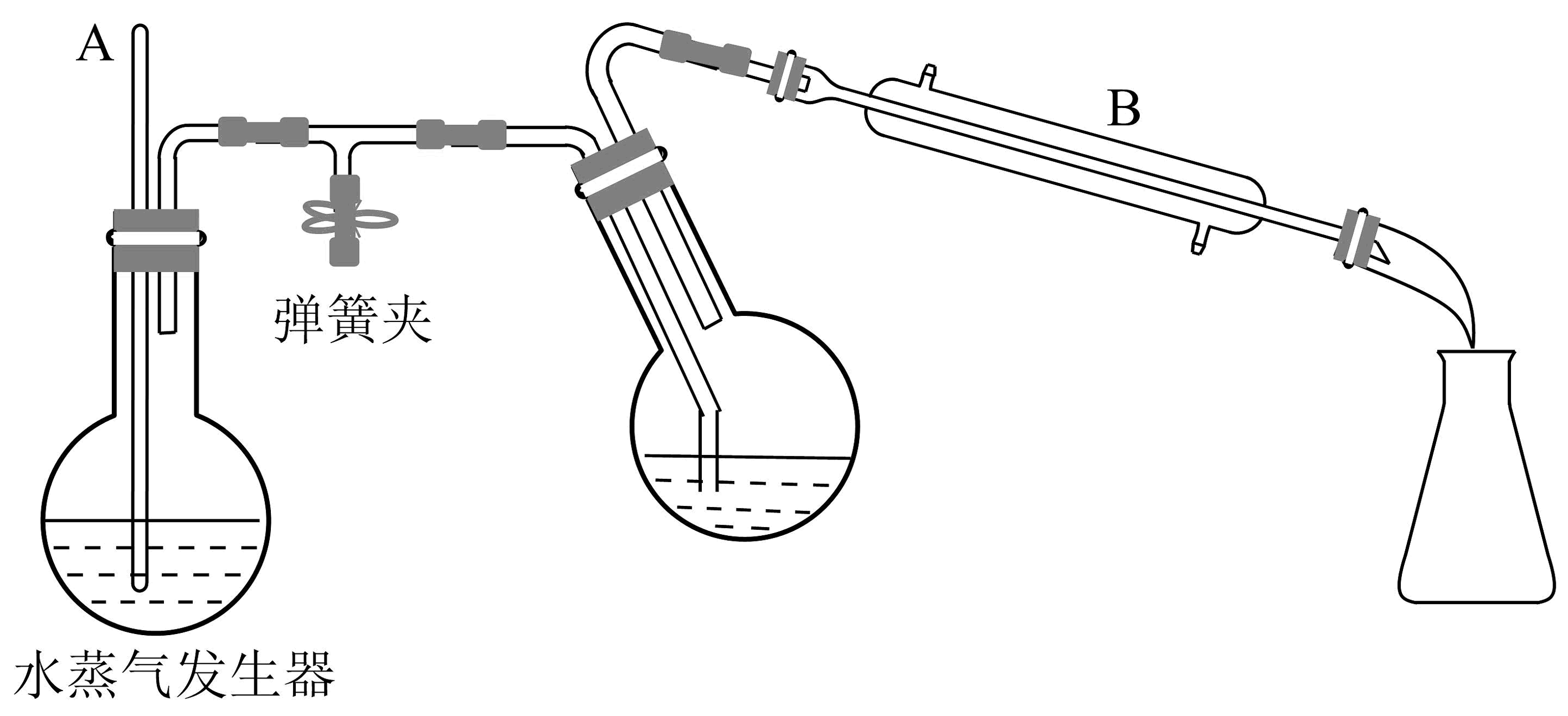
①装置中长玻璃管A的作用是。
②实验结束后,锥形瓶中的现象为。
-
13、Al元素具有很广泛的应用。(1)、请写出基态Al原子价层电子的电子排布图。(2)、与Al同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表 。
 A、a为I1、b为I2、c为I3 B、a为I2、b为I3、c为I1 C、a为I3、b为I2、c为I1 D、a为I1、b为I3、c为I2(3)、已知某晶体晶胞中阴离子做面心立方堆积,阴离子的位置(隐去阳离子)如图1所示,其晶胞中的阳离子在xy、xz、yz平面投影(隐去阴离子)均如图2所示,晶胞参数为apm。
A、a为I1、b为I2、c为I3 B、a为I2、b为I3、c为I1 C、a为I3、b为I2、c为I1 D、a为I1、b为I3、c为I2(3)、已知某晶体晶胞中阴离子做面心立方堆积,阴离子的位置(隐去阳离子)如图1所示,其晶胞中的阳离子在xy、xz、yz平面投影(隐去阴离子)均如图2所示,晶胞参数为apm。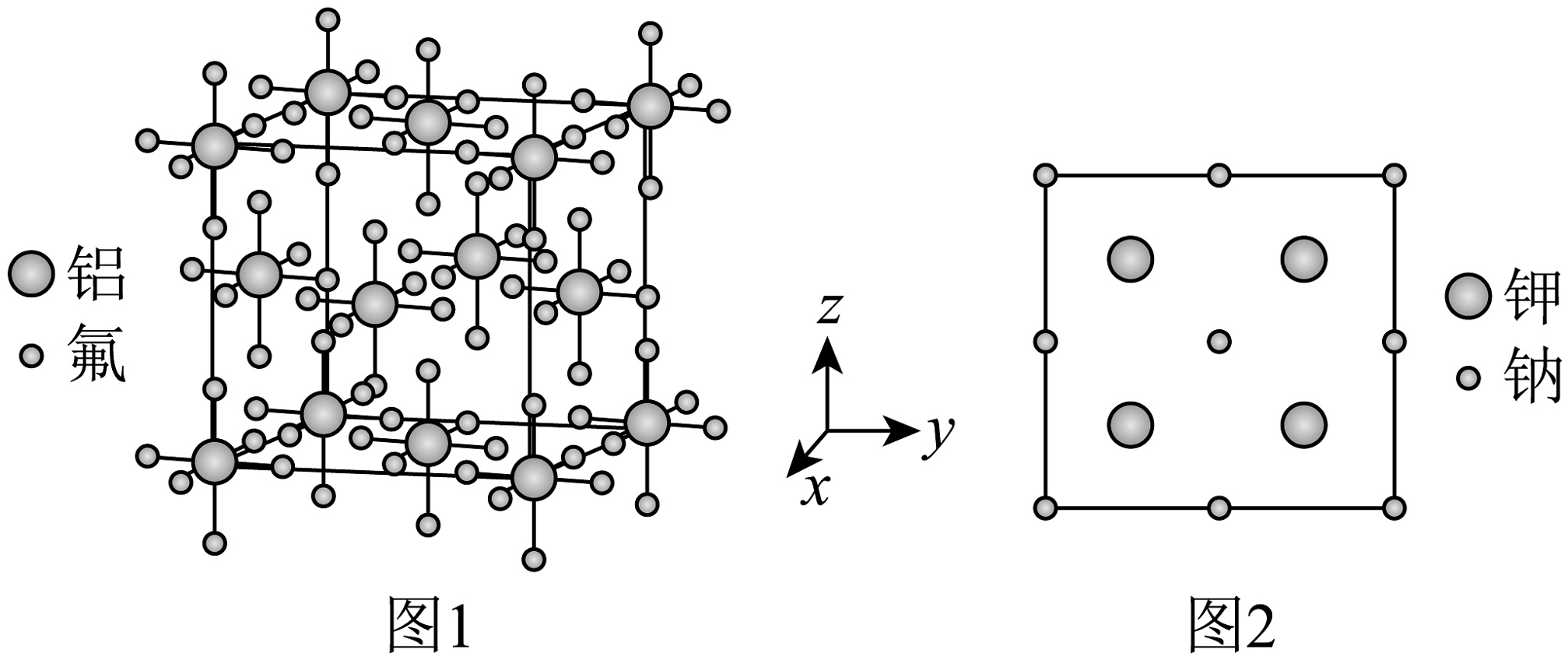
该物质的化学式为 , K+的配位数(紧邻的阴离子数)为。
(4)、聚合氯化铝是一种介于AlCl3和Al(OH)3之间的水溶性无机高分子聚合物,兴趣小组以铝土矿(主要成分为Al2O3 , 还含有少量Fe2O3和SiO2)为主要原料制备聚合氯化铝和金属铝的流程如图所示。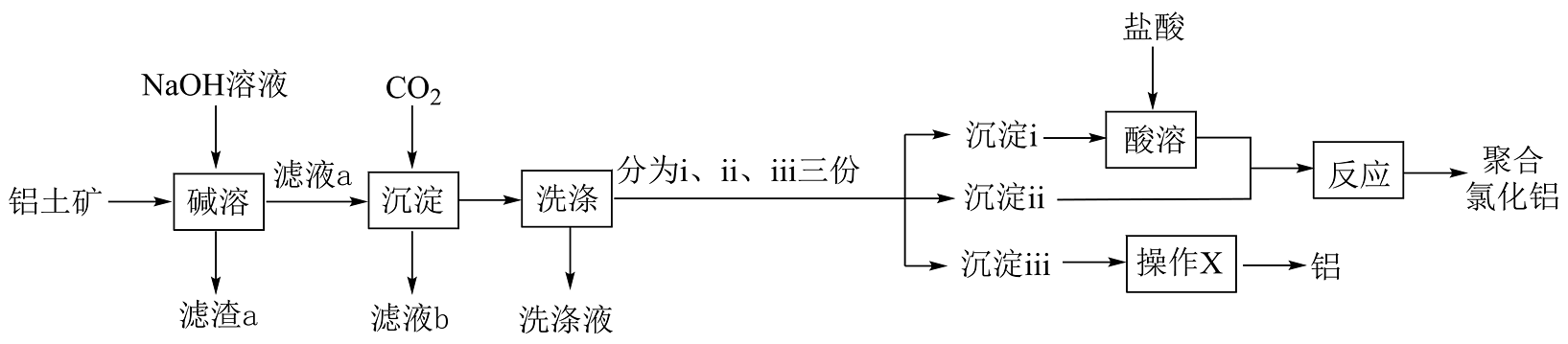
已知滤渣a中含有难溶的铝硅酸盐。
①下列说法正确的是。
A.“碱溶”时,所用NaOH溶液不能更换为氨水“碱溶”
B.滤液a中的溶质主要成分为NaOH、Na[Al(OH)4]、Na2SiO3
C.“操作X”可以是盐酸溶解、HCl气流中结晶、脱水、电解
D.通过控制沉淀ⅰ、ⅱ的比例可改变聚合氯化铝的组成
②若滤液a浓度较大,“沉淀”时通入过量CO2不利于减少生成沉淀中的杂质,原因是。
(5)、比较四羟基合铝酸根和硼酸根的碱性强弱[Al(OH)4]-[B(OH)4]-(填“>”、“<”);并从两者化学键的角度说明理由。(6)、无水氯化铝常用熔融盐电镀铝工艺中,在熔融的AlCl3、NaCl、KCl盐中存在着AlCl、Al2Cl、Na+、K+和Cl-离子,写出Al2Cl的结构式:。 -
14、以炼铁厂锌灰(主要成分为ZnO,含少量的CuO、MnO2、Fe2O3)原料制备的流程如图所示,已知:“浸取”工序中ZnO、CuO分别转化为可溶性的[Zn(NH3)4]2+和[Cu(NH3)4]2+。下列说法正确的是
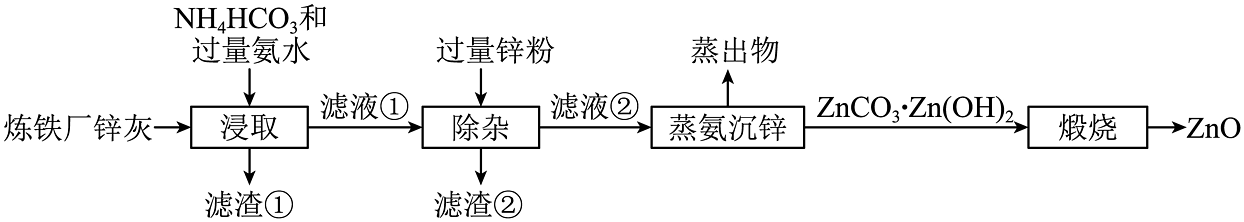 A、H-N-H的键角:[Cu(NH3)4]2+<NH3 B、滤渣②的主要成分为Fe2O3、Cu和Zn C、“滤渣①”经稀盐酸溶浸、过滤可获得MnO2 D、“浸取”采用较高温度更有利于提高浸取率
A、H-N-H的键角:[Cu(NH3)4]2+<NH3 B、滤渣②的主要成分为Fe2O3、Cu和Zn C、“滤渣①”经稀盐酸溶浸、过滤可获得MnO2 D、“浸取”采用较高温度更有利于提高浸取率 -
15、HA是一元弱酸,难溶盐MA的饱和溶液中c2(M+)随c(H+)而变化,已知M+不发生水解。实验发现,298K时c2(M+)—c(H+)为线性关系,如下图中实线所示。下列叙述正确的是
 A、溶液pH=4时,c(A-)=1.0×10-4mol·L-1 B、HA的电离常数Ka≈2.0×10-5 C、 D、溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
A、溶液pH=4时,c(A-)=1.0×10-4mol·L-1 B、HA的电离常数Ka≈2.0×10-5 C、 D、溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-) -
16、氮氧化物(NOx)是硝酸和肼等工业的主要污染物。一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,反应物A在沸石笼内转化为B、C、D等中间体的过程如图2所示。下列说法正确的是
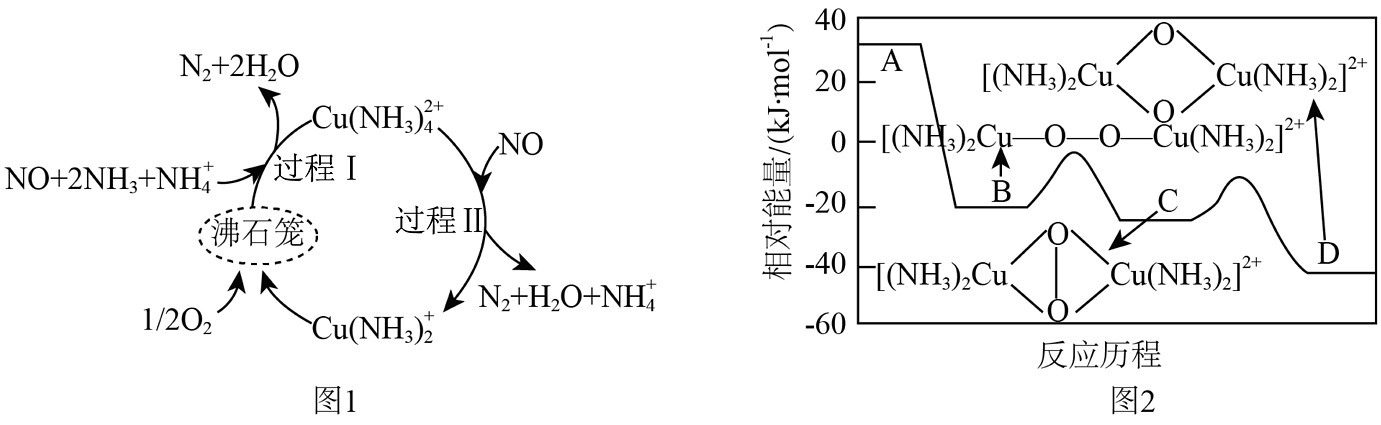 A、过程Ⅰ涉及非极性共价键的断裂与生成 B、过程Ⅱ中,脱除1molNO转移6mol电子 C、脱除NO的总反应中,氧化剂和还原剂的物质的量之比为4:5 D、图1总反应的化学方程式为4NO+4NH3+O24N2+6H2O
A、过程Ⅰ涉及非极性共价键的断裂与生成 B、过程Ⅱ中,脱除1molNO转移6mol电子 C、脱除NO的总反应中,氧化剂和还原剂的物质的量之比为4:5 D、图1总反应的化学方程式为4NO+4NH3+O24N2+6H2O -
17、工业上以氨基丙醇(H2NCH2CH2CH2OH)和乙二酸为原料电解,制备氨基丙酸和乙醛酸(HOOC-CHO)。装置如图所示,两级室之间以能透过H+的阳离子交换膜隔开。电解过程中温度保持不变。下列说法不正确的是
 A、Pb电极为阴极,H+通过离子交换膜从左室迁移至右室 B、反应过程中两室pH均变小 C、若将两电极材料互换,会使两种产品产量下降 D、PbO2电极上的电极反应:H2NCH2CH2CH2OH + H2O -4e-= H2NCH2CH2COOH + 4H+
A、Pb电极为阴极,H+通过离子交换膜从左室迁移至右室 B、反应过程中两室pH均变小 C、若将两电极材料互换,会使两种产品产量下降 D、PbO2电极上的电极反应:H2NCH2CH2CH2OH + H2O -4e-= H2NCH2CH2COOH + 4H+ -
18、硼及其化合物在材料制造、有机合成等方面应用广泛。图(a)为一种无限长单链状结构的多硼酸根,图(b)硼氢化钠晶胞结构。下列说法正确的是
 A、图a中多硼酸根的化学式为 [BO3] B、硼氢化钠晶体中BH周围紧邻且等距的Na+数为4 C、图(a)中O-B-O的键角大于BH中的H-B-H的键角 D、硼氢化钠晶体属于混合晶体,有较强的还原性
A、图a中多硼酸根的化学式为 [BO3] B、硼氢化钠晶体中BH周围紧邻且等距的Na+数为4 C、图(a)中O-B-O的键角大于BH中的H-B-H的键角 D、硼氢化钠晶体属于混合晶体,有较强的还原性 -
19、工业通过高温煅烧焦炭与SrSO4(硫酸锶)混合物,并通入一定量的空气,采用反应一或反应二制备SrS(s):
反应一:SrSO4(s) + 2C(s) 2CO2(g) + SrS(s) ΔH1
反应二:SrSO4(s) + 4CO(g) 4CO2(g) + SrS(s) ΔH2 = -118.8kJ·mol−1
已知:CO2(g) + C(s) = 2CO(g) ΔH3 = +172.5kJ·mol−1
C(s) + O2(g) = CO2(g) ΔH4 = -393.5kJ·mol−1
随温度升高,反应产物种类、物质的量的变化如图所示:
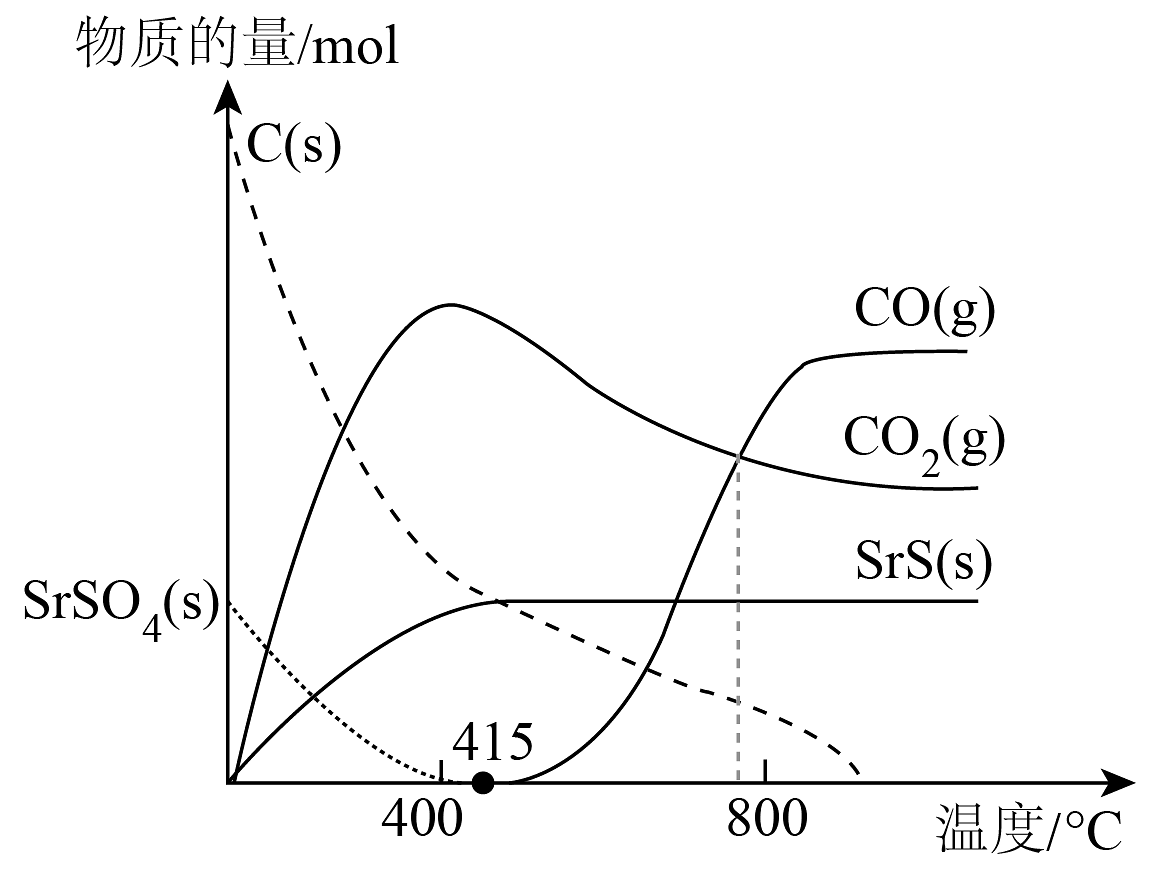
下列说法正确的是
A、ΔH1 = -226.2kJ·mol−1 B、800℃时,反应二的平衡常数K<1 C、当温度高于415℃时,体系内的主反应变为SrSO4(s)+ 4C(s)= 4CO(g)+ SrS(s) D、通入空气的作用是只是利用CO和O2反应放出的热量为制备过程供能 -
20、有机物P是一种治疗心律失常的药物,其部分合成路线如图所示(部分反应条件已略去)。

下列说法中错误的是
A、M→N为取代反应 B、M与溴水反应最多消耗 C、P完全氢化后有4个手性碳 D、P不能使酸性高锰酸钾溶液褪色